- 1.18 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第六章 化学反应与能量
第一节 化学反应与能量变化
第1课时 化学能与热能
课前自主预习
一、化学能与热能的相互转化
1.放热反应
(1)定义:放出热量的化学反应。
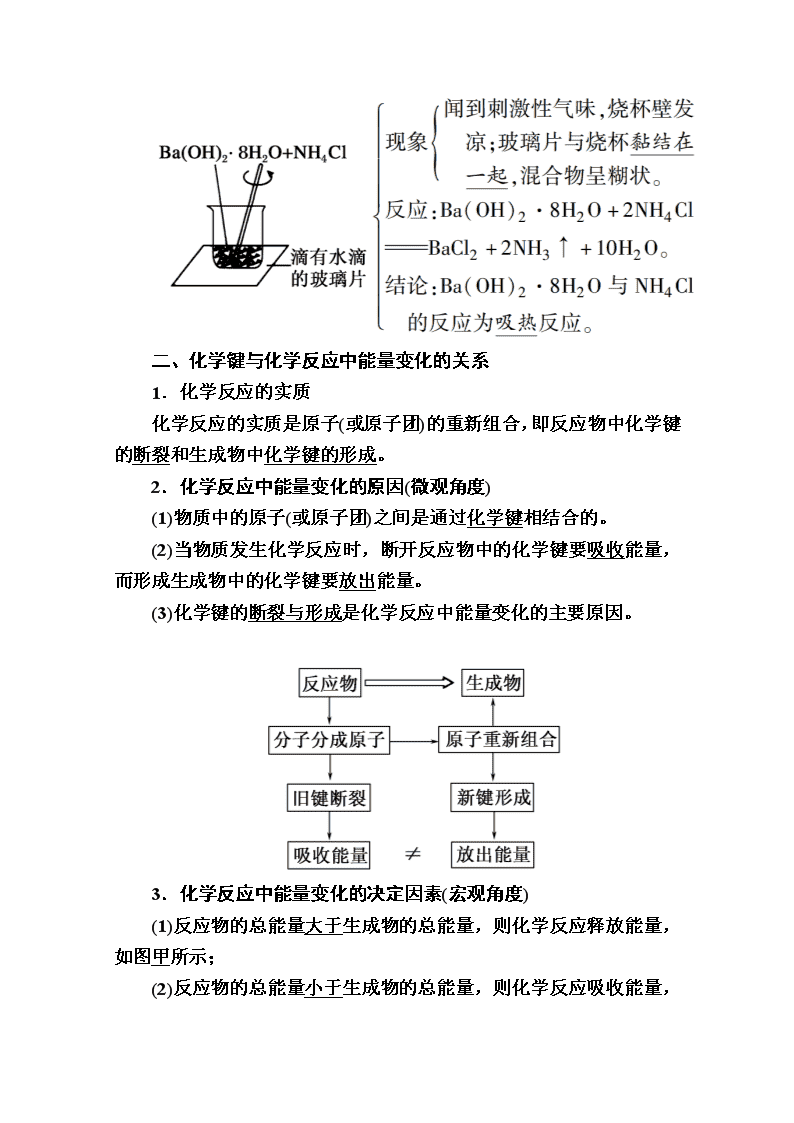
(2)实验探究:
②离子反应:Mg+2H+===Mg2++H2↑
③结论:Mg与盐酸反应为放热反应。
2.吸热反应
(1)定义:吸收热量的反应。
(2)实验探究:
二、化学键与化学反应中能量变化的关系
1.化学反应的实质
化学反应的实质是原子(或原子团)的重新组合,即反应物中化学键的断裂和生成物中化学键的形成。
2.化学反应中能量变化的原因(微观角度)
(1)物质中的原子(或原子团)之间是通过化学键相结合的。
(2)当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
(3)化学键的断裂与形成是化学反应中能量变化的主要原因。
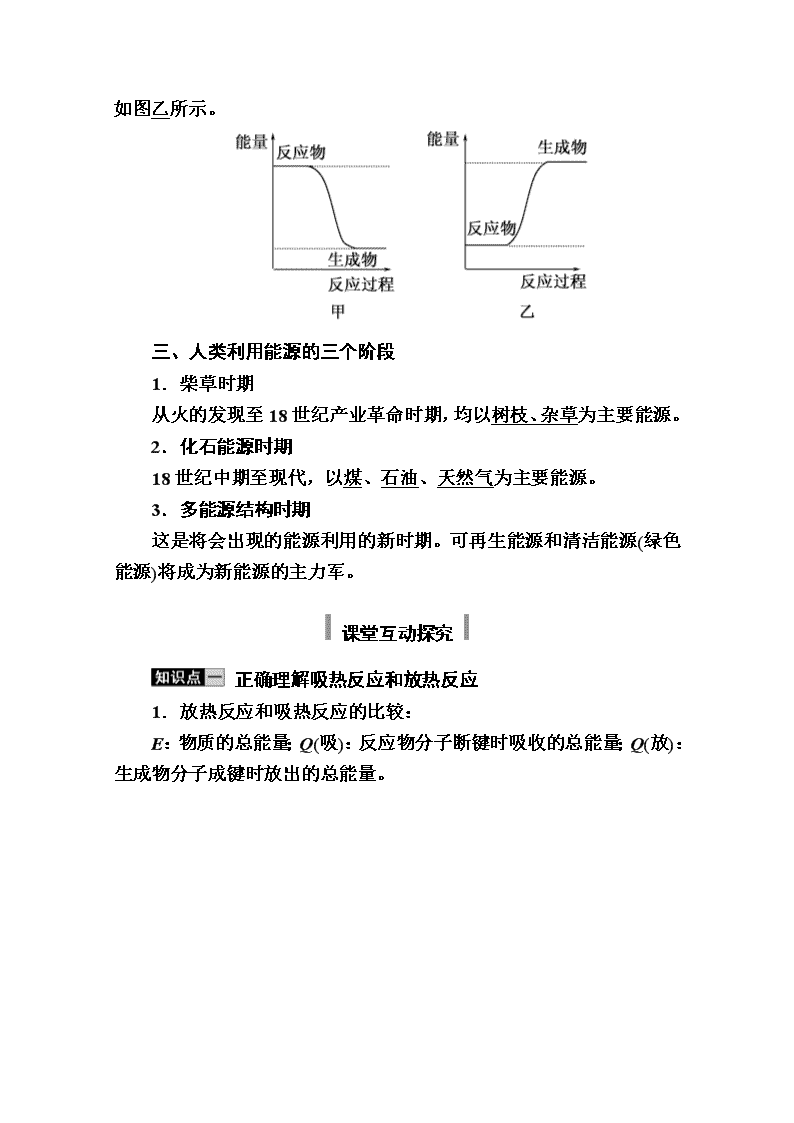
3.化学反应中能量变化的决定因素(宏观角度)
(1)反应物的总能量大于生成物的总能量,则化学反应释放能量,如图甲所示;
(2)反应物的总能量小于
生成物的总能量,则化学反应吸收能量,如图乙所示。
三、人类利用能源的三个阶段
1.柴草时期
从火的发现至18世纪产业革命时期,均以树枝、杂草为主要能源。
2.化石能源时期
18世纪中期至现代,以煤、石油、天然气为主要能源。
3.多能源结构时期
这是将会出现的能源利用的新时期。可再生能源和清洁能源(绿色能源)将成为新能源的主力军。
课堂互动探究
正确理解吸热反应和放热反应
1.放热反应和吸热反应的比较:
E:物质的总能量;Q(吸):反应物分子断键时吸收的总能量;Q(放):生成物分子成键时放出的总能量。
2.常见的放热反应和吸热反应:
3.吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,否则是吸热反应。
(2)根据化学键破坏或形成时的能量变化判断——用于计算。若破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量,属于放热反应,否则是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。
(4)根据反应条件判断。
凡是持续加热才能进行的反应一般就是吸热反应。
特别注意:化学反应是吸热反应还是放热反应与反应条件无必然的关系。具体如下:
利用化学键计算化学反应中的能量变化
1.化学键与能量变化的关系:
2.计算公式的推导分析:
以H2+Cl2===2HCl为例:
(1)图示分析:
(2)计算分析:
3.计算公式:
用Q(吸)表示反应物分子断裂时吸收的总能量,Q(放)表示生成物分子成键时放出的总能量。
公式:ΔQ=Q(吸)-Q(放)
利用化学键的能量变化计算化学反应中的能量变化:
ΔQ=Q(吸)-Q(放)
典例题组训练
题组一 放热反应与吸热反应
1.下列变化中属于吸热反应的是( B )
①液态水汽化
②将胆矾加热变为白色粉末
③苛性钠固体溶于水
④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥干冰升华
A.①④ B.②④
C.③⑤ D.④⑥
解析:注意吸热或放热过程与吸热反应或放热反应的区别。①③⑥均为物理变化,不属于吸热反应。②CuSO4·5H2O受热分解生成CuSO4和H2O,属于吸热反应。④KClO3分解是吸热反应。⑤是放热反应。
2.如图所示,在小试管里加入2 g新制备的无水硫酸铜,把小试管套在具支试管内。在U形管内加入少量红墨水。打开T形管螺旋夹,使U形管内两边的液面处于同一水平面。再夹紧螺旋夹,把水滴入小试管内,白色的无水硫酸铜完全变成蓝色的五水硫酸铜晶体,可观察到U形管右侧的液面下降,左侧的液面上升。
(1)①写出上述反应的化学方程式:CuSO4+5H2O===
CuSO4·5H2O。
②该反应是放热(填“吸热”或“放热”)反应。
③反应中的无水硫酸铜和水具有的总能量大于(填“大于”或“
小于”)五水硫酸铜晶体的总能量。
(2)如果U形管内两边的液面处于同一水平面后,在小试管内先加入Ba(OH)2·8H2O晶体,再加入NH4Cl固体,用玻璃棒不断搅拌,则可观察到U形管中的现象为U形管右侧液面上升,左侧液面下降。
解析:(1)滴入水后,CuSO4+5H2O===CuSO4·5H2O,现象是U形管右侧液面下降,左侧液面上升,可知是具支试管内气体受热膨胀,压强增大所致,所以此反应是放热反应,CuSO4和H2O的总能量大于CuSO4·5H2O的总能量。
(2)Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O,反应吸热,导致具支试管内气体压强减小,U形管中右侧液面上升,左侧液面下降。
1.常见的放热反应
(1)所有的燃烧反应,剧烈的发光、发热的化学反应;
(2)酸碱中和反应;
(3)大多数的化合反应;
(4)铝热反应;
(5)活泼金属与酸或H2O的反应。
2.常见的吸热反应
(1)氢氧化钡晶体与氯化铵固体的反应;
(2)大多数的分解反应;
(3)碳与水蒸气的反应;
(4)以C、H2、CO为还原剂的氧化还原反应。
题组二 化学能与热能的相互转化
3.(双选)根据下面的信息,判断下列叙述中正确的是( AD )
A.氢气跟氧气反应生成水的同时释放能量
B.氢气跟氧气反应生成水的同时吸收能量
C.1 mol H2跟1/2 mol O2反应生成1 mol H2O一定释放能量245 kJ
D.2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ
解析:由图中信息可知,1 mol H2(g)的共价键断裂吸收能量436 kJ,1/2 mol O2(g)的共价键断裂吸收能量249 kJ,两项共吸收能量685 kJ;2 mol H(g)与1 mol O(g)形成1 mol H2O(g)的共价键释放能量930 kJ。在1 mol H2(g)+1/2 mol O2(g)→1 mol H2O(g)的过程中,放出的能量比吸收的能量多245 kJ。C项所陈述的内容中缺少物质的状态,所以释放的能量不一定是245 kJ;D项释放的能量=2×(930-436-249)=490 kJ,故D正确。
4.(双选)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是( BC )
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合不能直接生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
解析:通常情况下,N2比NO稳定,A错误;放电条件下,N2(g)和O2(g)才能反应生成NO,B正确;由图知1 mol N2(g)和1 mol O2(g)反应吸收的热量为946 kJ+498 kJ-2×632 kJ=180 kJ,则1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,C正确,D错误。
(1)键能:共价键的键能是指生成1 mol共价键所放出的能量或破坏1 mol共价键所消耗的能量。
(2)键能与物质的稳定性:键能越大,共价键越牢固,形成的物质越稳定,则该物质本身所具有的能量越低。
题组三 能源
5.H2是一种很有前途的能源,以水为原料大量制取H2
,最理想的途径是( A )
A.利用太阳能直接使水分解为H2
B.以焦炭和水为原料制水煤气后再分离出H2
C.以赤热的Fe和水反应生成H2
D.由热电厂提供电能,利用直流电电解水产生H2
解析:B项,C+H2O(g)CO+H2;C项,3Fe+4H2O(g)
Fe3O4+4H2;D项,2H2O2H2↑+O2↑,B、C、D三项都要消耗传统能源。而A项中太阳能是已被人们使用的新能源,与传统能源相比较,太阳能的优点很多,而且是一般传统能源无法比拟的。
6.有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。观察下面图示,判断在此构想的物质循环中,太阳能最终转化为( B )
A.化学能 B.热能 C.生物质能 D.电能
解析:理解图示的转化关系便可顺利解题。关键信息是利用太阳能使CO2、H2O、N2等重新组合,根据图示可知燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。故选B。
核心素养
常见的放热反应与吸热反应
提醒:①化学反应的能量变化主要表现为放热或吸热,但这并不是唯一的表现形式,其他的还有发光、放电等。
②
化学反应表现为吸热或放热,与反应的条件没有必然关系,而是取决于反应物和生成物具有的总能量(或焓)的相对大小。
③化学反应表现为吸热或放热,与反应开始时是否需要加热无关。需要加热的反应不一定是吸热反应,如C+O2CO2为放热反应;不需要加热的反应也不一定是放热反应,如Ba(OH)2·8H2O与NH4Cl的反应为吸热反应。
【例】 (双选)如图是化学反应中物质变化和能量变化的示意图。若E1>E2,则下列反应符合该示意图的是( )
A.NaOH溶液与稀盐酸的反应
B.锌与稀盐酸的反应
C.氢氧化钡与氯化铵固体的反应
D.一氧化碳还原CuO的反应
【解析】 吸收的能量E1大于释放的能量E2,故该反应为吸热反应。NaOH溶液与稀盐酸的反应属于放热反应,故A错误;锌与稀盐酸的反应属于放热反应,故B错误;氢氧化钡与氯化铵固体的反应属于吸热反应,故C正确;一氧化碳还原CuO的反应属于吸热反应,故D正确。
【答案】 CD
相关文档
- 2019-2020学年新教材高中化学课后2021-07-088页
- 2021山西运城市高中联合体高三10月2021-07-088页
- 2020高中化学第二章烃和卤代烃第三2021-07-089页
- 2020_2021学年新教材高中化学第2章2021-07-088页
- 高中化学第五章化工生产中的重要非2021-07-085页
- 高中化学:1-4-1《研究有机化合物的2021-07-0812页
- 2021年1月重庆市普通高中学业水平2021-07-0810页
- 2020版高中化学课时作业1元素周期2021-07-086页
- 高中物理 第13章 第2节全反射课件 2021-07-0843页
- 2019-2020学年高中化学课时作业3核2021-07-087页