- 163.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课后作业(十九)
[基础巩固]
一、元素周期表的结构
1.下列说法正确的是( )
A.常用元素周期表中元素排序的依据是原子的核电荷数
B.元素周期表有16个纵行,也就是16个族
C.原子的最外层电子数相同的元素,一定属于同一族
D.电子层数相同的粒子,对应元素一定属于同一周期
[解析] 元素周期表中有18个纵行,16个族,第Ⅷ族占3个纵行;Be和He的最外层电子数都是2,但不属于同一族;Ne和Na+的电子层数都是2,但不属于同一周期。
[答案] A
2.主族元素在周期表中的位置取决于该元素的( )
A.相对原子质量和核外电子数
B.电子层数和最外层电子数
C.相对原子质量和最外层电子数
D.电子层数和次外层电子数
[解析] 对主族元素而言,其电子层数就是该元素在元素周期表中的周期序数;其最外层上的电子数就是该元素在周期表中的族序数;由该元素在周期表中的周期和族决定元素的位置。
[答案] B
3.元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )
A.该元素的名称是钠
B.该元素的原子序数为11
C.该元素在地壳中的含量为22.99%
D.该元素的元素符号为Na
[解析]
8
据图可知,该元素的名称是钠,其元素符号为Na,原子序数为11,相对原子质量为22.99,故选C。
[答案] C
二、元素周期表的应用
4.已知元素的原子序数,可以推断元素原子的( )
①质子数 ②核电荷数 ③核外电子数 ④离子所带电荷数
A.①③ B.②③ C.①②③ D.②③④
[解析] 原子序数=核电荷数=质子数=核外电子数。
[答案] C
5.几种粒子具有相同的核电荷数,则可说明( )
A.可能属于同一种元素
B.一定是同一种元素
C.一定有相同的原子序数
D.核外电子数一定相等
[解析] 粒子可能是分子、原子、离子,虽然具有相同的核电荷数,但不一定是同一种元素,如CH4与H2O,B错误。核外电子数不一定相等,如Na与Na+、F与F-等,D错误。粒子种类未确定,则不能判定一定是原子,故C不正确。
[答案] A
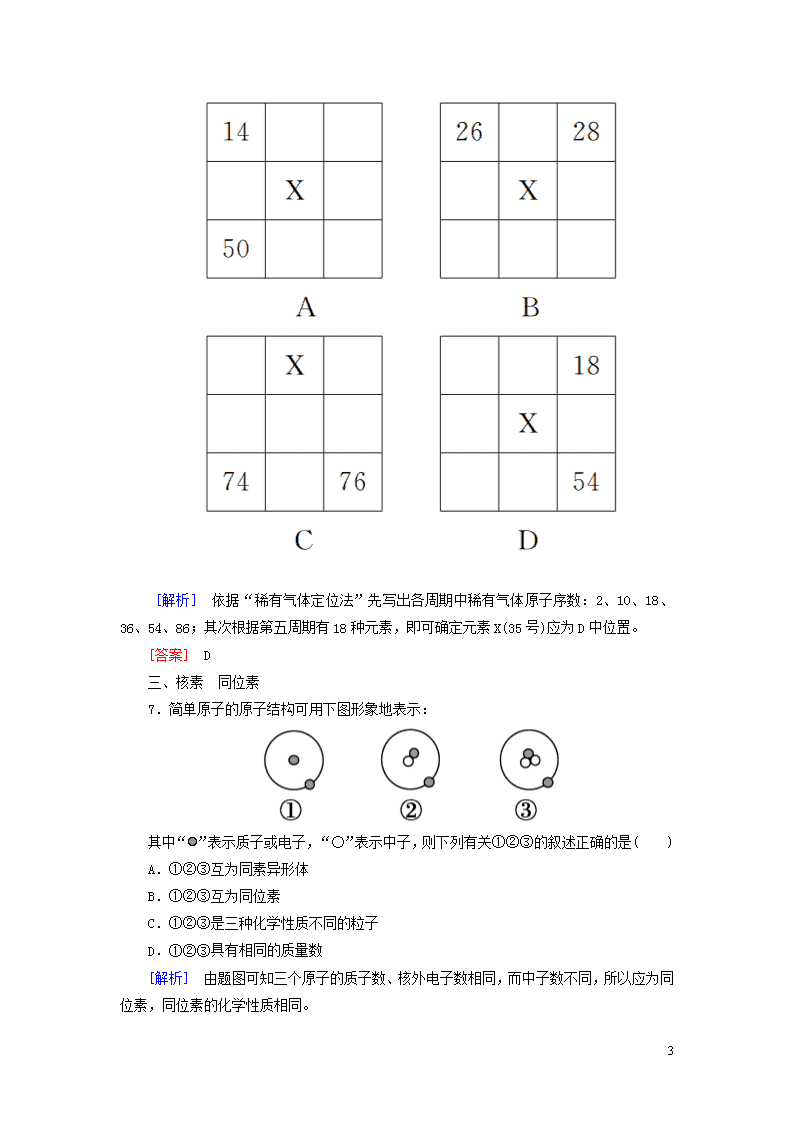
6.下图各为元素周期表的一部分(数字为原子序数),其中X为35的是( )
8
[解析] 依据“稀有气体定位法”先写出各周期中稀有气体原子序数:2、10、18、36、54、86;其次根据第五周期有18种元素,即可确定元素X(35号)应为D中位置。
[答案] D
三、核素 同位素
7.简单原子的原子结构可用下图形象地表示:
其中“”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A.①②③互为同素异形体
B.①②③互为同位素
C.①②③是三种化学性质不同的粒子
D.①②③具有相同的质量数
[解析] 由题图可知三个原子的质子数、核外电子数相同,而中子数不同,所以应为同位素,同位素的化学性质相同。
8
[答案] B
8.下列说法正确的是( )
A.有H、D、T与16O、17O、18O构成的水分子的相对分子质量有18个
B.H2、D2、T2互为同素异形体
C.H2、D2、T2在相同条件下的密度比为1∶2∶3
D.氕、氘发生核聚变反应生成其他元素,属于化学变化
[解析] H、D、T组合H2、D2、T2、HD、HT、DT共6种,分别与16O、17O、18O构成的水分子共有6×3=18种,但其中有相对分子质量相同的分子,故构成的水分子的相对分子质量个数小于18,A错误;H2、D2、T2均为氢气单质,属于一种物质,B错误;H2、D2、T2在相同条件下的密度比等于气体相对分子质量之比,为2∶4∶6=1∶2∶3,C正确;氕、氘发生核聚变反应生成其他元素,属于核反应,不是化学变化,D错误。
[答案] C
[能力提升]
9.两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为( )
①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6
⑥m-12 ⑦m+14
A.①②④⑤ B.①②③⑤
C.①②③④⑤ D.①②③④⑤⑥⑦
[解析] 两种短周期元素X和Y可组成化合物XY3,则X为ⅢA族元素时,Y为ⅤⅡA族元素;或X、Y均为ⅥA族元素;还有可能为X在ⅤA族,Y为ⅤⅡA族或H;①若Y为Cl,X为Al,则X的原子序数为m-4,故①正确;②若Y为F,X为Al,则X的原子序数为m+4,故②正确;③若Y为S,X为O,则X的原子序数为m+8,故③正确;④若Y为Cl,X为P,则X的原子序数为m-2,故④正确;⑤若Y为H,X为N,则X的原子序数为m+6,故⑤正确;⑥若Y为Cl,X为N,则X的原子序数为m-12,故⑥正确;⑦若Y为H,X为P,则X的原子序数为m+14,故⑦正确;故答案为D。
[答案] D
10.0.05 mol某金属单质与足量的盐酸反应,放出1.12 L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A.第三周期ⅠA族 B.第三周期ⅡA族
C.第四周期ⅠA族 D.第四周期ⅡA族
[解析] 设该金属单质与盐酸反应所表现的化合价为+x价,则0.05x=×2,x=2。根据题意,该金属单质为Ca,位于第四周期ⅡA族。
8
[答案] D
11.据相关报道,在日本生产的婴儿奶粉中检测到铯的人工放射性核素。下列说法正确的是 ( )
A.133Cs的核电荷数为133
B.133Cs+核外有54个电子
C.133Cs质子数比137Cs少4个
D.铯与水的反应比钠与水的反应缓慢
[解析] A项,核电荷数等于原子序数为55,错误;B项正确;C项,质子数决定元素种类,133Cs和137Cs质子数相等,错误;D项,Cs的金属性比Na强,与水反应更剧烈,错误。
[答案] B
12.X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。已知X、Y、Z三种元素的质子数之和为40,则X、Y、Z分别是( )
X
Y
Z
A.N、S、Cl B.B、Si、P
C.C、P、S D.Be、Al、Si
[解析] 设Y的质子数为n,则X、Z的质子数分别为n-8-1,Z为n+1。由题意知,n-8-1+n+n+1=40,n=16,即Y为硫元素,X为氮元素,Z为氯元素。
[答案] A
13.结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。
8
(2)表中所列元素,属于短周期元素的有________,属于主族元素的有________;g元素位于第________周期第________族;i元素位于第________周期第________族。
(3)元素f是第________周期第________族元素,请在下面方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
[解析] (1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期各有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。由此可画出周期表的边界。(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。(3)第三周期笫ⅥA族元素为硫,原子序数为16,相对原子质量为32。
[答案] (1)
(2)a、b、c、d、e、f、g a、b、d、c、e、f 三 0 四 ⅡB
(3)三 ⅥA
14.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为________,该原子的核外电子数为________。
8
(2)以下关于Fe的叙述正确的是________(填字母)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是________________________________________________。
[解析] (1)Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。(2)Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素;Fe元素不是一种新元素,Fe衰变放出两个质子后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质。
[答案] (1)19 26 (2)AC
(3)Fe与Fe的核外电子排布相同,化学性质几乎完全相同
15.下表是元素周期表的一部分,针对表中的①~⑨9种元素,填写下列空白:
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
二
①
②
③
三
④
⑤
⑥
⑦
⑧
四
⑨
(1)写出元素符号和名称:
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑦的单质跟④的氢氧化物溶液反应:_____________________。
⑤的氧化物跟④的氢氧化物溶液反应:________________。
⑥的单质在③的单质中燃烧:__________________。
[解析] 根据元素周期表的位置可推知:①~⑨分别为C、N、O、Na、Al、S、Cl、Ar、K。
[答案] (1)①C碳 ②N氮 ⑧Ar氩 ⑨K钾
(2)Cl2+2NaOH===NaCl+NaClO+H2O
Al2O3+2NaOH===2NaAlO2+H2O S+O2SO2
8
8
相关文档
- 2020版高中化学课时作业1元素周期2021-07-086页
- 2020版高中化学课时作业5元素周期2021-07-085页
- 2021高考化学一轮复习课时达标作业2021-07-088页
- 2019届二轮复习原子结构元素周期表2021-07-087页
- 2019-2020学年高中化学作业6元素周2021-07-086页
- 第一节 元素周期表 教案22021-07-083页
- 2019届二轮复习元素周期律元素周期2021-07-087页
- 2021高考化学一轮复习专题5第2讲元2021-07-0878页
- 高中化学鲁科版选修3课后练习:1-2-22021-07-084页
- 2019届一轮复习人教版元素周期律元2021-07-085页