- 525.24 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
太和一中2019-2020学年度第一学期高三年级校本教材反馈测试
化学试卷
考试范围:化学基本概念、金属及其化合物 考试时间:90分钟 满分:100分
可能用到相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Ba 137
第I卷(选择题 共42分)
一、单选题(本大题共21小题,每题2分)
1.下列有关操作的说法不正确的是( )
A.《本草经集注》记载了鉴别硝石(KNO3)和朴硝(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,此处运用了物质升华的性质
B.《本草纲目》记载了烧酒的制作工艺:“凡酸坏之酒,皆可蒸烧”,此处用到的操作是蒸馏
C.《肘后备急方》一书中有“青蒿一握,以水二升渍,绞其汁”,此处用到的操作是溶解
D.唐诗有“千淘万漉虽辛苦,吹尽狂沙始到金”的诗句,此处用到的操作是过滤
2.下列关于除杂方法的叙述正确的是( )
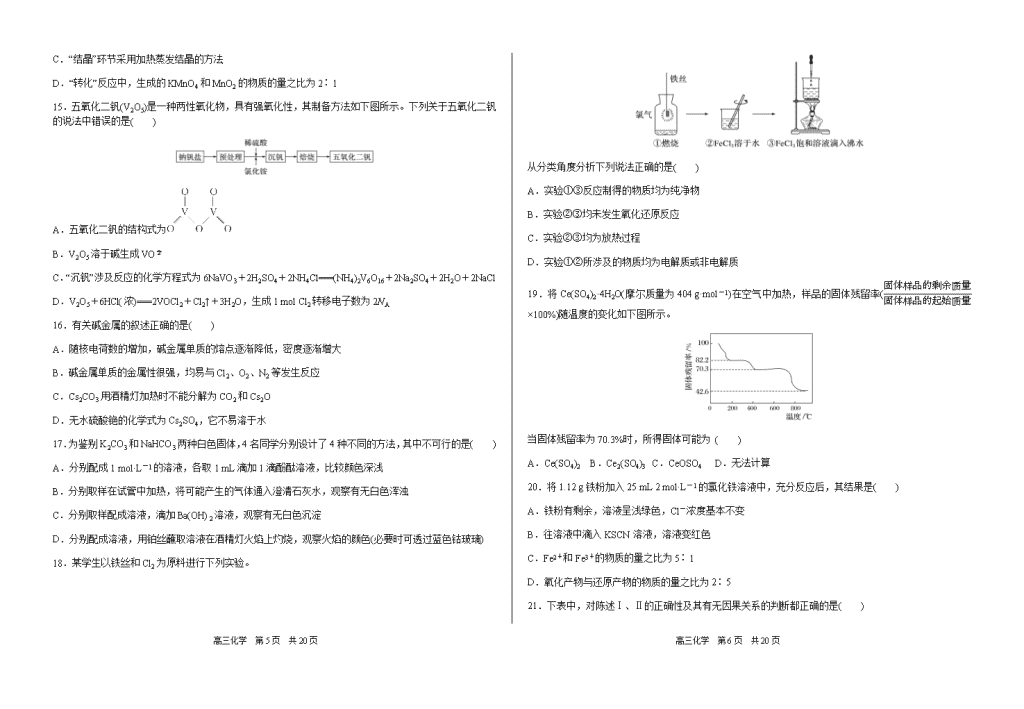
A.乙烯中混有的SO2可以通过溴水除去
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤洗涤
C.向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3
D.除去NaCl溶液中少量的Na2S:加入AgCl后再过滤
3.下列实验所选择的装置或仪器都正确的是( )
选项
A
B
C
D
实验
分离植物油和氯化钠溶液
除去氯化钠晶体中混有的氯化铵晶体
分离CCl4中的Br2
除去CO2气体中的HCl气体
装置或仪器
4.在蒸馏操作中,仪器选择及安装都正确的是( )
5.如图表示1 g O2与1 g气体X在相同容积的密闭容器中压强(p)与温度(T)的关系,则气体X可能是( )
A.C2H4 B.CH4 C.NO D.CO2
6.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.32 g S8(分子结构:)中的共价键数目为NA
B.2 g由H218O和2H2O组成的物质中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
7.下列有关实验原理或操作正确的是( )
A.用20 mL量筒量取15 mL酒精,加5 mL水,配制质量分数为75%的酒精溶液
B.在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子和NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C.实验中需用950 mL 2.0 mol·L-1Na2CO3溶液,配制时选用的容量瓶的规格和称取的Na2CO3的质量分别为950 mL、201.4 g
高三化学 第19页 共20页 高三化学 第20页 共20页
D.实验室配制500 mL 0.2 mol·L-1硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
8.把200 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为( )
A.(10b-5a)mol·L-1 B.(2b-a)mol·L-1
C.(-)mol·L-1 D.(5b-)mol·L-1
9.能正确表达下列反应的离子方程式为( )
A.用醋酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS===H2S↑+Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO===Al2(CO3)3↓
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-===NO+NO+H2O
10.某溶液中可能存在Br-、CO、SO、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是( )
A.Al3+、Mg2+、SO B.Mg2+、CO、I-
C.Al3+、SO、I- D.Al3+、Br-、SO
11.O2F2可以发生反应:H2S+4O2F2===SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1∶4
12.将0.1 mol Cl2通入100 mL含等物质的量的HBr与H2SO3的混合溶液中,有一半的HBr被氧化,则下列说法正确的是( )
A.物质的还原性:HBr>H2SO3>HCl
B.HBr与H2SO3的物质的量浓度均为0.6 mol·L-1
C.通入0.1 mol Cl2发生反应的离子方程式为5Cl2+4H2SO3+2Br-+4H2O===4SO+Br2+10Cl-+16H+
D.若再通入0.05 mol Cl2,恰好能将HBr和H2SO3完全氧化
13.实验室制备NaClO2的装置如下图,其中C装置内生成ClO2,下列说法正确的是( )
A.实验开始时,应打开分液漏斗的活塞及弹簧夹乙,关闭弹簧夹甲
B.可用98.3%硫酸代替75%硫酸
C.H2O2是制备 NaClO2反应的还原剂
D.F中的试剂可用饱和Ca(OH)2溶液
14.以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:
下列说法正确的是( )
A.“灼烧”可在石英坩埚中进行
B.母液中的溶质是K2CO3、KHCO3、KCl
高三化学 第19页 共20页 高三化学 第20页 共20页
C.“结晶”环节采用加热蒸发结晶的方法
D.“转化”反应中,生成的KMnO4和MnO2的物质的量之比为2∶1
15.五氧化二钒(V2O5)是一种两性氧化物,具有强氧化性,其制备方法如下图所示。下列关于五氧化二钒的说法中错误的是( )
A.五氧化二钒的结构式为
B.V2O5溶于碱生成VO
C.“沉钒”涉及反应的化学方程式为6NaVO3+2H2SO4+2NH4Cl===(NH4)2V6O16+2Na2SO4+2H2O+2NaCl
D.V2O5+6HCl(浓)===2VOCl2+Cl2↑+3H2O,生成1 mol Cl2转移电子数为2NA
16.有关碱金属的叙述正确的是( )
A.随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大
B.碱金属单质的金属性很强,均易与Cl2、O2、N2等发生反应
C.Cs2CO3用酒精灯加热时不能分解为CO2和Cs2O
D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
17.为鉴别K2CO3和NaHCO3两种白色固体,4名同学分别设计了4种不同的方法,其中不可行的是( )
A.分别配成1 mol·L-1的溶液,各取1 mL滴加1滴酚酞溶液,比较颜色深浅
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
18.某学生以铁丝和Cl2为原料进行下列实验。
从分类角度分析下列说法正确的是( )
A.实验①③反应制得的物质均为纯净物
B.实验②③均未发生氧化还原反应
C.实验②③均为放热过程
D.实验①②所涉及的物质均为电解质或非电解质
19.将Ce(SO4)2·4H2O(摩尔质量为404 g·mol-1)在空气中加热,样品的固体残留率(×100%)随温度的变化如下图所示。
当固体残留率为70.3%时,所得固体可能为 ( )
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4 D.无法计算
20.将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入KSCN溶液,溶液变红色
C.Fe2+和Fe3+的物质的量之比为5∶1
D.氧化产物与还原产物的物质的量之比为2∶5
21.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( )
高三化学 第19页 共20页 高三化学 第20页 共20页
选项
陈述Ⅰ
陈述Ⅱ
判断
A
铜绿的主要成分是碱式碳酸铜
可用稀盐酸除去铜器表面的铜绿
Ⅰ对;Ⅱ对;无
B
铜表面易形成致密的氧化膜
铜制容器可以盛放浓硫酸
Ⅰ对;Ⅱ对;有
C
向硫酸铜溶液中通入少量氨气,有蓝色沉淀产生,过滤后灼烧滤渣,最后变成黑色固体
把铜丝放在酒精灯火焰上灼烧,铜丝表面变黑
Ⅰ对;Ⅱ对;有
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ错;Ⅱ对;无
高三化学 第19页 共20页 高三化学 第20页 共20页
第II卷(非选择题 共58分)
二、填空题
22.(10分)人体血液里Ca2+的浓度一般采用m g·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】如图是配制50 mL KMnO4标准溶液的过程示意图。
(1)请你观察图示判断,其中不正确的操作有________(填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将________(填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸与KMnO4反应的离子方程式为:
2MnO+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O
则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________ mg·cm-3。
23.(16分)5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水。
阳离子
Na+
Al3+
Fe3+
Cu2+
Ba2+
阴离子
OH-
Cl-
CO
NO
SO
分别取它们的水溶液进行实验,结果如下:
① A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
高三化学 第19页 共20页 高三化学 第20页 共20页
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1 H2SO4,Cu片逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、B、C、D、E的化学式:A________;B________;C________;D________;E________。
(2)写出步骤②中发生反应的离子方程式:__________________________________________
______________________________________________________________________________。
(3)写出步骤⑤中发生反应的离子方程式:__________________________________________
______________________________________________________________________________。
若要将Cu片完全溶解,至少加入稀H2SO4的体积是________mL。
24.(12分)钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用,从钛白水解工业废酸(含Sc3+、TiO2+、Mn2+、H+、SO等离子)中提取氧化钪(Sc2O3)的一种流程如图:
请回答下列问题:
(1)在钛白水解工业废酸中,加入H2O2是为了使TiO2+转化为难萃取的[Ti(O2)(OH)(H2O)4]+,
[Ti(O2)(OH)(H2O)4]+中Ti的化合价为________。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如下图,应选择的合适O/A值为________。
温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~15 ℃,其理由是
________________________________________________________________________。
T/℃
5
10
15
25
30
钪的萃取率/%
91.3
96
97.1
97.3
98.0
钛的萃取率/%
0.94
0.95
2.10
3.01
4.20
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣Ⅰ,写出该反应的离子方程式__________________。
(4)草酸钪“灼烧”的化学方程式为________________________________________________。
(5)若该钛白水解废酸中含Sc3+的浓度为16 mg·L-1,从1 m3该废酸中提取得到21.6 g Sc2O3,则钪的提取率为________(保留两位有效数字)。
高三化学 第19页 共20页 高三化学 第20页 共20页
25.(20分)某铝合金中含有元素镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品ag,称量时应该使用的主要仪器的名称是 。
(2)将样品溶解于足量的稀盐酸,过滤。滤液中主要含有 ,滤渣中含有________________________________________________________________________,
溶解、过滤用到的玻璃仪器是___________________________________________。
(3)向滤液中加入过量氢氧化钠溶液、过滤。有关反应的离子方程式是________________________________________________________________________。
(4)向步骤(3)的滤液中通入足量二氧化碳气体,过滤。有关反应的离子方程式是________________________________________________________________________。
(5)步骤(4)过滤后的滤渣用蒸馏水洗涤数次,烘干并灼烧至恒重,冷却后称量,其质量为bg。有关反应的化学方程式是_________________________________________,
原样品中铝的质量分数是 。
(6)若步骤(3)中加入氢氧化钠的量不足,则实验结果 (填“偏高”“偏低”或“不影响”,下同);若步骤(5)中滤渣没有洗涤,则实验结果 ;若滤渣的灼烧不充分,则实验结果 。
高三化学 第19页 共20页 高三化学 第20页 共20页
太和一中2019-2020学年度第一学期高三年级校本教材反馈测试
化学答案
第I卷(选择题 共48分)
1.答案 A
解析 钾元素的焰色反应为紫色,钠元素的焰色反应为黄色,则硝石(KNO3)和朴硝(Na2SO4)可通过焰色反应来鉴别,A项错误;《本草纲目》中“凡酸坏之酒,皆可蒸烧”,酸坏之酒中含有乙酸,利用乙酸和乙醇的沸点不同进行分离,该操作为蒸馏,B项正确;“以水二升渍”中的“渍”即为浸泡溶解,C项正确;诗句中的“淘”和“漉”的原理和过滤的原理相同,D项正确。
2.答案 D
解析 A项,乙烯能与溴水反应;B项,BaCO3能溶于盐酸,被提纯的物质不易复原;C项,会引入新的杂质Ca2+,应加入MgCO3或MgO等除杂;D项,Na2S和AgCl反应生成Ag2S和NaCl,过滤除去Ag2S和剩余的AgCl,达到除杂的目的。
3.答案 A
解析 植物油和氯化钠溶液互不相溶,可用分液法分离,A项正确;除去氯化钠晶体中混有的氯化铵晶体应用加热分解法,而不能用蒸馏法,B项错误;分离CCl4中的Br2应用蒸馏法,不能用过滤法,C项错误;NaOH溶液可以同时吸收CO2和HCl,D项错误。
4.答案 B
解析 蒸馏操作中,需要测定馏分的温度,所以温度计水银球应放在蒸馏烧瓶的支管口处,B和C中温度计位置均正确,但C中的冷凝装置为球形冷凝管,它一般用作反应装置,主要用于冷凝回流,使反应更彻底,故只有B项正确。
5.答案 D
解析 根据阿伏加德罗定律推论,同温同容下,存在=,可得n(O2)>n(X),又因质量均为1 g,由n=可得M(X)>M(O2),故仅有D项符合题意。
6.答案 D
解析 A项,在一个S8分子中含有8个共价键,所以32 g S8中含有共价键数目为NA;B项,H218O、2H2O的摩尔质量均为20 g·mol-1,所以2 g由H218O、2H2O组成的物质中含有的质子数为NA;C项,8 g CuO被H2还原生成Cu转移电子数为×2NA mol-1=0.2NA;D项,Cl2溶于水,含氯元素的微粒有Cl2、Cl-、ClO-和HClO,Cl-、ClO-与HClO的微粒数之和应小于NA。
7.答案 B
解析 不能用量筒来配制溶液,应用烧杯,且15 mL酒精的质量不是5 mL水的质量的3倍,A项错误;1.5NA个硫酸根离子的物质的量为1.5 mol,NA个金属阳离子的物质的量为1 mol,设金属离子的化合价为x,根据电荷守恒可知,x=1.5×2=3,故金属阳离子为+3价,所以该硫酸盐可以表示为M2(SO4)3,根据硫酸根离子守恒可知,硫酸盐为0.5 mol,所以该硫酸盐的物质的量浓度为=2.5 mol·L-1,B项正确;容量瓶没有950 mL规格,应用1 000 mL的容量瓶进行配制,则m(Na2CO3)=cVM=1 L×2 mol·L-1×106 g·mol-1=212 g,C项错误;配制500 mL 0.2 mol·L-1硫酸亚铁溶液,需要绿矾(FeSO4·7H2O)的物质的量为0.5 L×0.2 mol·L-1=0.1 mol,质量为27.8 g,D项错误。
8.答案 A
解析 NH4HCO3和a mol NaOH恰好完全反应,则NH4HCO3的物质的量为0.5a mol,取另一份加入含b mol HCl的盐酸恰好反应完全,由NH4HCO3反应掉的HCl为0.5a mol,则由Na2CO3反应掉的HCl为b mol-0.5a mol,Na2CO3的物质的量为(b mol-0.5a mol)×0.5,则c(Na+)=(b mol-0.5a mol)÷0.1 L=(10b-5a)mol·L-1。
9.答案 D
解析 A项,醋酸为弱酸,离子方程式中醋酸不能拆开;B项,硫化亚铁与浓硫酸混合加热生成硫酸铁、二氧化硫和水且浓硫酸不能拆;C项,向硫酸铝溶液中滴加碳酸钠溶液发生水解相互促进反应,生成氢氧化铝和二氧化碳;D项,用氢氧化钠溶液吸收工业废气中的NO2,生成硝酸钠、亚硝酸钠和水,离子方程式正确。
10.答案 A
解析 根据①可判断溶液中有Br-和CO,根据离子共存原则,不存在Al3+、Mg2+;根据②可判断溶液中无SO;根据③不能确定是否含有I-,因为在①中氯水可能把I-氧化成IO,致使溶液不变蓝色。
11.答案 D
解析 A项,O元素的化合价由反应前的+1价变为反应后的0价,化合价降低,获得电子,所以氧气是还原产物,错误;B项,在反应中O2F2中的O元素的化合价降低,获得电子,所以该物质是氧化剂,而H2S中的S元素的化合价是-2价,反应后变为SF6中的+6价,所以H2S是还原剂,错误;C项,外界条件不明确,不能确定HF的物质的量,所以不能确定转移电子的数目,错误;D项,根据反应化学方程式可知还原剂H2S与氧化剂O2F2的物质的量之比是1∶4,正确。
12.答案 C
解析 因反应H2SO3+Br2+H2O===H2SO4+2HBr知还原性:H2SO3>HBr。0.1 mol Cl2通入100 mL含等物质的量的HBr与H2SO3的混合溶液中,有一半的HBr被氧化,设HBr的物质的量为x
高三化学 第19页 共20页 高三化学 第20页 共20页
,由得失电子守恒可知,0.1 mol×2=x×0.5×1+x×(6-4),解得x=0.08 mol。由上述分析可知,A项错误;根据上述计算,HBr的物质的量为0.08 mol,溶液的物质的量浓度为0.8 mol·L-1,B项错误;通入0.1 mol Cl2发生反应的离子方程式为5Cl2+4H2SO3+2Br-+4H2O===4SO+Br2+10Cl-+16H+,C项正确;由上述分析可知,还有0.04 mol HBr未被氧化,则再通入0.02 mol Cl2,恰好能将HBr和H2SO3完全氧化,D项错误。
13.答案 C
解析 A项,C装置中的竖直玻璃管用于平衡系统的气压并可防止堵塞。实验开始时,应打开弹簧夹甲,错误;B项,98.3%硫酸中硫酸大多以分子的形式存在,不能电离出氢离子,其与亚硫酸钠反应较慢,不能用其代替75%的硫酸,错误;C项,C中产生的ClO2通入D中后与H2O2反应生成NaClO2时,氯元素的化合价降低,被还原,故H2O2是还原剂,正确;D项,饱和Ca(OH)2溶液的浓度较低,无法充分吸收尾气中的二氧化硫和二氧化氯,错误。
14.答案 D
解析 “灼烧”时,KOH会与石英坩埚中的二氧化硅反应,A项错误;结晶后的母液中有KMnO4、KCl、KHCO3,B项错误;“结晶”环节采用加热蒸发浓缩、冷却结晶的方法,C项错误;由2H2O+3K2MnO4+4CO2===2KMnO4+MnO2↓+4KHCO3可知,氧化产物为KMnO4,还原产物为MnO2,氧化产物与还原产物的物质的量之比为2∶1,D项正确。
15.答案 B
解析 根据五氧化二钒的化学式(V2O5)及氧元素的化合价可以推出钒元素的化合价为+5价,因此A中所示的结构式正确;根据题干信息知V2O5是一种两性氧化物,既可与酸反应,也可与碱反应,其与碱的反应属于复分解反应,各元素化合价不变,故B错误;根据题目所给流程图可知,“沉钒”是使钒元素以沉淀形式析出,发生的是复分解反应,各元素化合价不发生改变,故C正确;V2O5具有强氧化性,其与盐酸反应时可将Cl-氧化成氯气,生成1 mol Cl2失去2 mol e-,D正确。
16.答案 C
17.答案 C
解析 K2CO3的水解程度比NaHCO3的大,溶液碱性较强,滴加酚酞检验,碳酸钾溶液的颜色更深,A项正确;NaHCO3不稳定,受热易分解,生成二氧化碳气体,可通入澄清石灰水,观察有无白色浑浊,B项正确;K2CO3和NaHCO3均与氢氧化钡反应生成碳酸钡白色沉淀,C项错误;二者分别含有K元素、Na元素,焰色反应现象不同,D项正确。
18.答案 B
解析 实验③得到的是氢氧化铁胶体,是混合体系,A项错误;实验②中的溶解主要是物理变化,实验③中的水解是发生复分解反应,两者均未发生氧化还原反应,B项正确;实验③中盐的水解是吸热过程,C项错误;实验①中的铁和氯气是单质,既不是电解质也不是非电解质,D项错误。
19.答案 B
解析 404×70.3%≈284,A的相对分子质量为332,B的相对分子质量为568,C的相对分子质量为252,根据质量守恒808×70.3%≈568,应选B。
20.答案 B
解析 n(Fe)==0.02 mol,n(FeCl3)=2 mol·L-1×0.025 L=0.05 mol,由反应Fe+2Fe3+===3Fe2+知,0.02 mol铁粉完全反应需要0.04 mol氯化铁。
铁完全反应,氯化铁有剩余,Cl-浓度基本不变,A错误;
氯化铁有剩余,往溶液中滴入KSCN溶液,显红色,B正确;0.02 mol Fe反应生成Fe2+为0.06 mol,Fe3+剩余0.01 mol,其物质的量之比为6∶1,C错误;氧化产物与还原产物均为氯化亚铁,Fe被氧化,氯化铁被还原,则氧化产物与还原产物的物质的量之比为1∶2,D错误。
21.答案 D
解析 稀盐酸可以与Cu2(OH)2CO3反应,而且稀盐酸不能与Cu反应,Ⅰ、Ⅱ有因果关系,A错误;铜表面不能形成致密的氧化膜,B错误;Ⅰ、Ⅱ均正确,但没有因果关系,C错误;蓝色硫酸铜晶体受热转化为白色硫酸铜粉末有新物质生成,属于化学变化,CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
22.(10分,每空2分)答案 (1)①②⑤ (2)50 mL容量瓶 (3)偏小 (4)2 (5)1.2
解析 (1)由图示可知①②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切。
(3)如果用按照图示的操作所配制的溶液进行实验,在其他操作正确的情况下,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小。
(5)血液样品中Ca2+的浓度为
=1.2 mg·cm-3。
23.(16分,每空2分)答案 (1)CuSO4 FeCl3 Ba(OH)2 Al(NO3)3 Na2CO3
(2)2Fe3++3CO+3H2O===2Fe(OH)3↓+3CO2↑
(3)3Cu+8H++2NO===3Cu2++2NO↑+4H2O 500
解析 本题主要考查离子反应。
①蓝色沉淀是氢氧化铜,白色固体是硫酸钡,据此判断A和C是硫酸铜和氢氧化钡;
②在剩余阳离子中只有Na+可以与CO
高三化学 第19页 共20页 高三化学 第20页 共20页
结合,红褐色沉淀是氢氧化铁,气体是二氧化碳,B和E中一种是碳酸钠,另一种物质是铁盐;
③说明C是氢氧化钡,D是铝盐,相应地A是硫酸铜;
④说明B是铁盐,E是碳酸钠;
⑤说明D是硝酸铝,相应地B是氯化铁。
(1)A、B、C、D、E的化学式分别为CuSO4、FeCl3、Ba(OH)2、Al(NO3)3、Na2CO3。
(2)步骤②中Fe3+与CO的水解相互促进,发生反应的离子方程式:2Fe3++3CO+3H2O===2Fe(OH)3↓+3CO2↑。
(3)步骤⑤中稀硝酸与铜发生反应,反应的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O。38.4 g Cu的物质的量为0.6 mol,消耗1.6 mol H+,需要0.8 mol H2SO4,因此,若要将Cu片完全溶解,至少加入稀H2SO4的体积是=0.5 L=500 mL。
24.(12分,每空2分)答案 (1)+4 (2)1∶4 温度为10~15 ℃时,钪的萃取率较高,且钛的萃取率较低(合理即得分) (3)Mn2++H2O2+2OH-===MnO2↓+2H2O
(4)2Sc2(C2O4)3+3O22Sc2O3+12CO2 (5)88%
解析 (1)[Ti(O2)(OH)(H2O)4]+中存在过氧根离子(O)和OH-,故化合物中Ti为+4价。
(2)在10~15 ℃钪萃取率较大,而钛的萃取率较低,钪的相对纯度较高。
(4)草酸根中碳的化合价是+3价,在灼烧草酸钪时会被氧化为CO2,则化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
(5)1 m3废酸中Sc3+的质量为16 g,21.6 g Sc2O3中钪的质量为21.6 g×≈14 g,故钪的提取率为×100%≈88%。
25.(20分,除标注外每空2分)答案:(1)托盘天平(1分)
(2)MgCl2、AlCl3、HCl Cu、Si 烧杯、玻璃棒、普通漏斗
(3)Mg2++2OH-===Mg(OH)2↓、Al3++4OH-===AlO+2H2O(4分,每个方程式2分)
(4)AlO+CO2+2H2O===Al(OH)3↓+HCO
(5)2Al(OH)3Al2O3+3H2O ×100%
(6)偏低(1分) 偏高(1分) 偏高(1分)
高三化学 第19页 共20页 高三化学 第20页 共20页
相关文档
- 【化学】河北省唐山市区县联考20202021-07-0821页
- 【化学】陕西省宝鸡中学、西安三中2021-07-0828页
- 【化学】四川省宜宾市叙州区第一中2021-07-0815页
- 湖南省长沙市长沙六中2020届高三上2021-07-085页
- 贵州省安顺市2020届高三上学期第一2021-07-0810页
- 【化学】天津市杨村第一中学2020届2021-07-0817页
- 四川省内江市高中2020届高三上学期2021-07-0810页
- 【化学】安徽省太和第一中学2019-22021-07-0817页
- 吉林省吉林市2021届高三上学期第一2021-07-0810页
- 福建省长乐市高级中学2020届高三上2021-07-089页