- 468.56 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
天津一中 2020-2021-1 高三年级化学学科 0 月考试卷
本试卷分为第 I 卷(选择题)、第 II 卷(非选择题)两部分,共 100 分,考试用时
60 分钟。第 I 卷 1 至 2 页,第 II 卷 3 至 4 页。考生务必将答案涂写规定的位置上,答 在试卷上的无效。
祝各位考生考试顺利!
C:12 N:14 O:16 Na:23 Mg :24 Fe :56
第Ⅰ卷 选择题 (单选)(共 12 道题,每题 3 分,共 36 分)
1.化学与生活、生产密切相关。下列说法正确的是 A.气象报告中的“PM2.5”是指一种胶体粒子 B.石英玻璃主要成分是硅酸盐,可制作化学精密仪器 C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 D.“天宫一号”使用的碳纤维,是一种新型有机高分子材料
2. 下列说法错误的是
A.淀粉和纤维素均可水解产生葡萄糖 B.油脂的水解反应可用于生产甘油 C.氨基酸是组成蛋白质的基本结构单元 D.淀粉、纤维素和油脂均是天然高分子
3.设 NA 为阿伏加德罗常数的值。下列叙述正确的是 A.标准状况下,22.4L CCl4 所含分子数为 NA B.常温常压下,7.8g Na2O2 晶体中阳离子和阴离子总数为 0.3NA C.7.8g 苯中含有的碳碳双键数为 0.3NA
D.室温下,1L pH=13 的 NaOH 溶液中,由水电离的 OH- 数目为 0.1NA
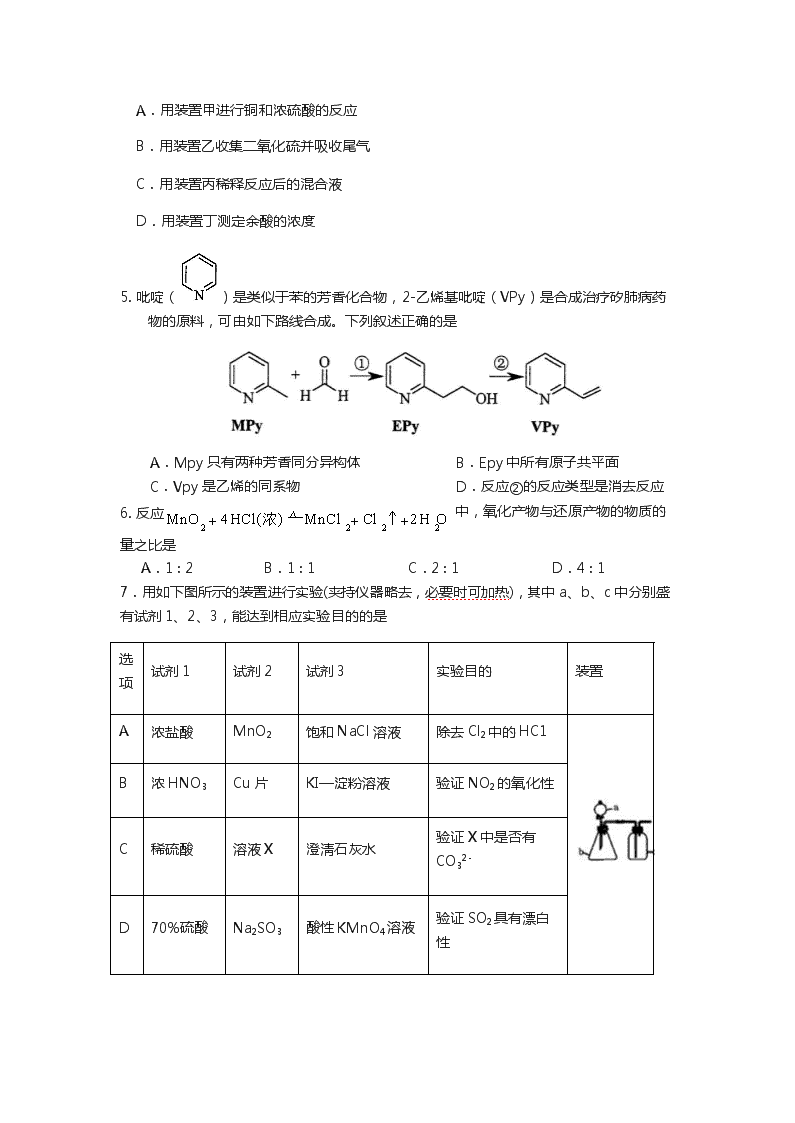
4.探究浓硫酸和铜的反应,下列装置或操作正确的是
A.用装置甲进行铜和浓硫酸的反应
B.用装置乙收集二氧化硫并吸收尾气 C.用装置丙稀释反应后的混合液 D.用装置丁测定余酸的浓度
5. 吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药 物的原料,可由如下路线合成。下列叙述正确的是
A.Mpy 只有两种芳香同分异构体 B.Epy 中所有原子共平面 C.Vpy 是乙烯的同系物 D.反应②的反应类型是消去反应
2 2 2 2
6. 反应 M nO + 4 HCl(浓) Δ M nCl + Cl +2 H O
量之比是
中,氧化产物与还原产物的物质的
A.1∶2 B.1∶1 C.2∶1 D.4∶1
7.用如下图所示的装置进行实验(夹持仪器略去,必要时可加热),其中 a、b、c 中分别盛 有试剂 1、2、3,能达到相应实验目的的是
选 项
试剂 1
试剂 2
试剂 3
实验目的
装置
A
浓盐酸
MnO2
饱和 NaCl 溶液
除去 Cl2 中的 HC1
B
浓 HNO3
Cu 片
KI—淀粉溶液
验证 NO2 的氧化性
C
稀硫酸
溶液 X
澄淸石灰水
验证 X 中是否有 CO32-
D
70%硫酸
Na2SO3
酸性 KMnO4 溶液
验证 SO2 具有漂白 性
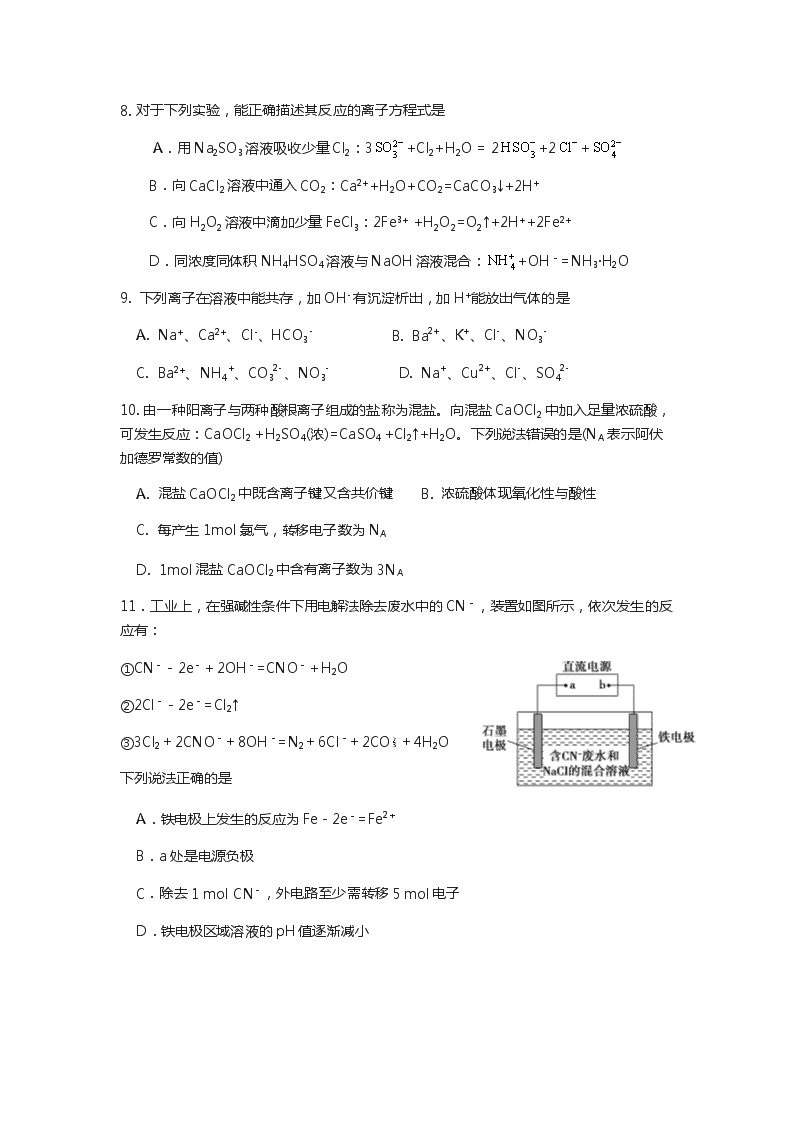
8. 对于下列实验,能正确描述其反应的离子方程式是
A.用 Na2SO3 溶液吸收少量 Cl2:3 SO2- +Cl2+H2O = 2 HSO- +2 Cl- + SO2-
3 3 4
B.向 CaCl2 溶液中通入 CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向 H2O2 溶液中滴加少量 FeCl3:2Fe3+ +H2O2=O2↑+2H++2Fe2+
4
D.同浓度同体积 NH4HSO4 溶液与 NaOH 溶液混合: NH+ +OH
-=NH3·H2O
9. 下列离子在溶液中能共存,加 OH- 有沉淀析出,加 H+能放出气体的是
- 2+ + - -
A. Na+、Ca2+、Cl-、HCO3
B. Ba
、K 、Cl 、NO3
+ 2- -
+ 2+ - 2-
C. Ba2+、NH4 、CO3
、NO3
D. Na
、Cu
、Cl 、SO4
10. 由一种阳离子与两种酸根离子组成的盐称为混盐。向混盐 CaOCl2 中加入足量浓硫酸,
可发生反应:CaOCl2 +H2SO4(浓)=CaSO4 +Cl2↑+H2O。下列说法错误的是(NA 表示阿伏 加德罗常数的值)
A. 混盐 CaOCl2 中既含离子键又含共价键 B. 浓硫酸体现氧化性与酸性 C. 每产生 1mol 氯气,转移电子数为 NA
D. 1mol 混盐 CaOCl2 中含有离子数为 3NA
11.工业上,在强碱性条件下用电解法除去废水中的 CN-,装置如图所示,依次发生的反 应有:
①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO +4H2O 下列说法正确的是
A.铁电极上发生的反应为 Fe-2e-=Fe2+
B.a 处是电源负极
C.除去 1 mol CN-,外电路至少需转移 5 mol 电子 D.铁电极区域溶液的 pH 值逐渐减小
12. 室温下,将两种浓度均为 0 .1m o l × L- 1 的溶液等体积混合,若溶液混合引起的体积变化 可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
3
A.NaHCO3-Na2CO3 混合溶液(pH=10.30):c(Na+)> c(CO32-)> c(HCO -)>
c(H+)
B.氨水-NH4Cl 混合溶液(pH=9.25):
c ( NH 4 ) + c (H
) = c ( NH 3 × H 2O ) + c (OH )
+ + -
C.CH3COOH-CH3COONa 混合溶液(pH=4.76):
c ( Na
) > c (CH3COOH ) > c (CH3COO
) > c (H )
+ - +
D.H2C2O4-NaHC2O4 混合溶液(pH=1.68,H2C2O4 为二元弱酸):
( + ) ( ) (
+ ) (
2- ) ( - )
c H + c
H 2C2O4
= c Na
+ c C2O4
+ c OH
第 II 卷(共 64 分)
注意: 交卷时只交答题卡!
13. 开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题: (1)Ti(BH4)3 是一种储氢材料,可由 TiCl4 和 LiBH4 反应制得。
①基态 Ti3+的电子排布式为 ;LiBH4 中 Li 和 B 原子半径为 Li B(填 “>”“<”或“=”)。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化 轨道类型为 。
(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和 NH3 合成。
①NH3BH3 中是否存在配位键 (填“是”或“否”);与 NH3BH3 互为等电子体的 分子的化学式为 。
②B、C、N 与 O 元素的第一电离能由大到小的顺序为 。
(3) 金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素 R 的氢 化物。R 的部分电离能如下表所示:
I1/KJ·mol-1
I2/KJ·mol-1
I3/KJ·mol-1
I4/KJ·mol-1
I5/KJ·mol-1
738
1451
7733
10540
13630
①该金属元素是 _(填元素符号).
②若氢化物的晶胞结构如图所示(有 4 个 H 原子位于面上,其余 H 原子 位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为
cm3[用含ρ、NA 的代数式表示(其中 NA 为阿伏加德罗常数的 值)]。
14.天然产物 H 具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
已知:(Z=—COOR,—COOH 等) 回答下列问题:
(1)A 的链状同分异构体可发生银镜反应,写出这些同分异构体所有可能的结 构: 。
(2)在核磁共振氢谱中,化合物 B 有 组吸收峰。
(3)化合物 X 的结构简式为 。
(4)D→E 的反应类型为 。
(5)F 的分子式为 ,G 所含官能团的名称为 。
(6)以和 为原料,合成,在方框中写 出路线流程图(无机试剂和不超过 2 个碳的有机试剂任选)。
15.草酸铁晶体 Fe2(C2O4)3·xH2O 通过相关处理后可溶于水,且能做净水剂,在 110℃可 完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
步骤 1:称量 4.66g 草酸铁晶体进行处理后,配制成 250 mL 一定物质的量浓度的溶液。 步骤 2:取所配溶液 25.00 mL 于锥形瓶中,加稀 H2SO4 酸化,滴加 KMnO4 溶液至草酸
4
根恰好全部氧化成二氧化碳,同时 MnO -被还原成 Mn
2+。向反应后的溶液中加入一小匙
锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中, 此时溶液仍呈酸性。
步骤 3:用 0.0200 mol·L-1KMnO4 溶液滴定步骤 2 所得溶液至终点,消耗 KMnO4 溶液 V1
mL,滴定中 MnO4-被还原成 Mn2+。
重复步骤 2、步骤 3 的操作 2 次,分别滴定消耗 0.0200 mol·L-1 KMnO4 溶液为 V2、V3
mL。
记录数据如下表:
实验编号
KMnO4 溶液的浓度(mol·L-1)
KMnO4 溶液滴入的体积(mL)
1
0.0200
V1 = 20.02
2
0.0200
V2 = 20.12
3
0.0200
V3 = 19.98
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因 (用离子方程式表示)
(2)该实验步骤 1 和步骤 3 中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃
棒外,一定需用下列仪器中的 (填序号)
A. 酸式滴定管 B.碱式滴定管 C.250 mL 容量瓶 D.锥形瓶 E.胶头滴管 F.漏斗
(3)加入锌粉的目的是
(4)步骤 3 滴定时是否选择指示剂 (是或否);说明理由
写出步骤 3 中发生反应的离子方程式
(5)在步骤 2 中,若加入的 KMnO4 溶液的量不够,则测得的铁含量 (填“偏
低”、“偏高”或“不变”);实验测得该晶体中结晶水的个数 x为 。
16.运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危 机具有重要意义。
(1)CO 还原 NO 的脱硝反应:2CO(g)+2NO(g)⇌ 2CO2(g)+N2(g) △H 已知:CO(g)+NO2(g) ⇌ CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)⇌ 2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)⇌ 2NO(g) △H3=+183kJ·mol-1
脱硝反应△H= ,有利于提高 NO 平衡转化率的条件是 (写出两条)。
(2)某温度下,向体积为 2L 的恒容容器中通入 2.00molNO2,发生反应:
2NO2(g) N2O4(g)∆H=-57.0kJ·mol-1,已知:v 正(NO2)=k1·c2(NO2),v 逆 (N2O4)=k2·c(N2O4),其中 k1、k2 为速率常数。测得 NO2 的体积分数[φ( (NO2)]与反应时 间(t)的关系如表:
t/min
0
20
40
60
80
φ
( (NO2)
1.0
0.75
0.52
0.50
0.50
则①平衡时,c(N2O4)= ;(计算结果保留一位小数)
k1
k
② 的数值为 ;
2
(3)用间接电化学法除去 NO 的过程,如图所示:
①已知电解池的阴极室中溶液的 pH 在 4~7 之间,写出阴极的电极反应式:
;
②用离子方程式表示吸收池中除去 NO 的原理: 。
参考答案
答案
1-5 CDBCD
6-10 BAAAB
11-12 CD
13. 1s22s22p63s23p63d1 > sp、sp2、sp3 是 C2H6 N>O>C>B Mg
14. (1) H 2 C = C H C H 2 C H O
(2)4
(3)
(4)加成反应
(5) C 1 3 H 1 2 O 3
羰基,酯基
(6)
15. Fe3+ + 3H2O Fe(OH)3(胶体)+ 3H+ A、C、D、E 将 Fe3+还原为
Fe2+ 否 因为 KMnO4 被还原剂还原成 Mn2+,紫红色褪去,所以不需要指示剂
5Fe2++MnO +8H+===5Fe3++Mn2++4H2O 偏高 5
16. -750KJ/mol 降低温度 增大压强(缩小容器体积)、增大 CO 浓度等 0.3mol/L
4
6 2HSO3-+2e-+2H+===S2O 2-
+2H2O 2NO+2S2O4
2-+2H2O===N2+4HSO3-
相关文档
- 【化学】天津市第一中学2020届高三2021-07-0810页
- 天津市第一中学2019-2020学年高二2021-07-0818页
- 【化学】天津市第一中学2020届高三2021-07-0619页
- 天津市第一中学2020届高三化学4月2021-07-0620页
- 2018-2019学年天津市第一中学高二2021-07-059页
- 2018-2019学年天津市第一中学高二2021-07-0327页
- 重庆市第一中学2020届高三上学期摸2021-07-0215页
- 数学理卷·2018届天津市第一中学高2021-07-019页
- 2017-2018学年天津市第一中学高二2021-07-0114页
- 2018-2019学年天津市第一中学高一2021-07-015页