- 3.09 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
- 1 -
2020-2021 学年高三总复习阶段性检测考试
理科综合卷 化学部分
注意事项:
1.考试范围:
化学——必修 1,必修 2,选修 4。
2.答卷前,考生务必将自己的姓名准考证号等填写在答题卡和试卷指定位置上。
3.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试
卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Fe 56 Ag 108
一、选择题:本题共 13 小题,每小题 6 分,共 78 分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
7.传统文化是我国古文明的瑰宝。下列有关解读错误的是
8.α-紫罗兰酮从一种桂花中提取,主要用于配制香精,它的键线式如图所示。已知:与四个
不同原子或原子团相连的碳原子叫手性碳原子。下列有关α-紫罗兰酮的说法正确的是
A.分子中有 10 个碳原子一定共平面
B.与同碳原子数的芳香醇互为同分异构体
C.与足量 Br2 反应的产物分子中含 4 个手性碳原子
D.1 mol α-紫罗兰酮和 3 mol H2 完全反应的产物化学式为 C13H20O
9.在 MoO3 作用下,HOCH2CH(OH)CH3 发生反应的历程如图,下列说法错误的是
- 2 -
A.反应的 4 种产物中有 2 种能发生银镜反应
B.MoO3 改变反应途径,提高了单位时间原料转化率
C.反应过程中 Mo 形成的共价键数目始终保持不变
D.①和②过程中催化剂促进 H-O 极性键断裂
10.某小组设计实验探究硝酸及其氮的氧化物性质,装置如图所示。
已知:FeSO4+NO=Fe(NO)SO4(棕色)。实验中观察到 I 中充满红棕色,II 中产生白色沉淀,
III 中溶液变为棕色,IV 中溶液逐渐褪色。下列说法正确的是
A.盛装浓硝酸的仪器叫长颈漏斗,装置 IV 吸收 NO
B.本实验能证明硝酸具有强氧化性,NO 具有还原性
C.装置 III 检验装置 I 中生成了 NO
D.II 中现象说明 NO2 气体中混有 H2SO4
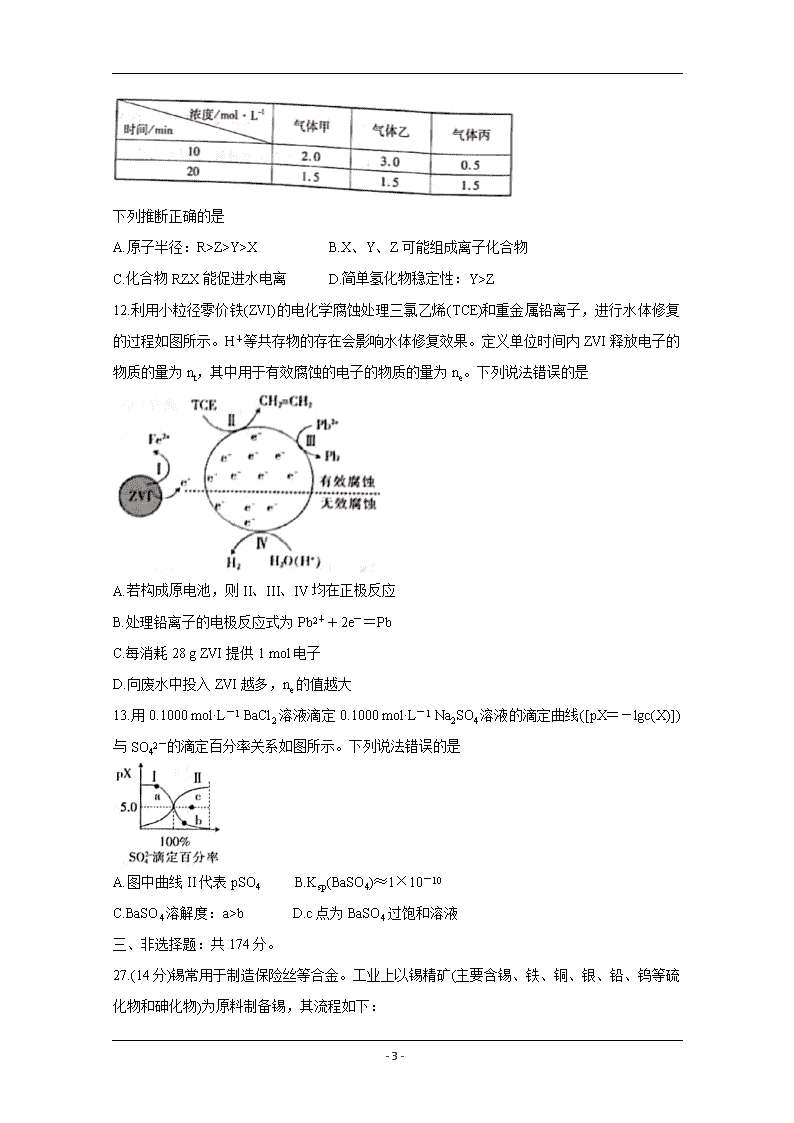
11.短周期主族元素 X、Y、Z、R 的原子序数依次增大,Z2-和 R+的电子层结构相同。Y 和 X
的单质分别为甲、乙,在一定条件下合成丙,测得相关数据如下:
- 3 -
下列推断正确的是
A.原子半径:R>Z>Y>X B.X、Y、Z 可能组成离子化合物
C.化合物 RZX 能促进水电离 D.简单氢化物稳定性:Y>Z
12.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯(TCE)和重金属铅离子,进行水体修复
的过程如图所示。H+等共存物的存在会影响水体修复效果。定义单位时间内 ZVI 释放电子的
物质的量为 nt,其中用于有效腐蚀的电子的物质的量为 ne。下列说法错误的是
A.若构成原电池,则 II、III、IV 均在正极反应
B.处理铅离子的电极反应式为 Pb2++2e-=Pb
C.每消耗 28 g ZVI 提供 1 mol 电子
D.向废水中投入 ZVI 越多,ne 的值越大
13.用 0.1000 mol·L-1 BaCl2 溶液滴定 0.1000 mol·L-1 Na2SO4 溶液的滴定曲线([pX=-lgc(X)])
与 SO42-的滴定百分率关系如图所示。下列说法错误的是
A.图中曲线 II 代表 pSO4 B.Ksp(BaSO4)≈1×10-10
C.BaSO4 溶解度:a>b D.c 点为 BaSO4 过饱和溶液
三、非选择题:共 174 分。
27.(14 分)锡常用于制造保险丝等合金。工业上以锡精矿(主要含锡、铁、铜、银、铅、钨等硫
化物和砷化物)为原料制备锡,其流程如下:
- 4 -
请回答下列问题:
(1)锡精矿在空气中焙烧,使硫元素和砷元素转化为易挥发的 SO2 和 As2O3,可用 (填
化学式)溶液吸收尾气。
(2)“焙烧”中将 WS2 转化成 WO3,用 10%纯碱溶液“碱浸”将 WO3 转化成易溶性的 Na2WO4
并放出气体,写出离子方程式: 。
(3)“熔炼”时使用焦炭粉,粉碎焦炭的目的是 ;如果炭还原 SnO2
时生成锡和 CO、CO2(体积比 3:1),写出化学方程式: 。
(4)利用如图所示装置精炼锡。Y 极材料是 (填化学式),阳极最先发生反应的电极反
应式为 。
(5)精炼锡的阳极泥主要有 Cu、Ag 和 PbSO4,回收铜和银的流程如下:
①下列说法正确的是 (填字母)。
A.KClO3 氧化 Cu 和 Ag B.只能用置换法提取铜
C.滤渣 2 的主要成分是 PbSO4 D.浸取 2 需要“高温”
②浸液 2 的主要成分是[Ag(NH3)2]Cl,氨水溶解氯化银的离子方程式为 。(已
知[Cu(NH3)4]SO4 的电离方程式书写:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-)
③若制得 4 mol 银,至少需要水合肼(N2H4·H2O) mol(已知:水合肼的氧化产物对环
境友好)。
28.(15 分)滴定法是测定甲醛废水中甲醛含量的一种方法(假设废水不含其他干扰实验的成分)。
实验步骤如下:
①用 KBrO3 固体配制 450 mL c1 mol·L-1 KBrO3 溶液;
- 5 -
②取 x mL 上述溶液.加入过量 KBr,加稀硫酸酸化,溶液呈棕黄色;
③向②所得溶液中加入 x mL 废水,溶液呈浅黄色;
④向③所得溶液中加入过量 KI;
⑤用 c2 mol·L-1 标准 Na2S2O3 溶液滴定④中溶液至浅黄色,滴加几滴淀粉溶液,继续滴定至终
点,消耗标准滴定液 y mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6;Na2S2O3 和 Na2S4O6 溶液
均为无色)
请回答下列问题:
(1)在步骤①中需要的定量仪器有托盘天平和 。
(2)步骤②中离子方程式为 。
(3)步骤③中必须使溶液呈浅黄色,原因是 ;溴
氧化 HCHO 生成 CO2,写出化学方程式 。
(4)下列情况表明 KI 一定过量的是 (填字母)。
A.n(KI)=6n(KBrO3) B.n(KI)=5n(KBrO3)
C.n(KI)>7n(KBrO3) D.n(KI)<6n(KBrO3)
(5)滴定终点标志是 ;废水中甲醛的浓度为 mol·L-1。
(6)若上述操作在通风条件下进行,测得结果 (填“偏高”“偏低”或“无影响”)。
29.(14 分)某小组探究 H2(g)+I2(g) 2HI(g) △H
(1)已知:H-H、I-I、H-I 键的键能(kJ·mol-1)依次为 436、151、297。上述反应中△H=
kJ·mol-1。
(2)在 698.6K 时,向密闭容器中充入 H2(g)、I2(g)发生上述可逆反应,测得有关数据如下:
根据上述数据和平衡常数定义式可以得出的规律是平衡常数只与 有关,与反应物
浓度和反应途径无关。
(3)在恒温恒容条件下发生上述反应,下列情况表明该反应已达到平衡状态的是 (填
字母)。
- 6 -
A.混合气体密度保持不变化 B.混合气体总压强保持不变
C.断裂 H-H 和 H-I 键速率之比为 1:2 D.混合气体中 HI 体积分数保持不变
(4)H2(g)+I2(g) 2Hl(g)的反应历程如下:第 1 步,I2 2I(快速平衡);第 2 步,I+H2 H2I(快
速平衡);第 3 步,H2I+I 2HI(慢反应)。
①第 1 步反应中, (填“放出”或“吸收”)热量。
②上述三步反应中,活化能最大的是第 (填数字)步反应。
③第 2 步正反应速率 (填“大于”“小于”或“等于”)第 3 步逆反应速率。
(5)在催化剂作用下,发生反应:H2(g)+I2(g) 2HI(g),温度与速率关系如图所示。
TT0 时, ,
反应速率降低。
(6)一定温度下,在密闭容器中充入等物质的量的 H2(g)和 I2(g)达到平衡时 H2 的转化率为α,则
在该温度下,平衡常数 Kp= (用分压计算的平衡常数为 Kp,分压等于总压×物质
的量分数)。
30.(15 分)邻苯二甲酸(H2R)常作分析试剂、配制标准溶液等。室温下,pKa1=2.95,pKa2=5.41(pK
=-lgK)。室温下,向一定浓度的 H2R 溶液中滴加 pH=13 的 NaOH 溶液,混合溶液中 x 与
pH 的关系如图所示,其中 x=lg
2c H R
c(HR )- 或 lg 2
c(HR )
c(R )
-
- 。请回答下列问题:
(1)写出 H2R 第二步电离方程式: 。
从两个角度解释 H2R 的 Ka1>Ka2; 。
(2)H2R 和 NaOH 反应过程如下:
- 7 -
①H2R(aq)+NaOH(aq)=NaHR(aq)+H2O(l) △H1
②H2R(aq)+2NaOH(aq)=Na2R(aq)+2H2O(l) △H2
③Na2R(aq)+H2R(aq)=2NaHR(aq) △H3
则△H3= (用含△H1 和△H2 的代数式表示)。
(3)直线 L1 代表 (填“lg
2c H R
c(HR )- ”或“lg 2
c(HR )
c(R )
-
- ”);直线 L2 上的所有点对应溶
液中水的电离程度 (填“一定”“一定不”或“不一定”)大于直线 L1。
(4)下列说法正确的是 (填字母)。
A.当溶液中 c(R2-)>c(HR-)时,溶液呈碱性
B.a=m=2.95,b=n=5.41
C.当溶液中 c(Na+)=c(HR-)+c(R2-)时,溶液 pH=7
D.c(Na2R)=c(NaHR)的溶液能抵消外加少量酸或碱的作用
(5)邻苯二甲醛被酸性高锰酸钾溶液氧化成邻苯二甲酸:
某小组设计如图装置探究该反应原理,关闭 K 时电流计显示电子由石墨极流向铂极。
①一段时间后观察到左烧杯中现象是 ;写出正极反应式: 。
②实验完毕后,取出少量右烧杯中溶液于试管, (补充
操作和现象),证明生成了邻苯二甲酸。
- 8 -
- 9 -
- 10 -
- 11 -
相关文档
- 【化学】广东省兴宁市第一中学20202021-07-0816页
- 【化学】天津市六校(天津中学、南开2021-07-0817页
- 天津市第八中学2021届高三上学期第2021-07-0816页
- 【化学】四川省绵阳市南山中学实验2021-07-0817页
- 【化学】安徽省滁州市定远县育才学2021-07-0817页
- 天津市第一中学2021届高三上学期摸2021-07-089页
- 【化学】重庆市铜梁县第一中学20202021-07-0812页
- 福建省莆田市第一联盟体2020届高三2021-07-0823页
- 【化学】江苏省如皋中学2020届高三2021-07-0821页
- 安徽省太和第一中学2021届高三上学2021-07-0810页