- 1.02 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
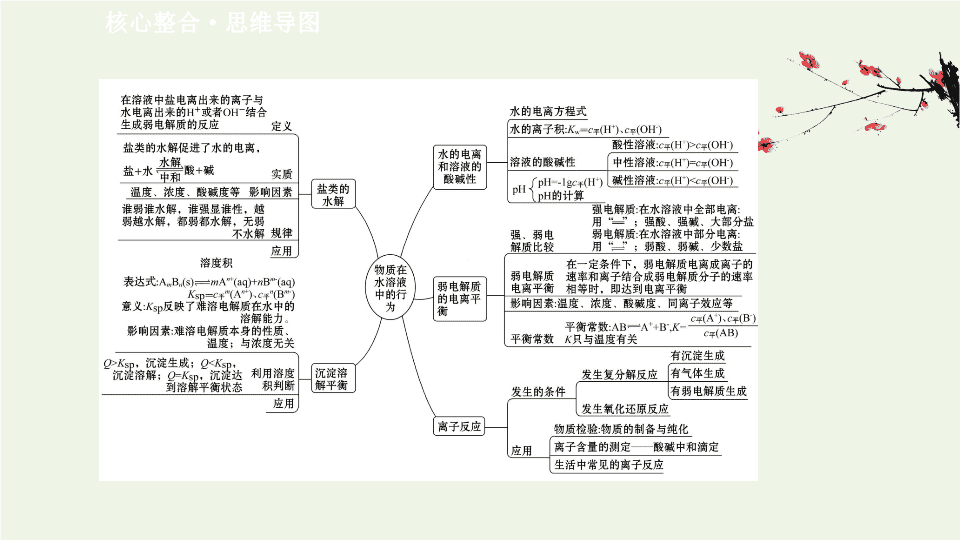
阶段复习课
第
3
章
核心整合
·
思维导图
情境探究
·
素养提升
1.
现有
S
2-
、 、 、
Al
3+
、 、
Na
+
、 、
[Al(OH)
4
]
-
、
Fe
3+
、 、
Cl
-
,
请按要求填空
:
(1)
在水溶液中
,
离子水解使溶液呈碱性的是
__________________________
。
(2)
在水溶液中
,
离子水解使溶液呈酸性的是
__________________________
。
(3)
既能在酸性较强的溶液里大量存在
,
又能在碱性较强的溶液里大量存在的
离子有
__________________________________________________________
。
(4)
既不能在酸性较强的溶液里大量存在
,
又不能在碱性较强的溶液里大量存
在的离子有
______________________________________________________
。
【
解析
】
(1)
弱酸根离子水解溶液显碱性
,
部分弱酸的酸式酸根离子若水解程
度大
,
则溶液也显碱性
,
即
S
2-
、 、 、
[Al(OH)
4
]
-
、 水解呈碱
性。
(2)
、
Al
3+
、
Fe
3+
属于弱碱阳离子
,
水解后溶液呈酸性。
(3)Na
+
、
Cl
-
、 是强碱阳离子或强酸的阴离子
,
既能在酸性较强的溶液中存在又能在碱性较强的溶液中存在。
(4)
、 属于弱酸的酸式酸根离子
,
既能与酸性较强的溶液反应又能与碱性较强的溶液反应。
答案
:
(1)S
2-
、 、 、
[Al(OH)
4
]
-
、
(2)
、
Al
3+
、
Fe
3+
(3)Na
+
、
Cl
-
、
(4)
、
2.
废弃物的综合利用既有利于节约资源
,
又有利于保护环境。实验室利用废旧电池的铜帽
(Cu
、
Zn
总含量约为
99%)
回收
Cu
并制备
ZnO
的部分实验过程如图所示
:
(1)①
铜帽溶解时加入
H
2
O
2
的目的是
__________________________________
_______(
用化学方程式表示
)
。
②铜帽溶解完全后
,
需将溶液中过量的
H
2
O
2
除去。除去
H
2
O
2
的简便方法是
__________
。
(2)
为确定加入锌灰
(
主要成分为
Zn
、
ZnO,
杂质为铁及其氧化物
)
的量
,
实验中
需测定除去
H
2
O
2
后溶液中
Cu
2+
的含量。实验操作
:
准确量取一定体积的含有
Cu
2+
的溶液于带塞锥形瓶中
,
加适量水稀释
,
调节溶液
pH=3
~
4,
加入过量的
KI,
用
Na
2
S
2
O
3
标准溶液滴定至终点。上述过程中反应的离子方程式如下
:
2Cu
2+
+4I
-
====2CuI(
白色
)↓+I
2
2 +I
2
====2I
-
+
①
滴定选用的指示剂为
________,
滴定终点观察到的现象为
______________
_______________________________________________________________
。
②
若滴定前溶液中的
H
2
O
2
没有除尽
,
所测定的
Cu
2+
含量将会
__________(
填“偏高”“偏低”或“不变”
)
。
【
解析
】
(1)
铜与稀硫酸不反应
,
加入
H
2
O
2
可以将铜氧化为
CuO,CuO
与稀硫酸反应。
H
2
O
2
不稳定
,
受热分解生成水和氧气
,
氧气逸出。
(2)
根据淀粉遇碘变蓝色的性质
,
可用淀粉溶液作指示剂。在锥形瓶中加入淀粉溶液
,
溶液变为蓝色
,
滴入
Na
2
S
2
O
3
标准溶液至溶液的蓝色褪去
,
且半分钟内不恢复原色
,
即证明
I
2
全部反应。若溶液中的
H
2
O
2
没有除尽
,H
2
O
2
具有强氧化性
,
会氧化
I
-
生成
I
2
,
导致
Na
2
S
2
O
3
标准溶液使用量偏多
,
从而使算出的
Cu
2+
含量偏高。
答案
:
(1)①Cu+H
2
O
2
+H
2
SO
4
====CuSO
4
+2H
2
O
②加热
(
至沸腾
)
(2)①
淀粉溶液 蓝色褪去
,
且半分钟内不恢复原色 ②偏高
3.
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测
定学校周边河水中的溶解氧。实验步骤及测定原理如下
:
Ⅰ.
取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与
Mn(OH)
2
碱性悬浊液
(
含有
KI)
混合
,
反应生成
MnO(OH)
2
,
实现氧的固定。
Ⅱ.
酸化、滴定
将固氧后的水样酸化
,MnO(OH)
2
被
I
-
还原为
Mn
2+
,
在暗处静置
5 min,
然后用标准
Na
2
S
2
O
3
溶液滴定生成的
I
2
(2 +I
2
====2I
-
+ )
。
回答下列问题
:
(1)
取水样时应尽量避免搅动水体表面
,
这样操作的主要目的是
___________
___________________________
。
(2)“
氧的固定”中发生反应的化学方程式为
__________________________
____________________
。
(3)Na
2
S
2
O
3
溶液不稳定
,
使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和
__________;
蒸馏水必须经过煮沸、冷却后才能使用
,
其目的是杀菌、除
______________
及二氧化碳。
(4)
取
100.00 mL
水样经固氧、酸化后
,
用
a mol·L
-1
Na
2
S
2
O
3
溶液滴定
,
以淀粉溶液作指示剂
,
终点现象为
________________________________________;
若消耗
Na
2
S
2
O
3
溶液的体积为
b mL,
则水样中溶解氧的含量为
_______mg·L
-1
。
(5)
上述滴定完成时
,
若滴定管尖嘴处留有气泡会导致测定结果偏
__________
(
填“高”或“低”
)
。
【
解析
】
本题采用碘量法测定水中的溶解氧的含量
,
属于氧化还原滴定。
(2)
根据氧化还原反应原理
,Mn(OH)
2
被氧气氧化为
MnO(OH)
2
,
由此可得化学方程式
2Mn(OH)
2
+O
2
====2MnO(OH)
2
。
(3)
加热可以除去溶解的氧气
,
避免实验结果不准确。
(4)
该实验用硫代硫酸钠标准溶液滴定
I
2
,
因此终点现象为当最后一滴标准溶液滴入时
,
溶液由蓝色变为无色
,
且半分钟内无变化
;
根据关系式
O
2
~
2MnO(OH)
2
~
2I
2
~
4Na
2
S
2
O
3
可得水样中溶解氧的含量为
[(ab×10
-3
) mol÷4×32×10
3
mg
·
mol
-1
]÷
0.1 L=80ab mg
·
L
-1
。
(5)
终点读数时有气泡
,
气泡占据液体应占有的体积
,
会导致消耗的
Na
2
S
2
O
3
体积偏小
,
最终结果偏低。
答案
:
(1)
使测定值与水体中的实际值保持一致
,
避免产生误差
(2)2Mn(OH)
2
+O
2
====2MnO(OH)
2
(3)
量筒 氧气
(4)
当最后一滴标准液滴入时
,
溶液由蓝色变为无色
,
且半分钟内无变化
80ab
(5)
低
相关文档
- 2020届二轮复习常用化学计量及应用2021-07-0865页
- 2021届高考化学一轮复习(苏教版)元素2021-07-0813页
- 湖南省怀化市2018-2019学年高一下2021-07-084页
- 2021版化学名师讲练大一轮复习鲁科2021-07-084页
- 最新高一化学必修二全册知识点总结2021-07-0815页
- 高中化学:3-3《羧酸 酯》课件(人教版2021-07-0828页
- 【化学】江苏省扬州江都大桥中学202021-07-0812页
- 【化学】2020年高考全国I卷高三最2021-07-0815页
- 高三化学下学期六调试题扫描版2021-07-0810页
- 高考化学一轮配套课件:第25讲 醛2021-07-0844页