- 1.98 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
1
化学流程图专题分析
随着新课改的进行,在高考化学试题中化工题逐渐成为一类热门的主流题型
"它将高中化学与某些化工生产很好地融合在一起,题目情景新颖,综合性强,
思维量大,具有挑战性。一些专家预测,在新课改背景下,无机化工题可能会
逐渐取代以往高考化学试题中的无机框图型推断题,2007 年广东、山东、上海
高考化学试题中均考查了化工题,江苏省十三大市化学试题中几乎都设置了化
工题。化工题是以某个具体的工业生产为背景,以化学基本理论为主线,结合
化学实践!环境保护!化学计算等考查同学们应用所学知识探究解决生产实际问
题的能力,对综合能力要求很高"化工题的特点表现为:题目多以流程图的形式
出现;题目所涉及的情景新颖;在题目中还时常出现一些化工术语(酸浸!水洗!
水热处理表面处理等);题目实际考查的是应用化学反应原理、化学平衡原理、
离子平衡理论!晶体结构知识!物质制备和分离(提纯)知识、绿色化学观点、安
全生产思想及从经济的视角分析、评价、探究实际生产中各种问题的能力为了
能够从容应答这类试题,考得理想的分数,下面我通过一个例题来分析解答化
工题的一般思路和主要策略,希望大家多提宝贵意见。
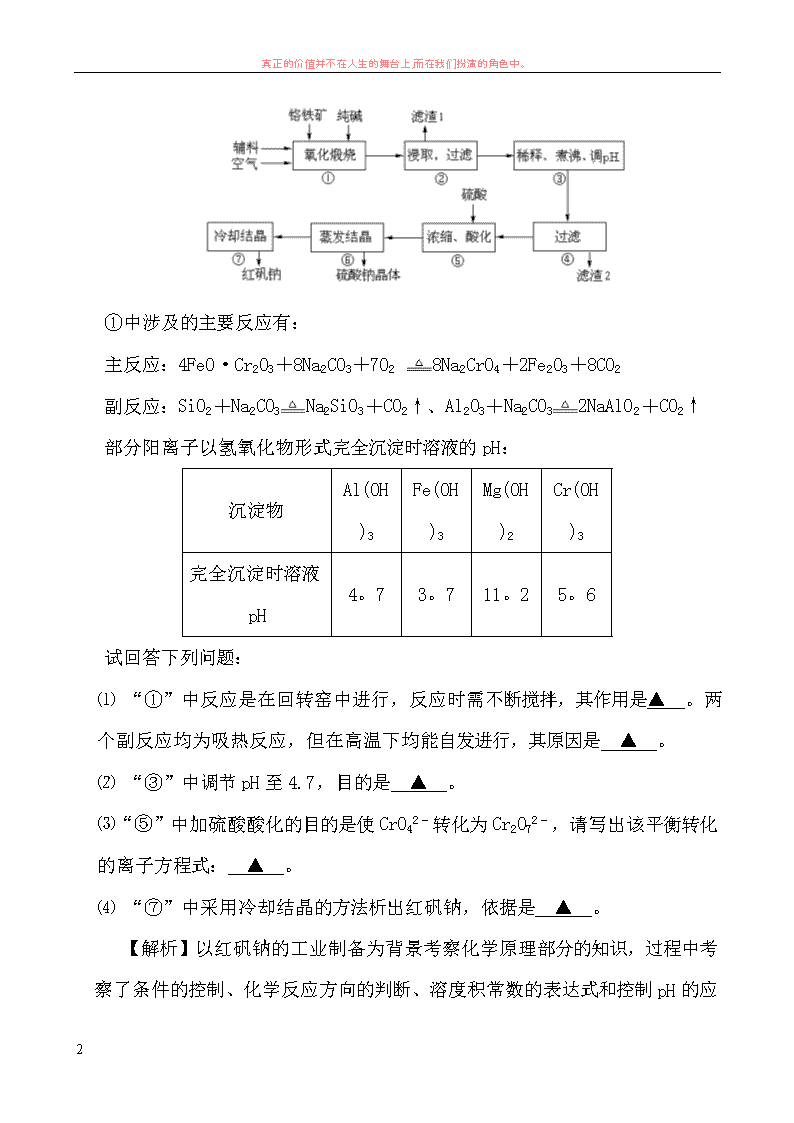
【例 1】重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国
目前主要是以铬铁矿(主要成份为 FeO·Cr2O3,还含有 Al2O3、MgO、SiO2 等杂质)
为主要原料进行生产,其主要工艺流程如下:
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
2
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的 pH:
沉淀物
Al(OH
)3
Fe(OH
)3
Mg(OH
)2
Cr(OH
)3
完全沉淀时溶液
pH
4。7 3。7 11。2 5。6
试回答下列问题:
⑴ “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是▲ 。两
个副反应均为吸热反应,但在高温下均能自发进行,其原因是 ▲ 。
⑵ “③”中调节 pH 至 4.7,目的是 ▲ 。
⑶ “⑤”中加硫酸酸化的目的是使 CrO4
2-转化为 Cr2O7
2-,请写出该平衡转化
的离子方程式: ▲ 。
⑷ “⑦”中采用冷却结晶的方法析出红矾钠,依据是 ▲ 。
【解析】以红矾钠的工业制备为背景考察化学原理部分的知识,过程中考
察了条件的控制、化学反应方向的判断、溶度积常数的表达式和控制 pH 的应
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
3
用。搅拌的目的是增大反应物的接触机会,从而加快反应速率。由于这两个
副反应是在高温下才自发进行,所以必然是一个△S>0 的反应。③溶液中存在
的主要阴离子有 CrO4
2-、AlO2
—、SiO3
2—,pH 调至 4.7,是为了除去其中的 AlO2
—、SiO3
2—。硫酸钠的溶解度随温度的升高,先增大后减小,这一点较特殊,
设问较困难。若给出其溶解度曲线,则可以帮助理解最后两步工艺。
【答 案】⑴ 使反应物接触更充分,加快反应速率 △S>0 ⑵除去溶液中
的 AlO2
—、SiO3
2—
⑶ 2CrO4
2-+2H+ Cr2O7
2-+H2O ⑷红矾钠的溶解度随温度的降低而减小
【小结】学生审题不清(采用冷却结晶的方法析出红矾钠,要回答的是依
据而不是原因、试题要求写出 CrO4
2-转化为 Cr2O7
2-的平衡转化离子方程式,但很
多学生不用可逆符号而用等号),概念混淆(不断搅拌、增大反应物的接触面积
能提高反应速率,能不能使平衡移动、不能增大反应物的转化率),思考问题的
指向不正确(讨论反应能否自发进行应从什么角度思考?部分学生还不知道),
分析问题能力差,化学原理不清,不能正确分析流程图中所包含的化学反应。
【例 2】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相
似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制 500mL 稀氨水(每升含有 39。20g 氨)
需要取浓氨水(每升含有 251.28g 氨)__________mL,用规格为_______mL 量筒
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
4
量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除 K+、SO4
2-外,还有大量的
NH4
+。检验 NH4
+的方法是
_______________________________________________________。
(3)写出沉淀物中所有物质的化学式
________________________________________。
(4)滤液 I 的成分是水和______________。
(5)为测定混合肥料 K2SO4、(NH4)2SO4 中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______溶液,产生白色沉淀。②
___________、__________、_________(依次填写实验操作名称)。③冷却、称
重。
(6)若试样为 mg,沉淀的物质的量为 n mol,则试样中 K2SO4 的物质的量为:
______mol(用含有 m、n 的代数式表示)。
【解析】(1)根据稀释前后溶质质量不变得:0.5L×39.2g/L=v×
251.28g/L,v=0.078L=78mL。为了减少误差,最好选用与氨水的实际体积稍
大一点的量筒即可。
(2)NH4
+的检验方法是先将 NH4
+中加入强碱,使之转化为 NH3,然后检验 NH3:
用润湿的红色石蕊试纸放在向移的试管口,试纸变蓝色,说明有氨气放出,原
物质中含有铵根离子。
(3)Al3++3NH3·H2O===Al(OH)3↓+3NH4
+,根据题意明矾石中含有 Al2O3、Fe2O3,
所以沉淀物为 Al(OH)3、Al2O3 和 Fe2O3。
(4)由于明矾石的组成与明矾相似,所以滤液的成分中含有 K2SO4 和反应后生成
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
5
的(NH4)2SO4 以及水。
(5)混合肥料中含有 K2SO4 和(NH4)2SO4,要产生白色沉淀,加入的溶液为 BaCl2
或 Ba(NO3)2 溶液,以后的操作为:先将混合液过滤,然后洗涤,最后干燥,冷却
后称量。
(6)根据题意有:174n(K2SO4)+132n[(NH4)2SO4]=mg……①,
再由 SO 2
4 守恒得:n(K2SO4)+n[(NH4)2SO4]=nmol… …②,n (K2SO4) =m-132n
42
mol。
【答案】(1)78;100。(2)取滤液少许,加入 NaOH,加热,生成的气体能使
湿润的红色石蕊试纸变蓝。(3)Al(OH)3;Al2O3;Fe2O3。(4)K2SO4;(NH4)2SO4。(5)BaCl2;
过滤;洗涤;干燥。(6)m-132n
42 mol。
【例 3】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,
利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为 MnO2,还含有 Si(16。27%)、Fe(5。86%)、Al(3。42%)、
Zn(2。68%)和 Cu(0。86%)等元素的化合物。部分阳离子以氢氧化物或硫化物
的形式完全沉淀时溶液的 pH 见下表,回答下列问题:
沉淀
物
Al(OH
)3
Fe(OH
)3
Fe(OH
)2
Mn(OH
)2
Cu(OH
)2
Zn(OH
)2
CuS Zn
S
Mn
S
Fe
S
pH 5.2 3.2 9.7 10.4 6.7 8.。0 ≥– ≥ ≥ ≥
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
6
0.42 2.
5
7 7
(1)FeSO4 在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要反应的化学方
程式为 。
( 2 ) 滤 渣 A 的 主 要 成 分
是 。
(3)加入 MnS 的目的是除去 杂
质。
( 4 ) 碱 性 锌 锰 电 池 中 , MnO2 参 与 的 电 极 反 应 方 程 式
为 。
( 5 ) 从 废 旧 碱 性 锌 锰 电 池 中 可 以 回 收 利 用 的 物 质
有 (写两种)。
【解析】考查学生对元素化合物的主要性质的掌握、书写电极反应方程形式
的能力以及学生能够从试题提供的新信息中,准确地提取实质内容,并与已有
知识模块整合,重组为新知识模块的能力。由反应流程可知:在酸性条件下二
氧化锰将 Fe2+氧化为 Fe3+,将 Cu 氧化成 Cu2+,此外溶液中的还有 Zn2+和 Al3+,当
调 pH 至 5。4 时,只有 Al(OH)3 和 Fe(OH)3 会完全沉淀,故滤渣 A 的主要成分是
Fe(OH)3 和 Al(OH)3。加入 MnS 后因为酸性条件下 CuS 、ZnS 更难溶所以会转化为
CuS 、ZnS 沉淀而除去 Cu2+ Zn2+。
【答 案】(1)MnO2 +2FeSO4 + 2H2SO4 =MnSO4 + Fe2(SO4)3 +2H2O (2 )
Fe(OH)3 Al(OH)3
(3)Cu2+ Zn2+(4)MnO2+H2O+e-=MnOOH+OH-(或 2MnO2+H2O+2e-=Mn2O3
+2OH-)
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
7
(5)锌、二氧化锰
【例 4】将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和
氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角
度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除 CaSO4·2H2O、KCl 外,还需要 等
原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除 CaCO3 外还含有 (填化学式)
等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4 溶液。检验滤液中含有 CO3
2-的方法是:
。
(5)已知不同温度下 K2SO4 在 100g 水中达到饱和时溶解的量如下表:
60℃时 K2SO4 的饱和 溶液 591g 冷却到 0
℃,可析出 K2SO4 晶体 g
(6)氯化钙结 晶 水 合 物
(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
温度(℃) 0 20 60
K2SO4 溶解的量
(g)
7。4 11。
1
18。
2
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
8
( 7 ) 上 述 工 艺 流 程 中 体 现 绿 色 化 学 理 念 的
是: 。
【解析】此题是一道以工业生产为背景的实验题,考查了实验基本操作、
离子检验、溶解度计算等。从生产流程图可以看出,所需原料除 CaSO4·2H2O、
KCl 外,还需要氨气、石灰石和水。硫酸钙是微溶的,碳酸钙是难溶的,因此石
膏悬浊液中加入碳酸铵溶液后生成了碳酸钙和硫酸铵,生成的碳酸钙中混有石
膏。碳酸根的检验可用酸化的方法,若产生气泡说明虑液中含有碳酸根。硫酸
钾饱和溶液在结晶过程中溶剂的量不变,查表可知不同温度下的溶解度,先求
出 591 饱和液中含有的水是 500g,在 0℃可溶解硫酸钾 37g,所以析出晶体 54g。
作为储热材料,要求能在室温左右的温度下工作,且对人体无害,故选 ad;绿
色化学要求整个生产过程中不排放污染物,原子利用率高,因此生产流程中碳
酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循
环使用。
【答案】(1)CaCO3 NH3 H2O (2)CaSO4+CO3
2-→CaCO3↓+SO4
2-(3)CaSO4
(4)滤液中滴加盐酸产生气泡 (5)54g (6)a d
(7)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨
在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
【小结】工业生产流程的设计和实验方案设计原理相似,只是在工业生产中
对经济性、环保性等许多细节方面有着更高的要求,解题时应在实验室原理的
基础上结合实际因素,充分读懂工业流程的每一个步骤的意义。
【例 5】以浓硫酸、浓硝酸、粗铜、水和空气为原料可制得硫酸铜
(CuSO4·5H2O)。制取硫酸铜晶体的过程如下图所示。
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
9
回答下列问题:
(1)配平在滤液(Ⅲ)中发生反应化学主程式:
____NOx+____H2O+____O2══____HNO3。
( 2 ) 写 出 制 取 硫 酸 铜 的 总 反 应 方 程 式
_________________________________。
( 3 ) 在 上 述 生 产 过 程 中 , 被 循 环 使 用 的 物 质 是
_______________________________。
(4)请你选用下列适宜的装置来模拟上述生产过程。将它们的编号填入方
框。
【解析】(1)NOx 中 N 的化合价为 2x,反应前后 N 化合价变化为 5-2x,O2 中
O 化合价变化为 4,初步配平为 4NOx+H2O+(5-2x)O2→HNO3,再配平其他物质的
化学计量数得:4NOx+2H2O+(5-2x)O2══4HNO3;(2)发生的有关的化学方程式
为:(5-2x)Cu+(12-4x)HNO3══(5-2x)Cu(NO3)2+2NOx +(6-2x)H2O……①、
4NOx+2H2O+(5-2x)O2══4HNO3……②、
A
(Cu、浓硫酸、浓硝酸) (水) (水、空气)
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
10
Cu(NO3)2+H2SO4══CuSO4+2HNO3……③,
①+②÷2+③×(5-2x),得:(5-2x)Cu+ O2+(5-2x)H2SO4══(5-2x)CuSO4+
(5-2x)H2O,
化简得 2Cu+O2+2H2SO4══2CuSO4+2H2O;
(3)要提供 O2,可用排空气法,即用 A 装置通过从分液漏斗中加水排出空气;
消除氮的氧化物用 B 装置,一个导气管通氮的氧化物,一个导气管通空气,另
一个导气管导出多余的空气。
由实验室用浓硫酸和金属铜制硫酸铜,拓展到用稀硫酸、金属铜、通入氧
气制硫酸铜, 延伸到化工生产硫酸铜,再回归到实验室模拟化工生产过程。
Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O Cu + 4HNO3(浓)== Cu(NO3)2
+ 2NO2↑+ 2H2O
SO2 + 2HNO3(浓)== H2SO4 + 2NO2 Cu(NO3)2 + H2SO4 == CuSO4↓ + 2HNO3 (应
用侯氏制碱法的生产原理)4NO2 + O2 + 2H2O == 4HNO3 把方程式进行加合,可
得总反应方程式:2Cu + O2 + 2H2SO4 2CuSO4 + 2H2O
在模拟化工生产过程时,又把通入空气和水回归为制取氧气通入水中。
答案:(1)2Cu + O2 + 2H2SO4 2CuSO4 + 2H2O (2)HNO3 (3)B、A。
【例 6】工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业
上用软锰矿制备高锰酸钾的一种工艺流程。
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
11
粉碎MnO2
熔融
KMnO4
K2CO3
MnO2
KOH
H2O
K2MnO4
CO2
操作Ⅰ KMnO4
K2CO3
操作Ⅱ
母液
KMnO4
粗晶体
干燥 KMnO4
晶体
石灰苛化 KOH
空气
①KMnO4 稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填
代号)。
a. 84 消毒液(NaClO 溶液) b. 双氧水 c. 苯酚 d. 75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_____(填
代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
③上述流程中可以循环使用的物质有 、 (写化学
式)。
④若不考虑物质循环与制备过程中的损失,则 1 mol MnO2 可制得 mol
KMnO4。
⑤该生产中需要纯净的 CO2 气体。若实验室要制备纯净的 CO2,所需试剂最好选
择(选填代号) 。a. 石灰石 b. 稀 HCl c. 稀 H2SO4
d. 纯碱
所需气体发生装置是_____________(选填代号)。
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
12
⑥操作Ⅰ的名称是 ;操作Ⅱ根据 KMnO4 和 K2CO3 两物质在 (填
性质)上的差异,采用 (填操作步骤)、趁热过滤得
到 KMnO4 粗晶体。
【解析】高锰酸钾又名灰锰氧,是+7 价锰最重要的化合物, 也是最重要和
最常用的氧化剂之一。本题以液相氧化法制备高锰酸钾为背景, 着重考察了基
本化学实验知识, 本题可很好地巩固试剂保存、分离提纯操作、有关气体制取
实验原理和装置知识等。
(1)高锰酸钾的消毒机理主要是靠其氧化性氧化微生物而杀灭微生物, 它通
过氧化细菌体内的活性基团而发挥作用,类似 84 消毒液(NaClO 溶液)、双氧水,
而苯酚、 酒精消毒机理主要是使蛋白质 75%凝固。
(2)试剂保存方法源于试剂的性质, 见光易分解的物质通常保存在棕色试剂
瓶中。浓硝酸、硝酸银、氯水等试剂都是中学阶段常用试剂, 都保存在棕色试
剂瓶中。
(3 从流程图中不难发现,由于 K2MnO4 在酸性条件下易歧化为 MnO2 和 KMnO4,所
以 MnO2 可以部分循环;母液成分主要是 K2CO3,通过加入石灰,产生 KOH 也可以
循环利用。
(4)本小题考察学生对制备原理的理解。一种方法是写出各步反应, 通过物
质的量的关系得出;另外,从流程中也可看出,Mn元素损失发生在 KMnO4 歧化
这一步,通过电子得失守恒,1molKMnO4 可制得 1/3molMnO2 和 2/3molKMnO4.
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
13
(5) 本题主要考察有关气体制取实验原理和装置, 气体发生装置取决于气
体制备原理。题目中关键词 “纯净”, 所以要选用纯碱和稀硫酸, 发生装置
就只能相应选择A。
(6)主要考察制备过程中分离提纯的基本操作。操作Ⅰ是分离不溶物 MnO2,所
以是过滤; 操作Ⅱ从两物质性质上分析, 都可溶, 故是利用两者溶解度的不
同而采用结晶方法分离, 但考虑到 KMnO4 易受热分解, 要得到 KMnO4 粗晶体,
只能蒸发浓缩结晶。
【答案】(1)ab (2)d (3)MnO2;KOH (4)2/3 (5)cd ;A;(6)过滤;
溶解度;浓缩结晶
[小结] 结合本题系统复习拓展介绍 KMnO4 作为氧化剂在不同介质条件下被还
原的产物, 也可以拓展到电解法制备高锰酸钾的工艺流程。
本专题考查考生将工艺流程与化学原理融合的能力。学生之所以怕无机化
工信息题往往是被陌生情景和专业术语吓倒,或者是因不能完全理解流程图的
含义而无从下手。解题时首先要粗读试题,尽量弄懂流程图。图中一般会出现
超纲知识,但题目中蕴涵了提示或者提问时不涉及,所以一定要关注题目的每
一个字眼,尽量弄懂流程图但不必要将每一个物质都推出,问什么推什么。其
次要带着问题去精心研究某一步或某一个物质。在答题时应注意前后问题往往
没有联带效应,即前一问不能回答没关系,不影响后面回答问题。遇到做不出
来的问题要及时放弃,以免影响其他问题的作答。最后,作答时一定要看清所
提问题,不能答非所问,注意语言表达的科学性。
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
14
练习
1.减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的
利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备
硫酸锰的生产流程如下:
浸出液的 pH<2,其中的金属离子主要是 Mn2+,还含有少量的 Fe2+、Al3+、Ca2
+、Pb2+等其他金属离子。
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附
金属离子的效果见下图。
离子 离子半径
(pm)
开始沉淀时
的pH
完全沉淀时
的pH
Fe2+ 74 7.6 9.7
→滤渣→
阳离子吸附剂
↓
MnSO4·H2O←
→
↓
滤渣
→
石灰浆
↓
→
MnO2 粉
↓
→浸出液→软锰矿浆→
→SO2
↓
废渣→ 高温焙烧
浸出 氧化
调节 pH
静 置 过滤
操作 a
干燥
吸附 静置、过滤
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
15
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ▲ ,氧化过程中主要反应的离子
方程式 ▲ 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 ▲ 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是
▲ (填写序号)。
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸
附时间
⑷ 操作a包括 ▲ 等过程。
2.重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂。实验室模拟工业生
产重铬酸钾时用铬铁矿(主要成份为 FeO·Cr2O3)、纯碱、烧碱、氯酸钾等
为原料先制得铬酸钠(Na2CrO4),涉及的主要反应是 6FeO·Cr2O3 + 24NaOH
+7KClO3 12Na2CrO4 + 3Fe2O3 +7KCl + 12H2O,然后将铬酸钠转化为 K2Cr2O7。
其主要工艺如下:
Fe3+ 64 2.7 3.7
Al3+ 50 3.8 4.7
Mn2+ 80 8.3 9.8
Pb2+ 121 8.0 8.8
Ca2+ 99 - -
Pb2+
Ca2+
Fe2+
Al3+
Mn2+、Fe3+
吸附率
1.00
0.75
0.50
0.25
0 2 4 6 8 吸附时间/h
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
16
试回答下列问题:
(1)在反应器①中,有 Na2CrO4 生成,同时 Fe2O3 转变为 NaFeO2,杂质 SiO2、
Al2O3 与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方
程式:
。
(2)NaFeO2 能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方
程式:
。
(3)操作③的目的是什么,用简要的文字和化学方程式说明:
。
(4)操作④中,酸化时,CrO4
2-转化为 Cr2O7
2-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样 2.5000g 配成 250mL 溶液,取出 25.00mL 于碘量瓶
中,加入 10mL 2mol/LH2SO4 溶液和足量碘化钾(铬的还原产物为 Cr3+),
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
17
放于暗处 5min,然后加入 100mL 水,加入 3mL 淀粉指示剂,用
0.1200mol/LNa2S2O3 标准溶液滴定(I2+2S2O3
2-=2I-+S4O6
2-)。
①判断达到滴定终点的依据
是: ;
②若实验中共用去 Na2S2O3 标准溶液 40.00mL,则所得产品中的重铬酸钾的
纯度为 (设 K2Cr2O7 的摩尔质量为 294g·mol -1,整个过程中
其它杂质不参与反应)。
3、工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
请回答下列问题:
(1)沉淀 C 的化学式为________,该物质除了用于金属冶炼以外,还可用
作________。
(2)电解熔融的氧化铝时,加入冰晶石的作用是________________。
(3)操作 I、操作 II、操作 III 都是________________(填操作名称),
实验室要洗涤 Al(OH)3 沉淀应该在________________装置中进行。
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
18
(4)生产过程中,除 NaOH、H2O 可以循环使用外,还可以循环使用的物质
有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
( 5 ) 写 出 Na2CO3 溶 液 与 CaO 反 应 离 子 方 程 式 :
__________________________________。
(6)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:
________(填化学式)。
4.现有含 FeCl2 杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的 CuCl2·2H2O,
首先将其制成水溶液,然后按下图所示步骤进行提纯:
已知 H2O2、KMnO4、NaClO、K2Cr2O7 均具有强氧化性,要将溶液中的 Cu2+、Fe2+、
Fe3+沉淀为氢氧化物,需溶液的 pH 分别为 6.4、6.4、3.7。请回答下列问题:
(1)本实验最适合的氧化剂 X 是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质 Y 不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)除去 Fe3+的有关离子方程式是(物质 Y 在(2)中选择合适的选项):
________________________________________________________________
( 4 ) 加 入 氧 化 剂 的 目 的 是
____________________________________________________。
(5)最后能不能直接蒸发结晶得到 CuCl2·2H2O?__________(填“能”或“不
能 ”)。 如 不 能 , 应 如 何 操 作 ? ( 如 能 , 此 空 不 填 )
含杂质的
水溶液Ⅰ 溶液Ⅱ
溶液Ⅲ
沉淀
纯 CuCl2·2H2O
加入氧化剂 X 加入物质 Y
一定条件
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
19
________________________________________________。
5.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧
化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质
中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加
热至 560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学
方程式为:
I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平
该 反 应 的 化 学 方 程 式 :
______________________________________________________________;
( 2 ) 步 骤 ② 中 , 用 稀 酸 酸 化 的 作 用 是
____________________________________________;在稀硝酸和稀盐酸中
不能选用的酸是:_________,其原因是____________________
______________________________________________________;
(3)步骤③要保持溶液微沸 1 小时以完全排出氯气,排出氯气的原因为
______
______________________________________________________;
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
20
(4)参照下表碘酸钾的溶解度,步骤 11 得到碘酸钾晶体,你建议的方法是
______ 。
温度/℃ 0 10 20 40 60 80
KIO3g/100
g 水
4.6
0
6.2
7
8.0
8
12.
6
18.
3
24.8
6.(10 分)工业碳酸钠(纯度约为 98%)中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO4
2-
等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Na2CO3·10H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
Ⅱ、有关物质的溶度积如下:
物质 CaCO3 MgCO3 Ca(OH)2 Mg(OH)2 Fe(OH)3
Ksp
4.96×10
—9
6.82×10
—6
4.68×10
—6
5.61×10
—12
2.64×10
—39
回答下列问题:
(1)加入 NaOH 溶液时,首先生成的沉淀是 (填化学式);生成氢氧
化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 。
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
21
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请 你 分 析 实 际 工 业 生 产 中 是 否 可 行 , 并 说 明 理
由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(l) △H= + 92.36 kJ·mol
—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H= + 473.63 kJ·mol
—1
又知:H2O(l)=H2O(g) △H= + 44 kJ·mol—1
写 出 Na2CO3 · H2O 脱 水 生 成 气 态 水 的 热 化 学 方 程
式 。
参考答案
1.⑴ SO2+MnO2=MnSO4 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
⑵ 4.7~8.3 ⑶ b c d ⑷ 蒸发浓缩结晶
2.(1)Al2O3+Na2CO3 2NaAlO2+CO2↑(2 分)
(2)NaFeO2+2H2O=Fe(OH)3↓+NaOH(2 分)
(3)由于硅酸钠和偏铝酸钠发生水解:SiO3
2-+2H2O H2SiO3+2OH-(或
SiO3
2-+H2O HSiO3
-+OH-,HSiO3
-+H2O H2SiO3+OH-,
AlO2
-+H2O Al(OH)3+OH-),降低 pH 值有利于平衡向正反应方向移动,
当 pH 调到 7~8 时,使它们水解完全(2 分)
(4)2CrO4
2-+2H+ Cr2O7
2-+H2O(1 分)
(5)①当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不
变色(2 分);
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
22
②94.08%(2 分)。
3(1)Fe2O3,颜料;(2)降低氧化铝的熔点;(3)过滤,过滤;(4)CaO 和 CO2,
Fe2O3 和 O2;(5)CO3
2-+CaO+H2O=CaCO3+2OH-;(6)SiO2
4.(1)C (2)CuO、CuCO3、Cu(OH)2、CU2(OH)2CO3
(3)Fe3++3H2O Fe(OH)3↓+3H+、CuO+2H+=Cu2++H2O
(4)将 Fe2+氧化成 Fe3+ (5)不能,蒸发浓缩,冷却结晶。
5、(1)6I2 + 11KClO3 + 3H2O = 6KH(IO3)2 + 5KCl + 3Cl2↑ (2 分)
(2)促进氯气从反应混合物中逸出。(2 分)稀盐酸(1 分)盐酸能还原已
生成的碘酸氢钾
(3)Cl2 能将 KIO3 氧化成 KIO4 (2 分) (4)蒸发结晶(1 分)
6、(10 分)(1)Fe(OH)3 (1 分),MgCO3 +2OH-= Mg (OH) 2↓+CO3
2-(2 分);
(2)高于 36℃(2 分)
(3)不可行(1 分); 若“母液”循环使用,则溶液 c(Cl-)和 c(SO4
2-)增大,最
后所得产物 Na2CO3 混有杂质(2 分)
(4)Na2CO3·H2O(s)=Na2CO3(s) +H2O(g) △H=+58.73kJ·mol—1(2 分)
相关文档
- 高中化学第二章化学反应与能量第三2021-07-085页
- 2020_2021学年高中化学第二章化学2021-07-089页
- 高中化学第3章物质在水溶液中的行2021-07-085页
- 高中化学专题化学家眼中的物质世界2021-07-0837页
- 高中化学必修一必修二知识点总结122021-07-0884页
- 2020_2021学年高中化学第二章化学2021-07-0815页
- 2020_2021学年新教材高中化学第3章2021-07-0815页
- 高中化学:3-3《羧酸 酯》课件(人教版2021-07-0828页
- 新教材高中化学课时跟踪检测二硫酸2021-07-087页
- 高中化学选修4知识点总结归纳2021-07-0833页