- 2.21 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
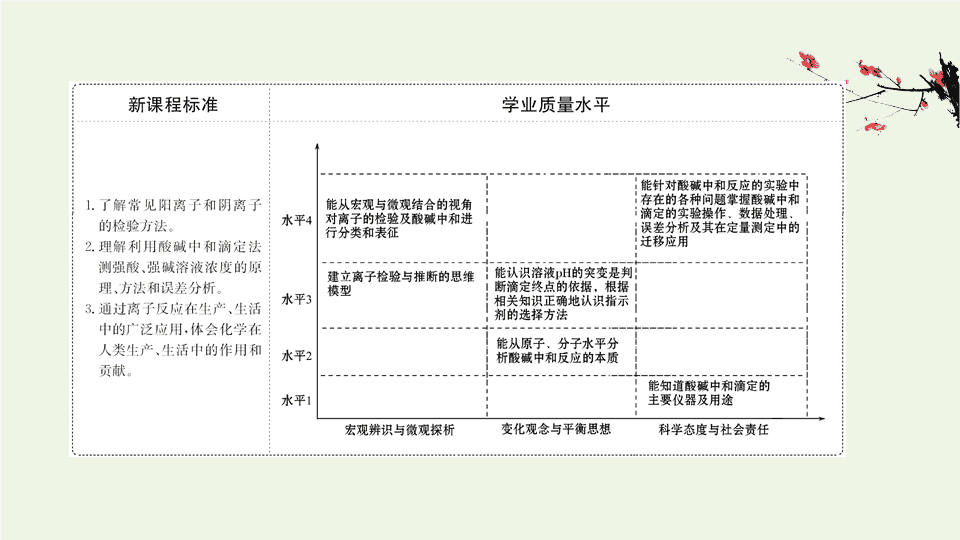
第
2
课时 离子反应的应用
一、物质检验与含量测定
1.
离子检验
利用离子的特征反应来检验一些常见离子。
如利用
Fe
3+
与
SCN
-
反应生成红色溶液检验
Fe
3+
,
离子方程式为
______________
________(
红色
);
利用
I
-
与
Ag
+
反应生成黄色沉淀检验
I
-
,
离子方程式为
__________________
____
。
必备知识
·
素养奠基
Fe
3+
+3SCN
-
====
Fe(SCN)
3
Ag
+
+I
-
====AgI↓(
黄
色
)
2.
测定溶液中离子的浓度
(1)
沉淀法
:
如溶液中 的浓度
,
用
____
将其转化为
BaSO
4
沉淀
,
再
_________
_____
求得。
(2)
酸碱中和滴定法
:
强酸溶液中
H
+
的浓度可以用已知准确浓度的
_____
溶液滴
定的方法获得。
(3)
氧化还原滴定法
:
如溶液中 的浓度可以用已知准确浓度的
____
溶液
滴定获得。
Ba
2+
称量沉淀
质量
强碱
Fe
2+
【
巧判断
】
(1)
能使石灰水变浑浊的无色无味气体一定是
CO
2
。
(
)
提示
:
√
。
CO
2
是无色无味可使澄清石灰水变浑浊的气体。
(2)
中和滴定时为了节省时间
,
不需要重复
2
~
3
次实验。
(
)
提示
:
×
。为了减少滴定误差
,
需进行
2
~
3
次实验。
(3)
用石灰水鉴别
NaHCO
3
和
Na
2
CO
3
。
(
)
提示
:
×
。
NaHCO
3
、
Na
2
CO
3
与石灰水反应均产生
CaCO
3
沉淀。
二、物质制备与纯化
1.
物质的制备
:
离子反应可以用于制备一些
___
、
___
、
___
、
_____
等。
(1)
氯碱工业生产烧碱和氯气的离子方程式
:
______________________________
。
(2)
实验室制取
CO
2
的离子方程式
:
__________________________
。
酸
碱
盐
气体
2Cl
-
+2H
2
O 2OH
-
+Cl
2
↑+H
2
↑
CaCO
3
+2H
+
====Ca
2+
+CO
2
↑+H
2
O
通电
====
2.
物质的纯化
(1)
制高纯度的氯化钠
:
除去其中少量的 、
Mg
2+
、
Ca
2+
,
需要引入的试剂离
子分别为
_______________
。
(2)
除去污水中的重金属离子
:
将其转化为
_____
而除去。
(3)
从海水中提取二氧化碳
:
Ba
2+
、
OH
-
、
沉淀
①a
室为
_____
室
,
发生反应为
____________________;
②c
室为
_____
室
,
发生反应为
_______________;
③a
室产生的
__
透过离子交换膜进入
b
室
,
与
b
室中的
______
发生反应
,
反应方程
式为
______________________
。
阳极
4OH
-
-4e
-
====2H
2
O+O
2
↑
阴极
2H
+
+2e
-
====H
2
↑
+H
+
====H
2
O+CO
2
↑
H
+
【
巧判断
】
(1)
用足量稀硝酸除去铁粉中的
Cu
。
(
)
提示
:
×
。
Fe
、
Cu
均溶于足量的稀硝酸。
(2)
将混有
HCl
的
CO
2
通入饱和
NaHCO
3
溶液中除去
HCl
。
(
)
提示
:
√
。
HCl
与
NaHCO
3
反应产生
CO
2
从而除去
HCl
。
(3)
可以用铁粉除去
FeCl
3
中的
FeCl
2
。
(
)
提示
:
×
。
Fe+2FeCl
3
====3FeCl
2
,
无法除去
FeCl
2
。
三、生活中的离子反应
1.
胃酸过多的治疗
服用胃舒平
[
主要成分是
Al(OH)
3
],
离子反应为
_______________________
。
2.
硬水及其软化
(1)
硬水的含义
:
自然界里含
_________
较多的水。
(2)
一般硬水
(
暂时硬水
)
的形成
:
水中的二氧化碳与岩石中的
CaCO
3
和
MgCO
3
发
生反应生成可溶性碳酸氢盐而使
Ca
2+
、
Mg
2+
进入水中形成
,
离子方程式为
____________________________,____________________________
。
Al(OH)
3
+3H
+
====Al
3+
+3H
2
O
Ca
2+
、
Mg
2+
CaCO
3
+CO
2
+H
2
O====Ca
2+
+
MgCO
3
+CO
2
+H
2
O====Mg
2+
+
(3)
硬水的软化方法
①加热法
:
加热可使 分解
,
生成的 与
Ca
2+
、
Mg
2+
结合成沉淀
,
发生
反应如下
:
________________________________,
_________________________________
。
②加沉淀剂法
:
在硬水中加入
______
等沉淀剂也可以降低水中
Ca
2+
、
Mg
2+
的浓
度
,
发生反应如下
:
_____________________,_____________________
。
Ca
2+
+ ====CaCO
3
↓+CO
2
↑+H
2
O
Mg
2+
+ ====MgCO
3
↓+CO
2
↑+H
2
O
Na
2
CO
3
Ca
2+
+ ====CaCO
3
↓
Mg
2+
+ ====MgCO
3
↓
【
情境
·
思考
】
矿泉水是从地下深处自然涌出的或者是经人工发掘的、未受污染的地下矿水
,
含有一定量的矿物盐、微量元素锂、锶、锌、硒等。因矿泉水一般含钙、镁较多
,
常温下钙、镁呈离子状态
,
极易被人体所吸收
,
起到很好的补钙作用。若煮沸时
,
钙、镁易与碳酸根生成水垢析出
,
这样既丢失了钙、镁
,
还造成了感官上的不适
,
所以矿泉水最佳饮用方法是在常温下饮用。
【
思考
】
(1)
怎样测定矿泉水中的微量元素呢
?
(2)
为什么矿泉水煮沸时易形成水垢
?
提示
:
测定矿泉水中的微量元素可以用滴定法。矿泉水煮沸时碳酸氢钙、碳酸氢镁均易分解形成碳酸盐沉淀。
关键能力
·
素养形成
知识点一 酸碱中和滴定
【
重点释疑
】
酸碱中和滴定的实验操作与误差分析
(1)
原理
:
①
定量分析
:
化学上把测定物质各组成成分含量的过程
,
称为定量分析过程。中和滴定是定量分析的一种方法。
②中和滴定
:
用已知物质的量浓度的酸
(
或碱
)
来测定未知物质的量浓度的碱
(
或酸
)
的方法就叫酸碱中和滴定。
实质
:H
+
+OH
-
====H
2
O
即酸中的
H
+
和碱中的
OH
-
物质的量相等。
(2)
实验用品
:
①
用到的仪器
:
酸式滴定管
,
碱式滴定管
,
移液管
,
滴定管夹
,
锥形瓶
,
烧杯
,
铁架台。
②滴定管的结构和使用。
a.
刻度
(
以
50 mL
规格为例
)
滴定管上标有温度
(20 ℃)
和刻度
,
刻度共
50
大格
,
每大格为
1 mL,
每大格分为
10
小格
,
每小格为
0.1 mL,
因此能读至
0.01 mL(
估读
1
位
)
。“
0”
刻度在上
,“50”
刻度在下
,
在“
0”
以上至管口和“
50”
以下至尖嘴均无刻度。
b.
滴定管盛装试剂要求
——“
二不能”
酸式滴定管不能装碱性溶液、水解呈碱性的盐溶液及氢氟酸。碱式滴定管不能装酸性溶液或高锰酸钾等强氧化性物质的溶液
(
橡胶易被腐蚀
)
。
(3)
试剂
:
①
标准液、待测液。
②指示剂
(
加
2
~
3
滴
)
。
(4)
操作
(
以标准盐酸滴定待测氢氧化钠溶液为例
):
①
滴定前的准备
:
a.
查漏
:
检查滴定管的活塞是否灵活、滴定管是否漏水。
b.
洗涤
:
酸式、碱式滴定管、锥形瓶依次用自来水、蒸馏水洗涤干净。
c.
润洗
:
用待盛溶液将酸式、碱式滴定管润洗
2
~
3
次
,
以保证装入溶液时不改变溶液的浓度。
d.
装液
:
溶液装入酸式、碱式滴定管中
,
所装溶液调至“
0”
刻度上方
2
~
3 cm
处。
e.
排气
:
调节活塞
(
或挤压玻璃球
),
赶走气泡使滴定管尖嘴部分充满溶液。
f.
调液面
:
使液面处于“
0”
刻度或“
0”
刻度以下某一刻度处。
g.
读数
:
读数时视线应与溶液凹液面最低处相平
,
记录刻度
(
保留两位小数
)
。
②
滴定
:
a.
用碱式滴定管
(
或移液管
)
取一定体积的待测液于锥形瓶中
,
并滴入
2
~
3
滴酚酞试剂。把锥形瓶放在垫有一张白纸的酸式滴定管下面。
b.
用左手控制活塞
,
右手不断旋转振荡锥形瓶
,
眼睛注视锥形瓶内溶液颜色变化及滴定流速
,
当溶液变至无色且半分钟内不再恢复红色
,
停止
,
记下刻度。
③终点判断。
等到滴入最后一滴标准液
,
指示剂变色
,
且半分钟内不恢复原色
,
视为滴定终点并记录消耗标准液的体积。
(5)
数据处理
:
重复上述操作
2
~
3
次
,
求出用去标准盐酸体积的平均值
,
根据
c(NaOH)=
计算。
(6)
误差分析
:
①
依据
c(
待
)=
对错误操作引起的误差进行分析。
②常见错误操作及对应误差
:(
以酸滴定碱为例
)
错误操作
c(
待
)
的误差
仪器
洗涤
酸式滴定管水洗后未用标准液润洗
偏大
碱式滴定管水洗后未用待测液润洗
偏小
锥形瓶水洗后用待测液润洗
偏大
量器
读数
滴定前俯视酸式滴定管
,
滴定后平视
偏大
滴定前仰视酸式滴定管
,
滴定后俯视
偏小
滴定
操作
滴定前酸式滴定管尖嘴部分有气泡
,
滴定结束后
气泡消失
偏大
滴定结束
,
滴定管尖端挂一滴液体未滴下
偏大
错误操作
c(
待
)
的误差
滴定
操作
锥形瓶水洗后留有少量蒸馏水
无影响
滴定过程中
,
振荡锥形瓶时
,
不小心将溶液溅出
偏小
用甲基橙作指示剂
,
滴至橙色
,
半分钟内又恢复成
黄色
,
不处理就计算
偏小
【
思考
·
讨论
】
(1)
用盐酸滴定氨水
,
选什么作指示剂
?
怎样描述滴定终点
?
提示
:
可选择甲基橙作指示剂
,
滴定终点时溶液由黄色变为橙色且半分钟内不再变化。
(2)
酸碱恰好完全反应的点与滴定终点是否相同
?
提示
:
不相同。酸碱恰好完全反应是指酸与碱按照物质系数恰好完全反应
,
酸和碱都不剩余
,
此时溶液可能为中性
,
也可能为酸性或碱性
;
而滴定终点是指指示剂颜色恰好变化的点
,
二者不相同。酸碱恰好完全反应与滴定终点特别接近
,
在一般科学研究中不会造成大的误差。
【
拓展深化
】
中和滴定拓展应用
中和滴定操作不仅适用于酸
碱中和反应
,
也可以迁移应用于
氧化还原反应。
氧化还原滴定法
(1)
原理
:
以氧化剂
(
或还原剂
)
为滴定剂
,
直接滴定一些具有还原性
(
或氧化性
)
的物质。
(2)
实例
:
①
酸性
KMnO
4
溶液滴定
H
2
C
2
O
4
溶液
②Na
2
S
2
O
3
溶液滴定碘液
原理
2Na
2
S
2
O
3
+I
2
====Na
2
S
4
O
6
+2NaI
指示剂
用淀粉作指示剂
终点判断
当滴入最后一滴
Na
2
S
2
O
3
溶液后
,
溶液的蓝色褪去
,
且
半分钟内不恢复原来的颜色
,
说明到达滴定终点
【
案例示范
】
【
典例
】
(2020·
淄博高二检测
)
用中和滴定法测定烧碱的纯度
,
若烧碱中含有与酸不反应的杂质
,
试根据实验回答
:
(1)
将准确称取的
4.3 g
烧碱样品配成
250 mL
待测液
,
需要的主要仪器除量筒、烧杯、玻璃棒外
,
还必须用到的仪器有
_____________________________
。
(2)
取
10.00 mL
待测液
,
用
式滴定管量取。
(3)
用
0.200 0 mol·L
-1
标准盐酸滴定待测烧碱溶液
,
滴定时左手旋转酸式滴定管的玻璃活塞
,
右手不停地摇动锥形瓶
,
两眼注视
,
直到滴定终点。
(4)
根据下列数据
,
烧碱的纯度为
________
。
滴定次数
待测体积
(mL)
标准盐酸体积
(mL)
滴定前读数
(mL)
滴定后读数
(mL)
第一次
10.00
0.50
20.40
第二次
10.00
4.00
24.10
(5)
以标准的盐酸滴定未知浓度的氢氧化钠溶液为例
,
判断下列操作引起的误差
(
填“偏大”“偏小”“无影响”或“无法判断”
)
。
①读数
:
滴定前平视
,
滴定后俯视
________;
②
用待测液润洗锥形瓶
________;
③
滴定接近终点时
,
用少量蒸馏水冲洗锥形瓶内壁
________
。
【
解题指南
】
解答本题应注意以下三点
:
(1)
一定要注意
,
滴定管的“
0”
刻度在上
,
它不同于量筒等仪器。
(2)
分清酸式滴定管与碱式滴定管的构造及使用注意事项。
(3)
分析误差时
,
注意归纳到标准液体积的大小上来推断。
【
解析
】
(1)
配一定物质的量浓度的溶液需要用一定规格的容量瓶、胶头滴管
等。
(2)
待测液为碱液
,
用碱式滴定管量取。
(4)
第一次
V
1
(
盐酸
)=19.90 mL,
第二次
V
2
(
盐酸
)=20.10 mL,
两次平均
V(
盐酸
)
=20.00 mL
。设烧碱的纯度为
x, ×10.00 mL=20.00×10
-3
L×
0.200 0 mol
·
L
-1
,x=0.930 2,
即其纯度为
93.02 %
。
(5)①
滴定后俯视
,
会造成读数偏小
,
造成结果偏小。
②用待测液润洗锥形瓶
,
相当于多取了待测液
,
会造成结果偏大。
答案
:
(1)250 mL
容量瓶、胶头滴管
(2)
碱
(3)
锥形瓶内溶液颜色变化
(4)93.02%
(5)①
偏小 ②偏大 ③无影响
【
母题追问
】
(1)
若用乙酸滴定此烧碱溶液
,
则选择什么指示剂较为合适
,
为什么
?
提示
:
因为二者恰好完全反应时生成醋酸钠
,
醋酸钠水解溶液显示碱性
,
故选择酚酞作指示剂。
(2)
若
(5)
中②改成“滴定前酸式滴定管内有气泡
,
滴定后气泡消失”
,
则测定值会如何变化
?
提示
:
偏大。因为气泡的体积也计算在了需要的盐酸的量中
,
所以测定值会偏高。
【
迁移
·
应用
】
1.(2020·
南京高二检测
)
下列实验操作不会引起误差的是
(
)
A.
酸碱中和滴定时
,
用待测液润洗锥形瓶
B.
酸碱中和滴定时
,
用冲洗干净的滴定管盛装标准溶液
C.
用
NaOH
标准溶液测定未知浓度的盐酸溶液时
,
选用酚酞作指示剂
,
实验时不小心多加了几滴
D.
用标准盐酸溶液测定未知浓度的
NaOH
溶液
,
实验结束时
,
酸式滴定管尖嘴部分有气泡
,
开始实验时无气泡
【
解析
】
选
C
。
A
项
,
锥形瓶一定不要用待测液润洗
,
否则会使待测液的量偏大
,
消耗标准液的体积偏大
,
从而使所测浓度偏大
;B
项
,
冲洗干净的滴定管无论是盛装标准溶液
,
还是待测溶液
,
都必须用待装溶液润洗
2
~
3
次
,
否则会使标准溶液或待测溶液比原来溶液的浓度偏小
,
影响结果
;C
项
,
在滴定过程中
,
指示剂略多加了几滴
,
一般不影响实验结果
,
因为指示剂不会改变反应过程中酸和碱的物质的量
;D
项
,
实验开始时酸式滴定管中无气泡
,
实验结束时有气泡
,
会导致所读取的
V(HCl)
偏小
,
依据
V(HCl)·c(HCl)=V(NaOH)·c(NaOH)
得所测得的
c(NaOH)
偏小。
2.(2020·
厦门高二检测
)
准确移取
20.00 mL
某待测
HCl
溶液于锥形瓶中
,
用
0.100 0 mol·L
-1
NaOH
溶液滴定。下列说法正确的是
(
)
A.
滴定管用蒸馏水洗涤后
,
装入
NaOH
溶液进行滴定
B.
随着
NaOH
溶液滴入
,
锥形瓶中溶液
pH
由小变大
C.
用酚酞作指示剂
,
当锥形瓶中溶液由红色变为无色时停止滴定
D.
滴定达终点时
,
发现滴定管尖嘴部分有悬滴
,
则测定结果偏小
【
解析
】
选
B
。
A
项
,
滴定管用蒸馏水洗涤后
,
还要用待装
NaOH
溶液润洗
,
否则将要引起误差
,
错误
;B
项
,
在用
NaOH
溶液滴定盐酸的过程中
,
锥形瓶内溶液由酸性逐渐变为中性
,
溶液的
pH
由小变大
,
正确
;C
项
,
用酚酞作指示剂
,
锥形瓶中溶液应由无色变为粉红色
,
且半分钟内不恢复原色时才能停止滴定
,
错误
;D
项
,
滴定达终点时
,
发现滴定管尖嘴部分有悬滴
,
则碱液的体积偏大
,
测定结果偏大
,
错误。
知识点二 离子反应的应用
——
离子的检验与推断
【
重点释疑
】
1.
常见离子的检验
(1)
常见阴离子的检验
离子
鉴定方法
产生现象
OH
-
①
在试管中取少量试液滴加紫色石
蕊
(
或无色酚酞
)
试液
;②
用玻璃棒
蘸取试液于红色石蕊试纸
①
紫色石蕊试液变蓝
(
或酚酞
变红
);
②
红色石蕊试纸变蓝
Cl
-
在试管中取少量试液
,
滴加
AgNO
3
溶
液
,
再加稀硝酸
生成白色沉淀
,
不溶于稀硝酸
离子
鉴定方法
产生现象
Br
-
在试管中取少量试液
,
滴加
AgNO
3
溶
液
,
再加稀硝酸
生成浅黄色沉淀
,
不溶于稀
硝酸
I
-
在试管中取少量试液
,
滴加
AgNO
3
溶
液
,
再加稀硝酸
生成黄色沉淀
,
不溶于稀硝
酸
在试管中取少量试液
,
先加
BaCl
2
产
生白色沉淀
,
另取少量溶液于试管
中加入稀盐酸或稀硝酸
,
将生成的
气体通入澄清的石灰水
产生无色、无味的气体
,
此
气体能使澄清的石灰水变浑
浊
在试管中
,
取少量试液
,
滴加盐酸
无明显现象
,
再加
BaCl
2
生成白色沉淀
离子
鉴定方法
产生现象
在试管中
,
取少量试液
,
先加
BaCl
2
产
生白色沉淀
,
另取少量溶液加盐酸生
成气体
,
把气体通入品红溶液
生成无色有刺激性气味的
气体
,
品红溶液褪色
(2)
常见阳离子的检验
离子
鉴定方法
产生现象
在试管中
,
取少量试液
,
加浓
NaOH
微热
,
用润湿的红色石蕊试纸靠近管口
有刺激性气味
,
使润湿的
红色石蕊试纸变蓝
Al
3+
①
在试管中取少量试液加适量
NaOH
溶
液
;②
加过量
NaOH
溶液
①
有白色絮状沉淀
;
②
上述沉淀消失
Fe
3+
①
在试管中取少量试液
,
加
KSCN
溶液
;
②
在试管中取少量试液
,
加入
NaOH
溶液
①
溶液呈红色
;
②
产生红褐色沉淀
Fe
2+
在试管中取少量试液加入
NaOH
溶液
生成白色沉淀
,
迅速变为
灰绿色
,
最后变为红褐色
2.
离子推断的四个原则
【
思考
·
讨论
】
下面是对溶液中有无 检验的实验方案
,
请评价各方案是否严密
?
分别说
明理由。
提示
:
不严密。如果试液中含有
Ag
+
(
或
Pb
2+
、
Hg
2+
)
而不含
,
当加入
BaCl
2
时
同样产生白色沉淀
,
并且加入稀硝酸后沉淀不溶解
,
故方案甲不严密
(Ag
+
等干
扰
)
。
提示
:
严密。只有含 的无色透明溶液才会出现此方案的现象
,
故方案乙严
密。
提示
:
不严密。如果试液中含有 而不含
,
当加入足量稀硝酸溶液后
,
被氧化成
,
再加入
Ba(NO
3
)
2
试液后出现不溶于稀硝酸的白色沉淀
,
故
方案丙不严密
(
干扰
)
。
【
规律方法
】
模型认知
——
无色溶液中离子推断的解题模板
【
案例示范
】
【
典例
】
(2020·
三明高二检测
)
铁红是一种广泛使用的红色颜料
,
其主要成分是
Fe
2
O
3
。其可以用于油漆、油墨、橡胶等工业中
,
可作为催化剂
,
玻璃、宝石、金属的抛光剂
,
可用作炼铁原料。如图是某学生设计的探究铁及其化合物的某些化学性质的流程图。下列有关叙述正确的是
(
)
A.
反应①的离子方程式为
Fe
2
O
3
+6H
+
====2Fe
3+
+3H
2
O
B.
检验乙溶液中的金属阳离子可用
KSCN
溶液
C.
反应③可制得一种红褐色的胶体
D.
物质丙在空气中能稳定存在
【
解题指南
】
解答本题注意以下两点
:
(1)
熟悉常见的离子的检验方法并能依据现象判断离子的存在。
(2)
注意运用“离子能否共存判断离子是否存在。
【
解析
】
选
A
。
A
项
,
甲、乙、丙分别为
FeCl
3
、
FeCl
2
和
Fe(OH)
2
,Fe
2
O
3
溶于酸生成
Fe
3+
,A
项正确。
B
项
,KSCN
溶液可检验
Fe
3+
,
不能检验
Fe
2+
,B
项错误。
C
项
,
Fe(OH)
2
为白色沉淀
,C
项错误。
D
项
,Fe(OH)
2
不稳定
,
在空气中易被氧化为
Fe(OH)
3
,D
项错误。
【
规律方法
】
离子检验中的干扰问题
(1)
进行离子检验时
,
需排除干扰离子的影响。
如检验 时
,
不能直接或间接引入
,
防止 的干扰
,
为排除
、 、
Ag
+
等的干扰
,
正确的操作是先向溶液中加稀盐酸没有气泡或
白色沉淀生成
,
再加
BaCl
2
溶液有白色沉淀
,
证明溶液中一定含有 。
(2)
对含多种离子的溶液分别进行离子检验时需要选择合适的顺序。
【
迁移
·
应用
】
(2020·
三明高二检测
)
一杯澄清透明的溶液中
,
已知各离子的浓度均为
0.1 mol·L
-1
,
体积为
1 L
。可能含有的离子
:
阳离子为
K
+
、
Fe
2+
、
Ba
2+
、
,
阴离子为
Cl
-
、 、 、 。向该混合液中加足量稀盐酸
,
有无色气
体生成
,
且阴离子的种类不变。下列对该溶液的叙述错误的是
(
)
A.
该溶液一定含有
Fe
2+
、 、
Cl
-
B.
该溶液一定不含
K
+
、
C.
该溶液一定不含 、
Ba
2+
D.
该溶液可能含有
【
解析
】
选
B
。加入足量稀盐酸
,
阴离子的种类不变
,
说明原溶液中肯定含有
Cl
-
,
且无
(
如有
,
加入足量稀盐酸
,
反应完全
,
种类改变
),
该气体只
能为
Fe
2+
与 在酸性条件下发生的氧化还原反应生成的
NO,
故肯定有
Fe
2+
、
、
Cl
-
,
肯定没有 。根据电荷守恒若溶液中有
,
就肯定含有
K
+
、
,
故
B
项错误
,D
项正确。若含
Ba
2+
,
则根据电荷守恒
,
阴离子除含
Cl
-
、
外
,
还得含
,
而
Ba
2+
与 不共存
,
故
C
项正确。
【
补偿训练
】
下列关于物质或离子检验的叙述正确的是
(
)
A.
在溶液中加
KSCN,
溶液显红色
,
证明原溶液中有
Fe
3+
,
无
Fe
2+
B.
气体通过无水硫酸铜
,
粉末变蓝
,
证明原气体中含有水蒸气
C.
灼烧白色粉末
,
火焰呈黄色
,
证明原粉末中有
Na
+
,
无
K
+
D.
将气体通入澄清石灰水
,
溶液变浑浊
,
证明原气体是
CO
2
【
解析
】
选
B
。
Fe
3+
遇
KSCN
会使溶液呈现红色
,Fe
2+
遇
KSCN
不反应无现象
,
如果该溶液既含
Fe
3+
,
又含
Fe
2+
,
滴加
KSCN
溶液
,
溶液呈红色
,
则证明存在
Fe
3+
,
但并不能证明无
Fe
2+
,A
项错误
;
气体通过无水硫酸铜
,
粉末变蓝
,
则发生反应
:CuSO
4
+5H
2
O
====CuSO
4
·5H
2
O,CuSO
4
·5H
2
O
为蓝色
,
故可证明原气体中含有水蒸气
,B
项正确
;
灼烧白色粉末
,
火焰呈黄色
,
证明原粉末中有
Na
+
,Na
+
焰色反应为黄色
,
但并不能证明无
K
+
,
因为
Na
+
的黄色对
K
+
的焰色反应具有干扰作用
,
故需透过蓝色的钴玻璃观察
K
+
的焰色反应
,C
项错误
;
能使澄清石灰水变浑浊的气体有
CO
2
、
SO
2
等
,
故将气体通入澄清石灰水
,
溶液变浑浊
,
则原气体不一定是
CO
2
,D
项错误。
【
课堂回眸
】
课堂检测
·
素养达标
1.(2020·
武汉高二检测
)
已知
,
环境中有很多金属离子可以与硫酸根离子结合
形成硫酸盐。大气中硫酸盐形成的气溶胶对材料有腐蚀破坏作用
,
危害动植物
健康
,
而且可以起催化作用
,
加重硫酸雾毒性
;
随降水到达地面以后
,
破坏土壤
结构
,
降低土壤肥力
,
对水系统也有不利影响。已知含有
Cu
2+
、
Fe
3+
、
Al
3+
、
Mg
2+
、 、
Na
+
、
Fe
2+
等离子的七种硫酸盐是常见的硫酸盐
,
下面的几种试剂
可以将以上七种硫酸盐溶液一次鉴别开来的是
(
)
A.NaOH
溶液
B.KSCN
溶液
C.NaHCO
3
溶液
D.NH
3
·H
2
O
溶液
【
解析
】
选
A
。加入
NaOH
溶液后分别会看到蓝色沉淀、红褐色沉淀、先有白色
沉淀后溶解、白色沉淀、气体、无明显现象、先有白色沉淀后迅速变为灰绿
色最后变为红褐色。
NH
3
·H
2
O
不能区分
Al
3+
和
Mg
2+
以及 和
Na
+
。
2.(2020·
温州高二检测
)
用
0.102 6 mol·L
-1
的盐酸滴定
25.00 mL
未知浓度的
氢氧化钠溶液
,
滴定达终点时
,
滴定管中的液面如图所示
,
正确的读数为
(
)
A.22.30 mL
B.22.35 mL
C.23.65 mL
D.23.70 mL
【
解析
】
选
B
。滴定管是一种精确度较高的仪器
,
每一小格为
0.10 mL,
零刻度在上
,
刻度自上而下逐渐增大。读数时视线要与凹液面的最低点相切
,
故读数为
22.35 mL
。
3.
下列有关实验中
,
用所选试剂
(
括号内物质
)
不能使实验达到目的的是
(
)
A.
证明
FeCl
2
溶液被氧化
(KSCN
溶液
)
B.
除去
C
2
H
6
中的
H
2
S
气体
(CuSO
4
溶液
)
C.
鉴别
SO
2
和
CO
2
两种气体
(
溴水
)
D.
检验
Na
2
SO
4
溶液中是否混有
NaCl(AgNO
3
)
溶液
【
解析
】
选
D
。
A
项中
Fe
2+
被氧化生成
Fe
3+
,
遇
KSCN
溶液显红色
,
故
A
正确
;B
项中的
H
2
S
气体与
CuSO
4
溶液反应能生成黑色的
CuS
沉淀
,
故
B
正确
;C
项中的
SO
2
能使溴水褪色
,
而
CO
2
不能
,
故
C
正确
;D
项中的
Na
2
SO
4
溶液也能与
AgNO
3
溶液反应生成白色沉淀
,
故
D
错误。
4.(2020·
金华高二检测
)
如图曲线
a
和
b
是盐酸与氢氧化钠溶液相互滴定的滴定曲线
,
下列叙述正确的是
(
)
世纪金榜导学号
A.
盐酸的物质的量浓度为
1 mol·L
-1
B.P
点时恰好完全反应
,
溶液呈中性
C.
曲线
a
是盐酸滴定氢氧化钠溶液的滴定曲线
D.
酚酞不能用作本实验的指示剂
【
解析
】
选
B
。由滴定起始时
pH=1
可知盐酸的浓度为
0.1 mol
·
L
-1
;
曲线
a
起始时溶液
pH=1,
可知是
NaOH
溶液滴定盐酸的曲线
;
酸碱中和滴定操作中可选用酚酞或甲基橙作为指示剂。
5.(2020·
日照高二检测
)
水体中的含氮化合物是引起富营养化的主要污染物
,
分析检测水体中的硝酸
(
盐
)
和亚硝酸
(
盐
)
含量
,
控制水体中的含氮污染物
,
对水资源的循环利用意义重大。
(1)
亚硝酸
(HNO
2
)
是一种弱酸
,
其电离平衡常数的表达式为
_________________________________________________
。
(2)
水体中亚硝酸的含量可以利用
KI
溶液进行分析测定。该测定反应中
,
含氮的生成物可以是
NO
、
N
2
O
、
NH
2
OH
、
NH
3
等。
①
NH
2
OH
中
,
氮元素的化合价为
________________
。
②
某水样中含有亚硝酸盐
,
加入少量稀硫酸酸化后
,
用
KI
溶液测定
,
且选用淀粉溶液作指示剂
,
反应中含
N
的生成物为
NO,
反应的离子方程式为
____________
________________________,
其中氧化产物为
________(
写化学式
)
。
③取
20 mL
含
NaNO
2
的水样
,
酸化后用
0.001 mol·L
-1
的
KI
标准溶液滴定
(
反应中含
N
的生成物为
NO),
滴定前和滴定后的滴定管内液面高度如图所示
,
由此可知水样中
NaNO
2
的浓度为
________ mg·L
-1
。
【
解析
】
(1)
亚硝酸的电离方程式为
HNO
2
+H
+
,
因此其电离平衡常数
K
a
= (2)①
根据化合物中所有元素的化合价代数和为
0
可知
,
NH
2
OH
中氮元素的化合价为
-1
。②亚硝酸具有氧化性
,
被
I
-
还原
,
生成
NO,I
-
被氧
化为
I
2
。③由滴定前后的滴定管读数可知消耗的
KI
标准溶液为
2.00 mL,
反应的
关系式为
NaNO
2
~
HNO
2
~
I
-
,
故
n(NaNO
2
)=n(I
-
)=2.00×10
-3
L×0.001 mol·L
-1
=2×10
-6
mol,
则水样中
NaNO
2
的浓度为
2×10
-6
mol×69 g·mol
-1
÷0.02 L
=6.9×10
-3
g·L
-1
=6.9 mg·L
-1
。
答案
:
(1)
(2)①-1
②
2HNO
2
+2I
-
+2H
+
====I
2
+2NO↑+2H
2
O(
或
2 +2I
-
+4H
+
====2NO↑+I
2
+2H
2
O)
I
2
③
6.9
相关文档
- 广西桂林市第十八中学2020-2021高2021-07-0815页
- 【化学】宁夏银川市宁夏大学附属中2021-07-0818页
- 人教版高二化学第十三章烃的衍生物2021-07-085页
- 2021届高考化学一轮复习原电池 化2021-07-084页
- 广西柳州市2021届高三化学上学期第2021-07-0815页
- 2019届高考化学一轮复习原子结构与2021-07-0819页
- 高中化学人教必修2课件-第三节 生2021-07-0837页
- 广东省肇庆市2020届高三第三次检测2021-07-0819页
- 2020年高考化学真题模拟题专项汇编2021-07-0812页
- 人教版高中化学选修5课件 第4章 第2021-07-0815页