- 553.15 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
安陆一中 2021 届高三年级 8 月诊断性考试
化 学 试 题
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Mn:55 Sn:119
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。
1.以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的
分析不合理的是( )
A.四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
B.商代后期铸造出工艺精湛的司母戊鼎,该鼎属于铜合金制品
C.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
2.下列物质的名称正确的是( )
A.C6H10O5:纤维素 B.[Ag(NH3)2]+:二氨合银离子
C.Na2SiO3:水玻璃 D. :2-甲基-1-丙醇
3.油条的做法是将矾、碱、盐按比例加入温水中,再加入面粉搅拌成面团;放置,使面
团产生气体,形成孔洞。放置过程发生反应:
2KAl(SO4)2·12H2O+3Na2CO3 = 2Al(OH)3↓+3Na2SO4+K2SO4+3CO2↑+21H2O
下列有关判断正确的是( )
A.放置过程发生的反应中,反应物和生成物均为电解质
B.放置过程发生的反应为氧化还原反应
C.反应的离子方程式为 2Al3++3CO32﹣==2Al(OH)3↓+3CO2↑
D.从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐
4.硒(Se)元素是人体必需的微量元素之一。下列说法正确的是( )
A. 硒的摄入量越多对人体健康越好 B. SeO32-空间构型为正四面体
C. H2Se 的熔沸点比 H2S 高 D. H2SeO4 的酸性比 H2SO4 强
5.设 NA 为阿伏加德罗常数的数值,下列说法正确的是( )
A.2.8g14N2 与 14C16O 的混合物中,中子数目为 l.4NA
B.含 0. l molFeCl3 的溶液与 0. l mol 锌充分反应,转移电子数为 0.l NA
C.标准状况下,5.6gC4H8 中 C-C 的数目可能为 0.4NA
D.某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的 OH-数目为 10-5 NA
2
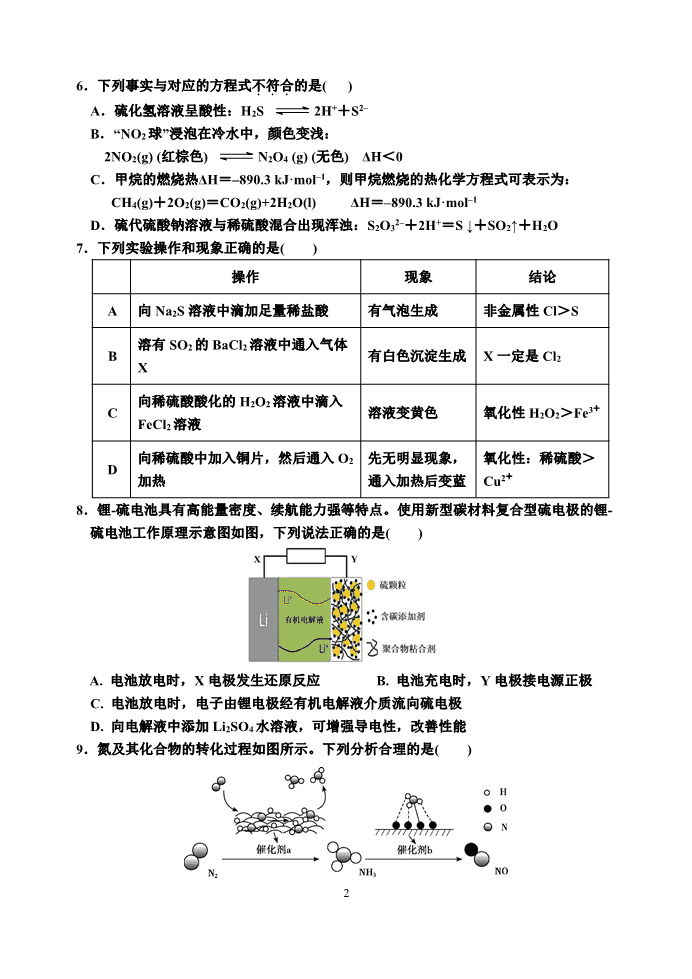
6.下列事实与对应的方程式不符合...的是( )
A.硫化氢溶液呈酸性:H2S 2H++S2–
B.“NO2 球”浸泡在冷水中,颜色变浅:
2NO2(g) (红棕色) N2O4 (g) (无色) ΔH<0
C.甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S ↓+SO2↑+H2O
7.下列实验操作和现象正确的是( )
操作 现象 结论
A 向 Na2S 溶液中滴加足量稀盐酸 有气泡生成 非金属性 Cl>S
B
溶有 SO2 的 BaCl2 溶液中通入气体
X
有白色沉淀生成 X 一定是 Cl2
C
向稀硫酸酸化的 H2O2 溶液中滴入
FeCl2 溶液
溶液变黄色 氧化性 H2O2>Fe3+
D
向稀硫酸中加入铜片,然后通入 O2
加热
先无明显现象,
通入加热后变蓝
氧化性:稀硫酸>
Cu2+
8.锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-
硫电池工作原理示意图如图,下列说法正确的是( )
A. 电池放电时,X 电极发生还原反应 B. 电池充电时,Y 电极接电源正极
C. 电池放电时,电子由锂电极经有机电解液介质流向硫电极
D. 向电解液中添加 Li2SO4 水溶液,可增强导电性,改善性能
9.氮及其化合物的转化过程如图所示。下列分析合理的是( )
3
A. 催化剂 a 表面发生了极性共价键的断裂和形成
B. 催化剂 a、b 能提高反应的平衡转化率
C. 在催化剂 b 表面形成氮氧键时,不涉及电子转移
D. N2 与 H2 反应生成 NH3 的原子利用率为 100%
10.习主席在 2020 年新年贺词中强调“5G 商用加速推出,凝结着新时代奋斗者的心血和
汗水,彰显了不同凡响的中国风采、中国力量”,制造芯片用到高纯硅,用 SiHCl3 与过
量 H2 在 1100~1200℃反应制备高纯硅的装置如下图所示(热源及夹持装置略去)。
已知: SiHCl3 遇水 H2O 强烈水解,在空气中易自燃。下列说法错误的是( )
A.装置 B 中的试剂是浓硫酸 B.实验时先打开装置 C 中分液漏斗的旋塞
C.装置 C 中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化
D.装置 D 不能采用普通玻璃管的原因是在反应温度下,普通玻璃管会软化
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题意,
全部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11.向盛有 KMnO4 溶液的试管中加入过量的 MnSO4 溶液,产生黑色沉淀,溶液由紫红色
变为无色;过滤,向滤液中加入少量的铋酸钠(NaBiO3)粉末,溶液又变为紫红色。下列
推断错误的是( )
A. 氧化性:NaBiO3>KMnO4>MnO2 B. 生成 8.7g 黑色沉淀,转移 0.2mol 电子
C. 利用 NaBiO3 可以检验溶液中的 Mn2+ D. NaBiO3 不能与浓盐酸发生反应生成氯气
12. 甲、乙均为 1L 的恒容密闭容器,向甲中充入 1molCH4 和 1molCO2,乙中充入 1molCH4
和 nmolCO2,在催化剂存在下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得
CH4 的平衡转化率随温度的变化如图所示。下列说法正确的是( )
A. 该反应的正反应是吸热反应
B. 773K 时,该反应的平衡常数小于 12.96
C. H2 的体积分数: φ(b)=φ(c)
D. 873K 时,向甲的平衡体系中再充入 CO2、CH4
各 0.4mol,CO、H2 各 1.2mol,平衡不发生移动
13.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中 W、X、Y、Z
均为短周期元素且原子序数依次增大。常温下,0.1 mol/L Z 的氢化物的水溶液中
4
c(H+ )=0.1 mol/L,且 Z 与 Y 位于不同周期。下列叙述正确的是( )
A.原子半径:W> X> Y
B.氢化物的沸点: X>Y> Z> W
C.X 的氧化物的水化物是强酸
D.Y 的单质均具有杀菌消毒作用
14.某实验小组探究 SO2 与 AgNO3 溶液的反应,实验记录如下表,下列说法正确的是( )
A. 通过测Ⅰ中无色溶液 a 的 pH 可以判断 SO2 是否被氧化
B. 实验Ⅱ说明白色沉淀 b 具有还原性
C. 实验Ⅲ说明溶液 a 中一定有 2-
4SO 生成
D. 实验Ⅰ、Ⅱ、Ⅲ说明 SO2 与 AgNO3 溶液反应既有 Ag2SO4 生成,又有 Ag2SO3 生成
15. 室温时,向 100mL 0.1mol·L-1 NH4HSO4 溶液中滴加 0.1mol·L-1NaOH 溶液,溶液 pH
随 NaOH 溶液体积的变化如图所示。下列说法正确的是( )
A. 图中 a、b、c、d 四个点,水的电离程度最大的是 d 点
B. a 点处存在 c(NH4+)+c(NH3·H2O)=0.1mol·L-1
C. b 点处存在 c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D. 由 b 到 c 发生反应的离子方程式为 NH4++OH-=NH3·H2O
序号 Ⅰ Ⅱ Ⅲ
实验
步骤
实 验
现象
得到无色溶液 a 和白
色沉淀 b
产生无色气体,遇空气变为
红棕色
产生白色沉淀
5
三、非选择题:本题共 5 小题,共 60 分。
16.(12 分)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵
((NH4)3Fe(C6H5O7)2)。
(1)Fe 基态原子核外电子排布式为_________________________; 2
2 6Fe H O
中与
Fe2+配位的原子是_________。
(2)NH3 分子中氮原子的轨道杂化类型是____________;与 NH +
4 互为等电子体的一种分
子为_________(填化学式)。
(3)柠檬酸的结构简式见右图。1 mol 柠檬酸分子中
碳原子与氧原子形成的σ键的数目为_______mol。
(4) 2CaCN 是离子化合物,各原子均满足 8 电子稳定结构, 2CaCN 的电子式是_______。
17.(12 分)某小组探究 2 3Na SO 溶液和 3KIO 溶液的反应原理。
(实验一)将含淀粉的 -1
2 30.01mol L Na SO 溶液加入 -1
30.01mol L KIO 酸性溶液(过量)
中,混合后约 5 秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
(1)溶液变蓝,说明 3KIO 具有__________性。
(2)查阅文献: 反应Ⅰ: - 2- - 2-
3 3 4IO +3SO =I +3SO 慢
反应Ⅱ: - -
3IO +I + _____=_____+_____ 较快
反应Ⅲ: 2- - 2- +
2 3 2 4I +SO +H O=2I +SO +2H 快
写出酸性条件下,反应Ⅱ的离子方程式______________________________________。
(3)向实验一所得蓝色溶液中加入少量 2 3Na SO 溶液,蓝色迅速褪去,后又变蓝色。据此
得出 2I 氧化性比 -
3IO 强,该结论______(填“合理”或“不合理”),理由是____ 。
(4)为了进一步研究 2 3Na SO 溶液和 3KIO 溶液的反应原理,设计如下实验。
(实验二)装置如图所示, K 闭合后,电流表的指针偏转情况记录如表:
表盘
时间
/min 10~t 2 3t ~t 4t
偏转
位置
右偏至
“Y”处
指针回到“0”处,又返至“X”
处;如此周期性往复多次
指针归
零
6
① K 闭合后,检验 b 极附近溶液存在放电产物 2-
4SO 的实验操作是______________。
② 1t 时,直接向 a 极区滴加淀粉溶液,溶液未变蓝。取 a 极附近溶液于试管中,滴
加淀粉溶液,溶液变蓝。判断 -
3IO 在 a 极放电的产物是__________。
(5)下列关于上述实验解释合理的是__________(填字母序号)。
A.实验一中:5 秒内无明显变化,可能是因为反应Ⅰ的活化能太小,反应速率太慢
B.实验二中:指针回到“0”处,可能是因为反应Ⅱ比反应Ⅰ快,导致 -
3IO 难与 2-
3SO 发
生反应
C.实验二中:又返至“X”处,可能是因为发生了反应Ⅲ,重新形成了原电池
18(11 分)苯胺( )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:① 和 NH3 相似,与盐酸反应生成易溶于水的盐
②用硝基苯制取苯胺的反应原理:2 +3Sn+12HCl→2 +3SnCl4+4H2O
③有关物质的部分物理性质见表:
物质 熔点/℃ 沸点/℃ 溶解性 密度/g∙cm-3
苯胺 -6.3 184 微溶于水,易溶于乙醚 1.02
硝基苯 5.7 210.9 难溶于水,易溶于乙醚 1.23
乙醚 -116.2 34.6 微溶于水 0.7134
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为_________;
用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是_________________________。
Ⅱ.制备苯胺。往图所示装置(夹持装置略,下同)的冷凝管口
分批加入 20mL 浓盐酸(过量),置于热水浴中回流 20min,
使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量 50%
NaOH 溶液,至溶液呈碱性。
7
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加 NaOH 溶液的主要目的是析出苯胺,反应的离子方程式为__________________。
Ⅲ.提取苯胺。
i.取出上图所示装置中的三颈烧瓶,
改装为如右图所示装置:
ii.加热装置 A 产生水蒸气,烧瓶 C 中收集到苯胺与水的混合物;分离混合物得到粗
苯胺和水溶液。
iii.往所得水溶液加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃
取液。
iv.合并粗苯胺和乙醚萃取液,用 NaOH 固体干燥,蒸馏后得到苯胺 2.79g。
(4)操作 ii 中,为了分离混合物,取出烧瓶 C 前,应先打开止水夹 d,再停止加热,理
由是_____________________________________。
(5)该实验中苯胺的产率为 _____________。
19.(12 分)氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精
矿为原料生产 CuCl 的工艺如下:
已知 CuCl 难溶于醇和水,溶于 c(Cl-)较大的体系[CuCl(s)+Cl- CuCl2-],潮湿空气
中易水解氧化。
(1)步骤 1 开始前需要对硫化铜精矿进行粉碎,目的是__________________________;
(2)步骤 1 是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
______________________________;
(3)步骤 2 是溶解过程,溶解时反应的离子方程式____ ;
(4)步骤 3 为主反应,Cu+的沉淀率与加入的 NH4Cl
的量关系如图所示。
①比较 c(Cu+)相对大小:A 点______C 点(填“>”、“<”或“=”);
②提高 C 点状态混合物中 Cu+沉淀率的措施是______________
______________________________________________________
8
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是 。
20.(13 分)1,3 - 环己二酮( )常用作医药中间体,用于有机合成。下列是
一种合成 1,3-环己二酮的路线。
回答下列问题:
(1)甲的分子式为 ___________________。
(2)丙中含有官能团的名称是______________________ 。
(3)反应①的反应类型是 _____________;反应②的反应类型是 ______________。
(4)反应③的化学方程式为_______________________________________________。
(5)符合下列条件的乙的同分异构体共有_____________种。
①能发生银镜反应
②能与 NaHCO3 溶液反应,且 1 mol 乙与足量 NaHCO3 溶液反应时产生气体 22. 4
L( 标准状况)写出其中在核磁共振氢谱中峰面积之比为 1 : 6 : 2 : 1 的一种同分异构
体的结构简式 __________________。(任意一种)
(6)设计以乙醇、 (丙酮)为原料制备 (2,4 -戊二酮)的合成
路线___________________________________________________________(无机试任
选)。
1
2021 届高三年级 8 月诊断性考试化学答案
1-5:ABDCC 6-10:ACBDB 11-15:BD AB A B CD
16(12 分,每空 2 分)
(1)1s22s22p63s23p63d64s2 或[Ar]3d64s2 O 或氧
(2)sp3 CH4 或 SiH4 (3) 7
(4)
2-.. ..
2+
.. ..
Ca N::C::N
17(12 分,除标注外,每空 2 分)
(1)氧化 ----------------- 1 分
(2) 3 2 2IO 5I 6H 3I 3H O +
(3)不合理 ------------------- 1 分
由于反应Ⅲ比反应Ⅰ快,故现象显示 2I 与 2
3SO 的反应,但速率快不能说明氧化性就强
(4)取样于试管中,先加入过量稀 HCl 除去 2
3SO ,再滴加少量 2BaCl 溶液,有白色沉
淀生成 I
(5)BC
18(11 分,除标注外,每空两分)
(1)NH3+HCl=NH4Cl 苯胺沸点较高,不易挥发
(2) b ------------------1 分
(3)C6H5NH3++OH-→ C6H5NH2+H2O
(4) 防止 B 中液体倒吸 (5) 60.0%
19(12 分,每空 2 分)
(1) 增大接触面积、加快反应速率、提高铜的浸出速率等合理性答案
(2)CuS+H2SO4+H2O2=CuSO4+S+2H2O
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 或 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
2
(4) ① > ②加水稀释 (5) HNO3 具有强氧化性会把 CuCl 氧化
20(13 分,除标注外,每空 2 分)
(1)C6H11Br --------------- 1 分
(2)醛基、羰基(酮基)
(3)消去反应 ---------1 分 氧化反应 ----------1 分
(4) +CH3CH2OH
+H2O
(5)12 或
(6)CH3CH2OH CH3COOH CH3COOCH2CH3
相关文档
- (3份)2020-2021学年高三(上)化学月考2021-07-0828页
- 【化学】江苏省扬州中学2019-20202021-07-0811页
- 【化学】山东省德州市夏津第一中学2021-07-0820页
- 【化学】四川省射洪县射洪中学20192021-07-0821页
- 【化学】黑龙江省安达市第七中学202021-07-0815页
- 【化学】福建省漳平市第一中学20192021-07-0817页
- 【化学】河南省安阳市林州市第一中2021-07-0816页
- 【化学】山东省济南历城二中2019-22021-07-0818页
- 【化学】河北省保定市易县中学20192021-07-0821页
- 【化学】山东省济宁市汶上圣泽中学2021-07-0819页