- 965.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考总复习
第1讲 化学能与热能
[考纲要求]
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能正确书写热化学方程式。4.了解焓变与反应热的含义。了解ΔH=H(反应产物)-H(反应物)表达式的含义。5.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。6.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
反应热和热化学方程式
知识梳理
1.化学反应中的能量变化
(1)化学反应中的两大变化:____变化和____变化。
(2)化学反应中的两大守恒:____守恒和____守恒。
(3)化学反应中的能量转化形式:____、光能、电能等。通常主要表现为____的变化。
2.反应热、焓变
(1)反应热
在化学反应过程中__________________通常叫做反应热。
(2)焓变
生成物与反应物的焓值差。
恒压条件下,化学反应的______等于焓变。
(3)符号:____。
(4)单位:______或________。
3.吸热反应和放热反应
(1)从能量高低角度理解
ΔH<0,放热反应 ΔH>0,吸热反应
(2)从化学键角度理解
22
高考总复习
ΔH=E1(反应物键能)-E2(生成物键能)
若E1E2,ΔH>0,吸热反应
4.热化学方程式概念及意义
(1)表示参加反应________和______关系的化学方程式。
(2)热化学方程式的意义
表明了化学反应中的________变化和________变化。
如:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
表示在25 ℃,101 kPa时,__________________生成____________,同时放出____________。
5.热化学方程式书写步骤
[回扣判断](正确的打“√”,错误的打“×”)
(1)物质发生化学变化都伴有能量的变化( )
(2)放热反应不需要加热就能反应,吸热反应不加热就不能反应( )
(3)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同( )
(4)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关( )
(5)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定( )
(6)2H2O(l)===2H2(g)+O2(g)的焓变ΔH>0( )
(7)H2(g)+O2(g)===H2O(l) ΔH1和
2H2(g)+O2(g)===2H2O(l) ΔH2中的ΔH1=ΔH2( )
(8)H2(g)+O2(g)===H2O(g) ΔH1和H2O(g)===H2(g)+O2(g) ΔH2中的ΔH1=ΔH2( )
22
高考总复习
[重点提醒]
常见的放热反应和吸热反应
1.放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
2.吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
对点速练
练点一 识图判断相关概念
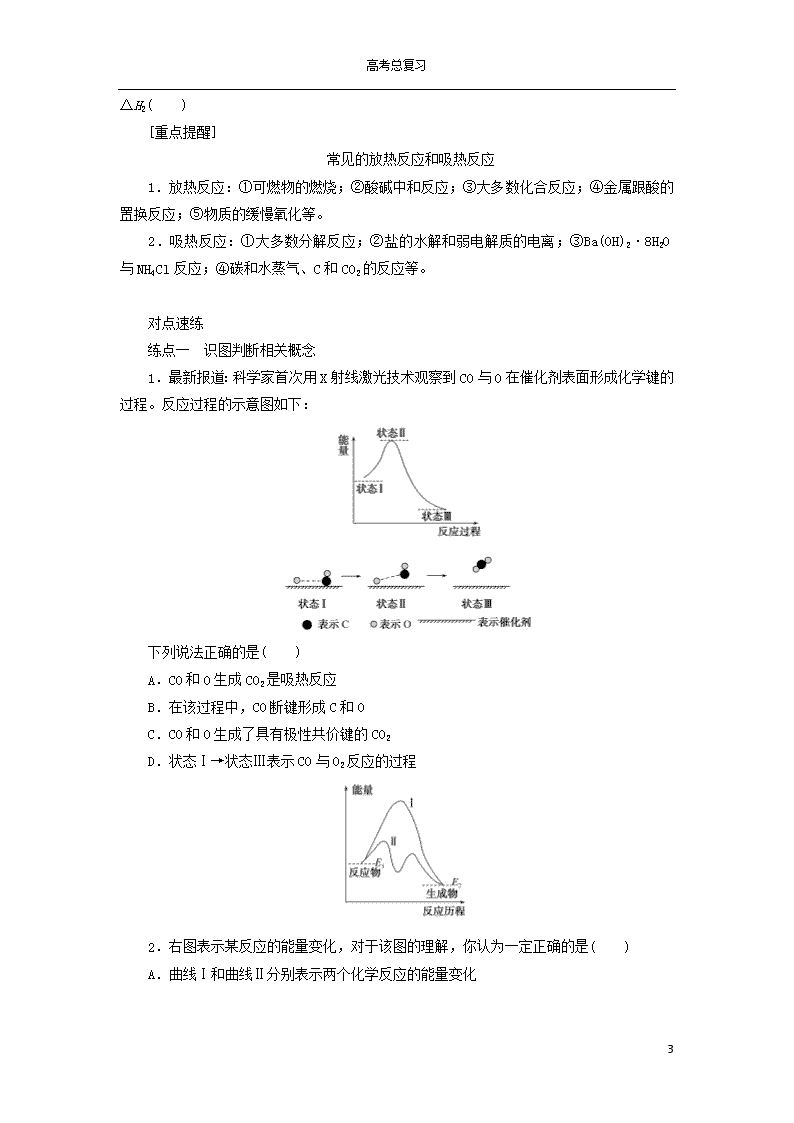
1.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
2.右图表示某反应的能量变化,对于该图的理解,你认为一定正确的是( )
A.曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化
B.曲线Ⅱ可表示反应2KClO32KCl+3O2↑的能量变化
22
高考总复习
C.该反应不需要加热就能发生
D.该反应的ΔH=E2-E1
3.某反应过程中体系的能量变化如图所示,下列说法错误的是( )
A.反应过程可表示为 ―→ ―→
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
练后归纳
正确理解活化能与反应热的关系
(1)催化剂能降低反应所需活化能,但不影响焓变的大小。
(2)在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即E1=E2+|ΔH|。
练点二 读图判断热化学方程式正误
4.已知1 g H2(g)完全转化成H2O,其能量变化如图所示,则下列表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)===2H2O(g) ΔH=+285.8 kJ/mol
22
高考总复习
B.2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol
C.2H2(g)+O2(g)===2H2O(g) ΔH=+571.6 kJ/mol
D.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
5.根据能量变化示意图,下列热化学方程式书写正确的是( )
A.C(金刚石,s)+O2(g)===CO2(g) ΔH=(E4-E1) kJ/mol
B.2C(石墨,s)+O2(g)===2CO(g) ΔH=(E2-E3) kJ/mol
C.C(石墨,s)=C(金刚石,s) ΔH=(E3-E4) kJ/mol
D.2CO2(g)===2CO(g)+O2(g) ΔH=2(E2-E1) kJ/mol
练点三 信息型热化学方程式的书写
6.写出满足下列给定信息条件的热化学方程式:
(1)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,则表示H2燃烧热的热化学方程式:________________。
(2)101 kPa时,1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,反应的热化学方程式:________________。
(3)0.3 mol乙硼烷(分子式B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为________________________________________________________________________。
(4)已知1 mol Na的单质在足量O2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放出190.0 kJ的热量,该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(6)化学反应N2+3H22NH3的能量变化如下图所示(假设该反应反应完全)。
22
高考总复习
写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:________________________________________________________________________。
技能归纳
“五审”法突破热化学方程式的正误判断
燃烧热、中和热
知识梳理
1.燃烧热
(1)概念:在101 kPa时,______纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→______,H→________,S→________等。
(2)在书写热化学方程式时,应以燃烧1
22
高考总复习
mol物质为标准来配平其余物质的化学计量数。例如:
C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5 518 kJ·mol-1。
2.中和热
(1)概念:在稀溶液中,强酸跟强碱发生中和反应生成______________时的反应热叫中和热。
(2)用离子方程式可表示为OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
3.中和热的测定
(1)装置(请在横线上填写仪器名称)
(2)计算公式
ΔH=- kJ·mol-1
t1—起始温度,t2—终止温度,n—生成水的物质的量。
(3)注意事项
①泡沫塑料板和碎泡沫塑料(或纸条)的作用是____________________________________。
②为保证酸完全中和,采取的措施是__________。
4.能源
(1)能源分类
(2)解决能源问题的措施
①提高能源的利用效率。
②开发新能源。
22
高考总复习
[回扣判断](正确的打“√”,错误的打“×”)
(1)甲烷的标准燃烧热ΔH=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ·mol-1( )
(2)在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量为57.3 kJ( )
(3)NaHCO3+H2HCOONa+H2O反应中,储氢、释氢过程均无能量变化( )
(4)随着科技的发展,氢气将成为主要能源之一( )
(5)粮食作物是制乙醇燃料的主要原料( )
(6)开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM 2.5的含量( )
(7)低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放( )
[重点提醒]
中和热测定实验误差分析
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液反应的误差分析:
引起误差的实验操作
t终-t始
|ΔH|
保温措施不好
偏小
偏小
搅拌不充分
偏小
偏小
所用酸、碱浓度过大
偏大
偏大
用同浓度的氨水代替NaOH溶液
偏小
偏小
用同浓度的醋酸代替盐酸
偏小
偏小
用50 mL 0.50 mol·L-1 NaOH溶液
偏小
偏小
对点速练
练点一 燃烧热、中和热的判断与计算
1.下列热化方程式中ΔH的数值表示可燃物燃烧热的是( )
A.CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1
2.下列说法正确的是( )
A.葡萄糖的燃烧热是2 800 kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
22
高考总复习
B.已知101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则该反应的反应热为221 kJ·mol-1
C.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
D.已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1
3.测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如图所示)。
(1)图中尚缺少的一种仪器是________。
(2)实验时环形玻璃搅拌棒的运动方向是________。
a.上下运动 b.左右运动
c.顺时针运动 d.逆时针运动
(3)写出反应的热化学方程式为________________________________________________________________________
________________________________________________________________________(中和热为57.3 kJ·mol-1)。
(4)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L-1 30 mL硫酸进行实验,通过多次实验测定中和热ΔH=-53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
练点二 能源问题
4.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可能再生。下列属于未来新能源的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.③④⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.⑤⑥⑦⑧
22
高考总复习
5.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
盖斯定律及其应用
知识梳理
1.盖斯定律
化学反应的反应热只与反应的__________________________有关,而与具体反应进行的____无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是____的,这就是盖斯定律。
2.盖斯定律的意义
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:反应C(s)+O2(g)===CO(g)的ΔH无法直接测得,可以结合下述两个反应的ΔH,利用盖斯定律进行计算。
C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
ΔH1=ΔH2+ΔH3
ΔH3=ΔH1-ΔH2
=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)
=-110.5 kJ·mol-1
22
高考总复习
则C(s)+O2(g)===CO(g) ΔH3=-110.5 kJ·mol-1
[回扣判断]
1.试比较下列各组ΔH的大小。
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
则ΔH1________ΔH2(填“>”、“<”或“=”,下同)。
(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1________ΔH2。
(3)两个有联系的不同反应相比
C(s)+O2(g)===CO2(g) ΔH1<0
C(s)+O2(g)===CO(g) ΔH2<0
则ΔH1________ΔH2。
2.已知室温下,将CuSO4·5H2O(s)溶于水会使溶液温度降低,将CuSO4(s)溶于水会使溶液温度升高,则下列能量转化关系的判断不正确的是( )
A.ΔH1>0 B.ΔH2>ΔH3
C.ΔH3>ΔH1 D.ΔH2=ΔH1+ΔH3
[重点提醒]
根据盖斯定律计算时的注意点
(1)参照目标热化学方程式,结合原热化学方程式(一般为2~3个)进行合理“变形”,(如热化学方程式颠倒、乘或除以某一个数,然后将它们相加、减。)可得出目标热化学方程式的ΔH与原热化学方程式ΔH之间的换算关系。
(2)当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号。
(3)将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
22
高考总复习
(4)在涉及反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
对点速练
练点一 利用盖斯定律计算反应热
1.已知:
①CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
②H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CH3OH(g)+O2(g)===CO2(g)+2H2O(l)的ΔH为( )
A.+478.7 kJ·mol-1 B.-764.5 kJ·mol-1
C.-478.7 kJ·mol-1 D.+764.5 kJ·mol-1
2.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为( )
A.3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
练点二 利用盖斯定律比较ΔH大小
3.已知:
①H2(g)+O2(g)===H2O(g)ΔH1=a kJ·mol-1
②2H2(g)+O2(g)===2H2O(g)ΔH2=b kJ·mol-1
③H2(g)+O2(g)===H2O(l)ΔH3=c kJ·mol-1
④2H2(g)+O2(g)===2H2O(l)ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.ad>0
C.2a=b<0 D.2c=d>0
4.已知5个热化学方程式如下:
①2H2(g)+O2(g)===2H2O(g) ΔH1
②3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
22
高考总复习
③2Fe(s)+O2(g)===Fe2O3(s) ΔH3
④2Al(s)+O2(g)===Al2O3(s) ΔH4
⑤2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1<0,ΔH3>0 B.ΔH5<0,ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
方法技巧
反应热大小比较法——盖斯定律“矢量三角”
(1)同一个反应,生成物的状态不相同
有如下两个热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH1和2H2(g)+O2(g)===2H2O(l) ΔH2(ΔH1和ΔH2都小于0),请比较ΔH1和ΔH2的大小。
结合反应本身的特点,设计如下的“矢量三角”:
依据盖斯定律得ΔH1+ΔH3=ΔH2,即ΔH2-ΔH1=ΔH3<0,故ΔH1>ΔH2。
(2)同一个反应,反应物的状态不相同
有如下两个热化学方程式:S(s)+O2(g)===SO2(g) ΔH1和S(g)+O2(g)===SO2(g) ΔH2(ΔH1和ΔH2都小于0),请比较ΔH1和ΔH2的大小。
结合反应本身的特点,设计如下的“矢量三角”:
依据盖斯定律得ΔH3+ΔH1=ΔH2,即ΔH2-ΔH1=ΔH3<0,故ΔH1>ΔH2。
(3)对于不同反应,当它们之间有关联时
有如下两个热化学方程式:C(s)+O2(g)===CO2(g) ΔH1和C(s)+O2(g)===CO(g) ΔH2(ΔH1和ΔH2都小于0),请比较ΔH1和ΔH2的大小。
结合反应本身的特点,设计如下的“矢量三角”:
22
高考总复习
依据盖斯定律得ΔH2+ΔH3=ΔH1,即ΔH1-ΔH2=ΔH3<0,故ΔH2>ΔH1。
练点三 利用盖斯定律书写热化学方程式
5.运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s)
ΔH=-2 983.2 kJ·mol-1
②P(红磷,s)+O2(g)===P4O10(s)
ΔH=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为( )
A.P4(白磷,s)===4P(红磷,s)ΔH=-29.2 kJ·mol-1
B.P4(白磷,s)===4P(红磷,s)ΔH=+29.2 kJ·mol-1
C.P4(白磷,s)===4P(红磷,s)
ΔH=-2 244.7 kJ·mol-1
D.P4(白磷,s)===4P(红磷,s)ΔH=+2 244.7 kJ·mol-1
6.阅读信息,写出指定条件的热化学方程式。
(1)工业上制取硝酸铵的流程图如下所示:
已知:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g)
ΔH=-1 745.2 kJ·mol-1;
6NO(g)+4NH3(g)5N2(g)+6H2O(g)
ΔH=-1 925.2 kJ·mol-1。
则反应Ⅰ的热化学方程式可表示为________________________________________________________________________
________________________________________________________________________。
(2)饮用水中的NO主要来自于NH。已知在微生物的作用下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
22
高考总复习
1 mol NH全部被氧化成NO的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
1.[2019·全国卷Ⅲ,28(2)]Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)===CuCl(s)+Cl2(g)
ΔH1=83 kJ·mol-1
CuCl(s)+O2(g)===CuO(s)+Cl2(g)
ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)===CuCl2(s)+H2O(g)
ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)的ΔH=________ kJ·mol-1。
2.[2018·全国卷Ⅱ,27(1)]CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4-CO2催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
C(s)+O2(g)===CO(g) ΔH=-111 kJ·mol-1
该催化重整反应的ΔH=________ kJ·mol-1。
3.[2017·全国卷Ⅲ,28(3)]已知:As(s)+H2(g)+2O2(g)===H3AsO4(s) ΔH1
H2(g)+O2(g)===H2O(l) ΔH2
2As(s)+O2(g)===As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)===2H3AsO4(s)的ΔH=________。
4.[2019·浙江4月,23]MgCO3和CaCO3的能量关系如图所示(M===Ca、Mg):
22
高考总复习
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( )
A.ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
5.[2017·北京卷,26]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1 412
熔点/℃
-69
-25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)===2CO(g)
ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:______________________。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH________0(填“>”“<”或“=”),判断依据:____________________。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3
22
高考总复习
溶液,则尾气的吸收液依次是______________________。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
物质a是__________,T2应控制在__________。
6.[2016·海南卷]油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)===57CO2(g)+52H2O(l)
已知燃烧1 kg该化合物释放出热量3.8×104 kJ,油酸甘油酯的燃烧热为( )
A.3.8×104 kJ·mol-1
B.-3.8×104 kJ·mol-1
C.3.4×104 kJ·mol-1
D.-3.4×104 kJ·mol-1
22
高考总复习
第六章 化学反应与能量
第1讲 化学能与热能
基础精讲练
考点一
1知识梳理
1.(1)物质 能量 (2)质量 能量 (3)热能 热量
2.(1)所释放或吸收的热量 (2)反应热 (3)ΔH (4)kJ·mol-1 kJ/mol
4.(1)物质的量 反应热 (2)物质 能量 1 mol固体碳和1 mol氧气反应 1 mol二氧化碳 393.5 kJ的热量
回扣判断 答案:(1)√ (2)× (3)× (4)√ (5)√ (6)√ (7)× (8)×
2对点速练
1.解析:A项,由能量—反应过程图像中状态Ⅰ和状态Ⅲ知,CO和O生成CO2是放热反应,错误;B项,由状态Ⅱ知,在CO与O生成CO2的过程中CO没有断键形成C和O,错误;C项,由状态Ⅲ及CO2的结构式O===C===O知,CO2分子中存在碳氧极性共价键,正确;D项,由能量—反应过程图像中状态Ⅰ(CO和O)和状态Ⅲ(CO2)分析,状态Ⅰ→状态Ⅲ表示CO和O原子反应生成CO2的过程,错误。
答案:C
2.解析:曲线Ⅰ(表示没有使用催化剂)和曲线Ⅱ(表示使用了催化剂)是同一个反应的能量变化,A项错误;曲线Ⅱ可以表示使用了催化剂的放热反应的能量变化,但二氧化锰催化氯酸钾分解的反应属于吸热反应,B项错误;放热反应不一定不需要加热,C项错误;反应的ΔH等于生成物的总能量减去反应物的总能量,D项正确。
答案:D
3.解析:由图可知,正反应放热,ΔH为负值;逆反应吸热,ΔH为正值,D错误。
答案:D
4.解析:由图可知,1 g H2(g)(即0.5 mol)和8 g O2(g)(即0.25 mol)完全反应生成H2O(l)放出142.9 kJ能量,据此写出热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol。
答案:D
5.解析:A项由图可知,1 mol O2(g)+1 mol C(金刚石,s)具有的能量为E4 kJ,1 mol CO2(g)具有的能量为E1 kJ,且E4>E1,则反应C(金刚石,s)+O2(g)===CO2(g)为放热反应,ΔH=(E1-E4) kJ/mol,错误。B项,1 mol CO(g)+0.5 mol O2(g)具有的能量为E2
22
高考总复习
kJ,则反应C(石墨,s)+O2(g)===CO(g)的ΔH=(E2-E3) kJ/mol,错误。C项,由图可知,C(石墨,s)===C(金刚石,s)为吸热反应,则有ΔH=(E4-E3) kJ/mol,错误。D项,由图可知,CO2(g)===CO(g)+O2(g)为吸热反应,ΔH=(E2-E1) kJ/mol,从而可知2CO2(g)===2CO(g)+O2(g)的ΔH=2(E2-E1) kJ/mol,正确。
答案:D
6.答案:(1)H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
(3)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l)
ΔH=-2 165 kJ·mol-1
(4)2Na(s)+O2(g)===Na2O2(s) ΔH=-511 kJ·mol-1
(5)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 520.0 kJ·mol-1
(6)N2(g)+3H2(g)2NH3(l) ΔH=-2(c+b-a) kJ·mol-1
考点二
1知识梳理
1.(1)1 mol CO2(g) H2O(l) SO2(g)
2.(1)1 mol液态H2O
3.(1)环形玻璃搅拌棒 温度计 (3)保温隔热,减少实验过程中的热量损失 使碱稍过量
回扣判断 答案:(1)× (2)× (3)× (4)√ (5)√ (6)√ (7)√
2对点速练
1.解析:A项,符合燃烧热的概念,正确;B项,生成物中的水是气体,属于不稳定氧化物,错误;C项,热化学方程式中是2 mol可燃物氢气燃烧放热,不符合燃烧热的概念,错误;D项,HCl不是氧化物,不符合燃烧热的概念要求,错误。
答案:A
2.答案:A
3.解析:实验测定中和热ΔH=-53.5 kJ·mol-1与57.3 kJ·mol-1有偏差,是因为实验过程中热量有散失。此实验中硫酸过量,用量筒量取NaOH溶液的体积时仰视读数使NaOH的量偏多,所测中和热数值偏大。
答案:(1)温度计 (2)a
22
高考总复习
(3)NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
或2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
(4)b
4.解析:新能源要符合污染小,可再生性强等特点,选D。
答案:D
5.解析:水的分解是吸热反应,A错误;氢能源由于受贮存和运输等因素的限制,还未普遍使用,但有巨大的开发利用的价值,B、D错误。
答案:C
考点三
1知识梳理
1.始态(各反应物)和终态(各生成物) 途径 相同
回扣判断
1.答案:(1)> (2)< (3)<
2.解析:A项,CuSO4·5H2O(s)受热分解生成CuSO4(s),为吸热反应,ΔH1>0,正确;B项,ΔH2>0,ΔH3<0,则ΔH2>ΔH3,正确;C项,ΔH3<0,ΔH1>0,则ΔH3<ΔH1,错误;D项,根据盖斯定律可知:ΔH2=ΔH1+ΔH3,正确。
答案:C
2对点速练
1.解析:分析题给热化学方程式可知,要得到目标热化学方程式,应将①和②中的H2(g)消去,而①和②中的H2(g)分别在方程式的两边,因此通过②×2+①即可得到目标热化学方程式,则CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=(-285.8 kJ·mol-1×2)+(-192.9 kJ·mol-1)=-764.5 kJ·mol-1。
答案:B
2.解析:由题可得
C(s)+O2(g)===CO2(g) ΔH1=a kJ·mol-1①
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1②
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1③
由盖斯定律得①×3+②-③为所给方程式,即x=3a+b-c,选A。
答案:A
3.解析:由于氢气的燃烧是放热反应,故四个反应的ΔH都小于0,即B、D错误;①、②式反应物、生成物的状态相同,①×2=②,即2ΔH1=ΔH2,2a=b,又H2
22
高考总复习
的燃烧反应为放热反应,故2a=b<0,C正确;③-①得:H2O(g)===H2O(l),由于气态水转变为液态水要放热,故其ΔH=ΔH3-ΔH1=c-a<0,cΔH1(CaCO3)>0,A项正确;由于ΔH2只与CO相关,故ΔH2(MgCO3)=ΔH2(CaCO3)>0,B项正确;根据能量关系图可知ΔH=ΔH1+ΔH2-ΔH3,由于ΔH(MgCO3)≠ΔH(CaCO3),故ΔH1(MgCO3)+ΔH2(MgCO3)-ΔH3(MgO)≠ΔH1(CaCO3)+ΔH2(CaCO3)-ΔH3(CaO)而ΔH2(MgCO3)=ΔH2(CaCO3),故ΔH1(MgCO3)-ΔH3(MgO)≠ΔH1(CaCO3)-ΔH3(CaO),ΔH1(CaCO3)-ΔH1(MgCO3)≠ΔH3(CaO)-ΔH3(MgO),C项错误;由于ΔH+ΔH3=ΔH1+ΔH2,而ΔH>0,故ΔH1+ΔH2>ΔH3,D项正确,故选C。
答案:C
5.解析:(1)①利用盖斯定律,将已知两个热化学方程式相加即可得出答案;②由图像可知,温度升高,二氧化碳减少,一氧化碳增多,有利于二氧化碳转化为一氧化碳;又因为温度升高平衡向吸热反应方向移动,所以二氧化碳生成一氧化碳的反应为吸热反应,故ΔH>0;③HCl气体溶于水即得到盐酸,所以在通其他水溶液之前先用水吸收HCl;之后用FeCl2溶液与Cl2反应生成FeCl3溶液;最后用NaOH溶液吸收尾气,防止污染空气;④由资料可知,冷却到室温时,滤渣中含有难溶于TiCl4的MgCl2,以及微溶于TiCl4的AlCl3和FeCl3。
(2)粗TiCl4中存在的杂质是SiCl4和微溶于TiCl4的AlCl3和FeCl3;先通过蒸馏的方式除去沸点较低的SiCl4,再控制温度在136 ℃~181 ℃,蒸馏得到纯净TiCl4。
答案:(1)①TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH=-45.5 kJ/mol
②> 温度升高,CO含量升高,CO2含量减少,反应向生成CO的方向进行
③水、FeCl2溶液、NaOH溶液
④AlCl3、FeCl3、MgCl2
(2)SiCl4 136 ℃~181 ℃
6.解析:燃烧热是指25 ℃和1 atm下1 mol可燃物完全燃烧生成稳定氧化物时所放出的热量,则1 mol油酸甘油酯的燃烧热为:=3.4×104 kJ·mol-1。
答案:C
22
相关文档
- 高中化学方程式总结2021-07-0816页
- 高中化学 盐类水解竞赛课2021-07-0814页
- 2020_2021学年高中化学专题十六化2021-07-087页
- 高中化学选修四 阶段性测试题含答2021-07-086页
- 2020_2021学年新教材高中化学第3章2021-07-088页
- 2021年1月广东省普通高中学业水平2021-07-0823页
- 【化学】安徽省示范高中培优联盟202021-07-0812页
- 2020_2021学年高中化学第二章化学2021-07-088页
- 2020_2021学年新教材高中化学第3章2021-07-0868页
- 高中化学人教必修2课件-第三节 生2021-07-0837页