- 1.05 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点 45 溶液的酸碱性及 pH
一、溶液的酸碱性与 pH
1.溶液的酸碱性(25 ℃时)
溶液的酸碱性 c(H+)与 c(OH-) 比较 c(H+)大小 pH
酸性溶液 c(H+)>c(OH-) c(H+)>1×10-7mol·L-1 <7
中性溶液 c(H+)=c(OH-) c(H+)=1×10-7mol·L-1 =7
碱性溶液 c(H+)7
提醒:pH=7 或 c(H+)=10-7 mol·L-1 的溶液不一定呈中性,因水的电离与温度有关,常温时,pH=7
或 c(H+)=10-7 mol·L-1 溶液呈中性,100 ℃时 pH=6 或 c(H+)=1×10-6 mol·L-1 呈中性。
2.溶液的 pH
(1)定义:pH=−lg c(H+)。
(2)pH 与溶液的酸碱性的关系
①25 ℃,纯水的 pH=7,溶液呈中性;pH<7 的溶液呈酸性;pH>7 的溶液呈碱性。
②pH 表示溶液的酸碱性及其强弱:25 ℃时,pH(<7)越小,溶液的酸性越强; pH(>7)越大,溶液的碱
性越强。
(3)pH 的适用范围
常温下,当溶液的酸碱性用 pH 表示时,一般情况下,1×10−14 mol·L−1pH>0。
pH=0 的溶液中并非无 H+,而是 c(H+)=1 mol·L−1;pH=14 的溶液中并非无 OH−,而是 c(OH−)=1 mol·L−1。
当 c(H+)>1 mol·L−1 时,一般不用 pH 表示溶液的酸碱性,用 c(H+)或 c(OH−)直接表示溶液的酸碱性更方
便。
注意:(1)未指明温度时,pH=7 不代表溶液呈中性,如 100 ℃时,pH=6 为中性溶液。
(2)溶液的酸碱性也可以用 pOH 表示:pOH=−lgc(OH−)。因为常温下,c(OH−)·c(H+)=10−14,若两边均
取负对数得:pH+pOH=14。
3.pH 的测定方法
(1)pH 试纸法
pH 试纸的使用方法:取一片 pH 试纸,放在洁净的表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测
液点于试纸中央,然后与标准比色卡对照读出数值。
pH 试纸的种类:常用的 pH 试纸有广泛 pH 试纸(pH 范围为 1~14 或 0~10,可识别的 pH 差值约为 1)和
精密 pH 试纸(pH 范围较窄,可识别的 pH 差值为 0.2 或 0.3)。
(2)pH 计法
常用 pH 计来精确测量溶液的 pH,读数时应保留两位小数。
(3)常用酸碱指示剂及其变色范围
指示剂 pH 及变色范围
甲基橙
石蕊
酚酞
注意:
(1)pH 试纸不能伸入待测液中。
(2)pH 试纸不能事先润湿(润湿相当于将溶液稀释)。用 pH 试纸测定的是一个粗略结果。
(3)用广泛 pH 试纸测出溶液的 pH 是整数,而不会是 3.1、5.2 等小数。
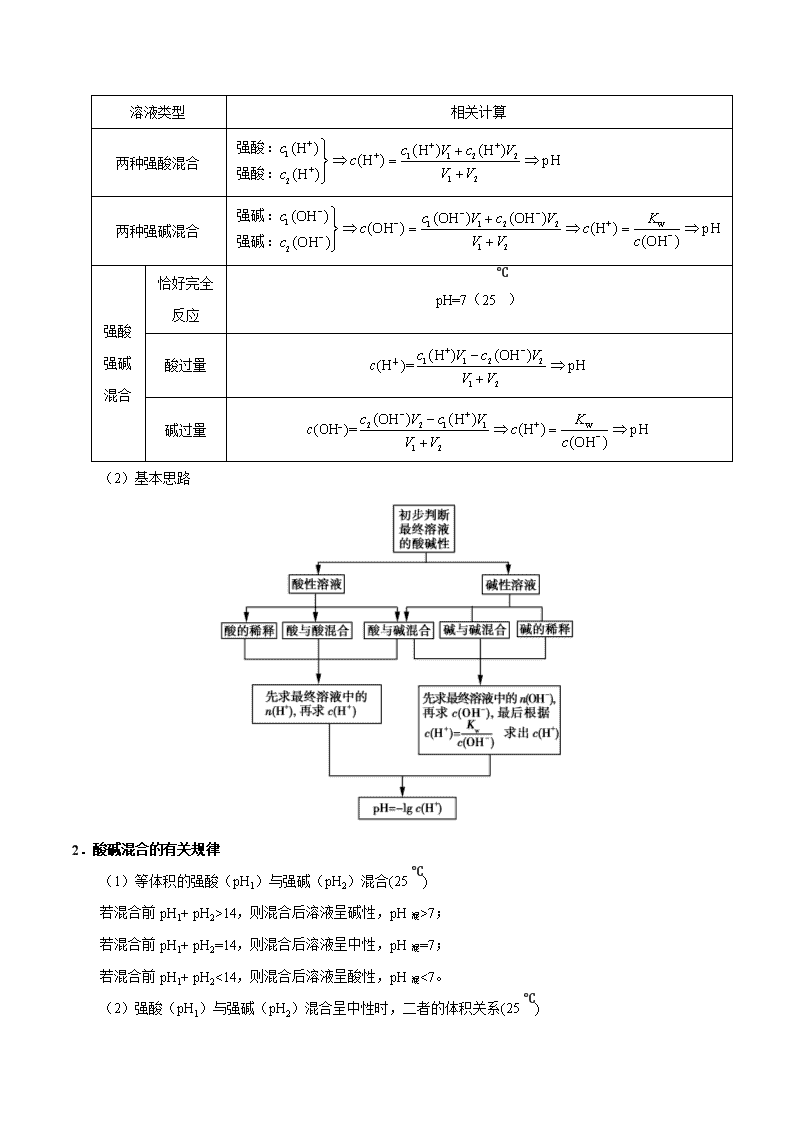
二、溶液的酸碱性及 pH 的计算
1.溶液 pH 的计算
(1)类型方法
①单一溶液
溶液类型 相关计算
强酸(HnA) 设 HnA 的浓度为 c mol/L,则 c(H+)=nc mol/L,pH=−lgc(H+)=−lgnc
强碱[B(OH)n]
溶液
设B(OH)n的浓度为c mol/L,则c(OH−)=nc mol/L,c(H+)=
14
W 1.0 10
(OH )
K
c nc
mol/L,
pH=−lgc(H+)=14+lgnc
②混合溶液
溶液类型 相关计算
两种强酸混合 1 1 1 2 2
1 22
( ) ( ) ( )( ) pH
(
H H H
H )
H
c c V c Vc
V Vc
强酸:
强酸:
两种强碱混合 1 1 1 2 2
1 22
wOH OH( ) ( ) ( )( ) ( )
( )( )
OHOH H pH
OHOH
c Kc V c Vc c
V V cc
强碱:
强碱:
强酸
强碱
混合
恰好完全
反应
pH=7(25℃)
酸过量 c(H+)= 1 1 2 2
1 2
H OH( ) ( ) pHc V c V
V V
碱过量 c(OH−)= 2 2 1 1
1 2
wOH H H p( ) H
OH
( ) ( )
( )
Kc V c V c
V V c
(2)基本思路
2.酸碱混合的有关规律
(1)等体积的强酸(pH1)与强碱(pH2)混合(25 ℃)
若混合前 pH1+ pH2>14,则混合后溶液呈碱性,pH 混>7;
若混合前 pH1+ pH2=14,则混合后溶液呈中性,pH 混=7;
若混合前 pH1+ pH2<14,则混合后溶液呈酸性,pH 混<7。
(2)强酸(pH1)与强碱(pH2)混合呈中性时,二者的体积关系(25 ℃)
若 pH1+ pH2=14,则 V 酸=V 碱;
若 pH1+ pH2≠14,则
2
1
pH 14
pH
OH 10
H 10= c
c
V
V
酸
碱
碱
酸
( )
( )
1 2pH +pH 1410 。
(3)等体积的强酸(pH1)与弱碱(pH2)混合(25 ℃),若 pH1+ pH2=14,由于弱碱过量,pH 混>7。
(4)等体积的弱酸(pH1)与强碱(pH2)混合(25 ℃),若 pH1+ pH2=14,由于弱酸过量,pH 混<7。
注意事项注意事项
(1)一般情况下,若ΔpH(pH 的差值)≥2 的两种强酸溶液等体积混合,pH=pH 小+0.3;若ΔpH≥2 的两
种强碱溶液等体积混合,pH=pH 大−0.3(相当于把 pH 小的酸溶液或 pH 大的碱溶液稀释到了原来的 2 倍)。
(2)酸按酸,碱按碱,同强混合在之间;异强混合看过量。若是碱碱混合或者酸碱混合且碱过量,一
定要先算 c(OH−),再算 c(H+)及 pH,或先算 c(OH−),再算 pOH、pH。
三、溶液稀释时 pH 的变化规律
1.常温下酸、碱的稀释规律
溶液 稀释前溶液 pH
加水稀释到体积为
原来的 10n 倍
稀释后溶液 pH
酸
强酸
pH=a
pH=a+n
弱酸 a7。
2.酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的 pH 都不可能大于 7 或小于 7,只能接近 7。
注意:
(1)对于 pH 相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的 pH
变化幅度大。这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中的 H+(或 OH‒)的数目(水电离
出的除外)不会增多,而弱酸(或弱碱)随着加水稀释,电离平衡向右移动,溶液中 H+(或 OH‒)的数目还
会增多。将 pH 相同的强酸和弱酸稀释后 pH 仍相同,则弱酸中所加的水比强酸中的多
(2)对于物质的量浓度相同的强酸和弱酸(或强碱和弱碱),稀释相同的倍数,pH 的变化幅度不同,
强酸(或强碱)稀释后 pH 的变化幅度大。
考向一 溶液酸碱性的判断
典例 1 下列水溶液一定呈中性的是( )
A.pH=7 的溶液 B.c(H+)=1.0×10-7mol·L-1 的溶液
C.c(H+)=c(OH-)的溶液 D.pH=3 的酸与 pH=11 的碱等体积混合后的溶液
1.T℃时,NaCl 溶液中 c(H+)=1×10-6mol/L 。下列说法正确的是
A.该 NaCl 溶液显酸性 B.该 NaCl 溶液中 KW=1×10-12
C.该 NaCl 溶液中 c(OH-)> c(H+) D.该 NaCl 溶液 pH=7
溶液酸碱性判断时的易错提醒
(1)判断溶液酸碱性的依据是 c(H+)与 c(OH−)的相对大小,若 c(H+)=c(OH−),则溶液呈中性。
(2)pH=7 或 c(H+)=10−7mol·L−1 的溶液不一定呈中性,因水的电离平衡与温度有关。常温时,pH=7 呈
中性;100 ℃时,pH=6 呈中性。
(3)溶液中 c(H+)越小,c(OH−)越大,溶液的酸性越弱,碱性越强;溶液中 c(H+)越大,c(OH−)越小,
溶液的酸性越强,碱性越弱。
(4)室温下,已知酸和碱 pH 之和的溶液等体积混合
①两强混合
a.若 pH 之和等于 14,则混合后溶液显中性,pH=7。
b.若 pH 之和大于 14,则混合后溶液显碱性,pH>7。
c.若 pH 之和小于 14,则混合后溶液显酸性,pH<7。
②一强一弱混合——“谁弱显谁性”
pH 之和等于 14 时,一元强酸和一元弱碱等体积混合呈碱性;一元弱酸和一元强碱等体积混合呈酸性。
考向二 溶液 pH 的计算
典例 2 (1)已知 T ℃,Kw=1×10-13,则 T ℃________25 ℃(填“>”“<”或“=”)。在 T ℃时将 pH=11 的
NaOH 溶液 a L 与 pH=1 的硫酸 b L 混合(忽略混合后溶液体积的变化),若所得混合溶液的 pH=10,
则 a∶b=________。
(2)25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6,y≥8),取 a L 该盐酸与 b L 该氢氧化钠
溶液反应,恰好完全中和,求:
①若 x+y=14,则 a/b =________(填数据);
②若 x+y=13,则 a/b=________(填数据);
③若 x+y>14,则 a/b=________________(填表达式)。
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH(x、y)的关系式为________________(填表达式)。
2.关于下列溶液混合后的 pH(忽略体积变化)说法不正确的是
A.25℃时,pH=2 的盐酸 pH=11 的烧碱溶液按体积比 1:9 充分反应后,溶液的 pH=4
B.25℃时,pH=2 和 pH=4 的盐酸溶液按体积比 1:10 充分混合后,溶液的 pH=3
C.25℃时,pH=3 的盐酸和 pH=3 醋酸溶液任意比例混合后,溶液的 pH=3
D.25℃时,pH=9 和 pH=11 的烧碱溶液等体积混合,pH=10
1.将 pH=1 的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量 NaOH
溶液,pH 都升高了 1,则加入的水与 NaOH 溶液的体积比为
A.9 B.10
C.11 D.12
2.常温下,pH=a 和 pH=b 的两种 NaOH 溶液,已知 b=a+2,则将两种溶液等体积混合后,所得溶液的
pH 接近于
A.a-lg 2 B.b-lg 2
C.a+lg 2 D.b+lg 2
3.下图是对 10mL 一定物质的量浓度的盐酸用一定物质的量浓度的 NaOH 溶液滴定的图像,依据图像推出
盐酸和 NaOH 溶液的物质的量浓度是下表内各组中的
选项
溶液
A B C D
c(HCl)/mol·L-1 0.12 0.04 0.03 0.09
c(NaOH)/mol·L- 0.04 0.12 0.09 0.03
4.室温下,有关 pH 计算结果一定正确的是
①强酸 pH=a,加水稀释到 10n 倍,则 pH=a+n
②弱酸 pH=a,加水稀释到 10n 倍,则 pHb−n(b−n>7)
A.①② B.②③ C.③④ D.②④
5.常温下,关于溶液稀释的说法正确的是
A.将 1 L 0.1 mol·L-1 的 Ba(OH)2 溶液加水稀释为 2 L,pH=13
B.pH=3 的醋酸溶液加水稀释 100 倍,pH=5
C.pH=4 的 H2SO4 溶液加水稀释 100 倍,溶液中由水电离产生的 c(H+)=1×10-6 mol·L-1
D.pH=8 的 NaOH 溶液加水稀释 100 倍,其 pH=6
6.在 T ℃时,某 NaOH 稀溶液中 c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知 a+b=12。向该溶液
中逐滴加入 pH=c 的盐酸(T ℃),测得混合溶液的部分 pH 如下表所示:
序号 NaOH 溶液体积 盐酸体积 溶液 pH
① 20.00 0.00 8
② 20.00 20.00 6
假设溶液混合前后的体积变化忽略不计,则 c 为
A.1 B.4
C.5 D.6
7.已知在 100 ℃时水的离子积 Kw=1×10-12(本题涉及溶液的温度均为 100 ℃)。下列说法中正确的是
A.0.005 mol·L-1 的 H2SO4 溶液,pH=2
B.0.001 mol·L-1 的 NaOH 溶液,pH=11
C.0.005 mol·L-1 的 H2SO4 溶液与 0.01 mol·L-1 的 NaOH 溶液等体积混合,混合溶液的 pH 为 6,溶液
显酸性
D.完全中和 pH=3 的 H2SO4 溶液 50 mL,需要 pH=9 的 NaOH 溶液 100 mL
8.某温度下,水的离子积约为 1×10-12,将 Va L pH=2 的硫酸溶液与 Vb L pH=11 的 NaOH 溶液混合,若
混合溶液的 pH=10,体积是(Va+Vb) L,则 Va∶Vb 为 ( )
A.2∶11 B.2∶9 C.11∶2 D.9∶2
9.现有室温下四种溶液,有关叙述不正确的是
序号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
A.③④中分别加入适量的醋酸钠晶体后,两溶液的 pH 均增大
B.②③两溶液等体积混合,所得溶液中 c(H+)>c(OH-)
C.V1 L④和 V2 L②混合,若混合后溶液 pH=7,则 V1=V2
D.分别加水稀释 10 倍,四种溶液的 pH:①>②>③>④
10.已知 H2A 为二元弱酸,室温下向 100.0 mL 0.1 mol·L-1H2A 溶液中加入不同质量的 NaOH 固体,pH 变
化如下表(不考虑溶液体积变化)。下列分析正确的是
m(NaOH)/g 0 0.4 0.8 1.2
pH 3.8 8.3 12.0 13.2
A.H2A 第一步电离 K1 的数量级为 10-8
B.上述过程中水的电离程度一直增大
C.m(NaOH)=0.6 g 时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.若溶液中加 NaOH 至c(HA-)
c(A2-)
=100 时,c(OH-)>100 c(H+)
11.(1)体积相同,浓度均为 0.2 mol·L-1 的盐酸和 CH3COOH 溶液,分别加水稀释 10 倍,溶液的 pH 分
别变成 m 和 n,则 m 与 n 的关系为________。
(2)体积相同,浓度均为 0.2 mol·L-1 的盐酸和 CH3COOH 溶液,分别加水稀释 m 倍、n 倍,溶液的 pH
都变成 3,则 m 与 n 的关系为________。
(3)体积相同,pH 均等于 1 的盐酸和 CH3COOH 溶液,分别加水稀释 m 倍、n 倍,溶液的 pH 都变成 3,
则 m 与 n 的关系为________。
(4)体积相同,pH 均等于 13 的氨水和 NaOH 溶液,分别加水稀释 100 倍,溶液的 pH 分别为 m 和 n,
则 m 和 n 的关系为________。
12.已知水在 25℃和 95℃时,其电离平衡曲线如图所示:
(1)95℃时,水的电离平衡曲线应为 B,请说明理由______。
25℃时,将 pH=9 的 NaOH 溶液与 pH=4 的硫酸溶液混合,所得混合溶液的 pH=7,则 NaOH 溶液与硫酸
溶液的体积比为______。
(2)95℃时,若 100 体积 pH=a 的某强酸溶液与 1 体积 pH=b 的某强碱溶液混合后溶液呈中性,则 a 与
b 之间应满足的关系是______。
(3)曲线 A 所对应的温度下,pH=2 的 HCl 溶液和 pH=11 的某 BOH 溶液中,若水的电离程度分别用α1、
α2 表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”)。
(4)曲线 B 对应温度下,将 0.02mol/LBa(OH)2 溶液与等物质的量浓度的 NaHSO4 溶液等体积混合后,
混合溶液的 pH=________。
1.[2015 海南]0.1 mol 下列气体分别与 1 L 0.l mol·L−1 的 NaOH 溶液反应,形成的溶液 pH 最小的是
A.NO2 B.SO2 C.SO3 D.CO2
2.[2015 新课标Ⅰ]浓度均为 0.10 mol/L、体积均为 V0 的 MOH 和 ROH 溶液,分别加水稀释至体积 V,pH
随
0
lgV
V 的变化如图所示,下列叙述错误..的是
A.MOH 的碱性强于 ROH 的碱性
B.ROH 的电离程度:b 点大于 a 点
C.若两溶液无限稀释,则它们的 c(OH-)相等
D.当
0
lgV
V =2 时,若两溶液同时升高温度,则 (M )
(R )
c
c
增大
3.(2008·全国高考真题)常温下,取浓度相同的 NaOH 和 HCl 溶液,以 3∶2 体积比相混合,所得溶液的
pH 等于 12,则原溶液的浓度为
A.0.01mol·L-1 B.0.017mol·L-1
C.0.05mol·L-1 D.0.50mol·L-1
4.(2007·全国高考真题)室温时,下列混合溶液的 pH 一定小于 7 的是
A.pH=3 的盐酸和 pH=11 的氨水等体积混合
B.pH=3 的盐酸和 pH=11 的氢氧化钡溶液等体积混合
C.pH=3 的醋酸和 pH=11 的的氢氧化钡溶液等体积混合
D.pH=3 的硫酸和 pH=11 的氨水等体积混合
相关文档
- 2020届高考化学一轮复习无机化工流2021-07-099页
- 全国通用2021高考化学一轮复习第十2021-07-097页
- 2020届高考化学一轮复习化学反应与2021-07-0929页
- 2019届高考化学人教版一轮复习乙醇2021-07-0912页
- 高考化学第一轮复习课件第1讲 化2021-07-095页
- 2020届高考化学一轮复习晶体结构与2021-07-0927页
- 2020届高考化学一轮复习(苏教版)水的2021-07-097页
- 全国通用2021高考化学一轮复习第十2021-07-095页
- 2020届高考化学一轮复习烃的含氧衍2021-07-0924页
- 2021届(鲁科版)高考化学一轮复习实验2021-07-098页