- 1.82 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
课时 盐类的水解
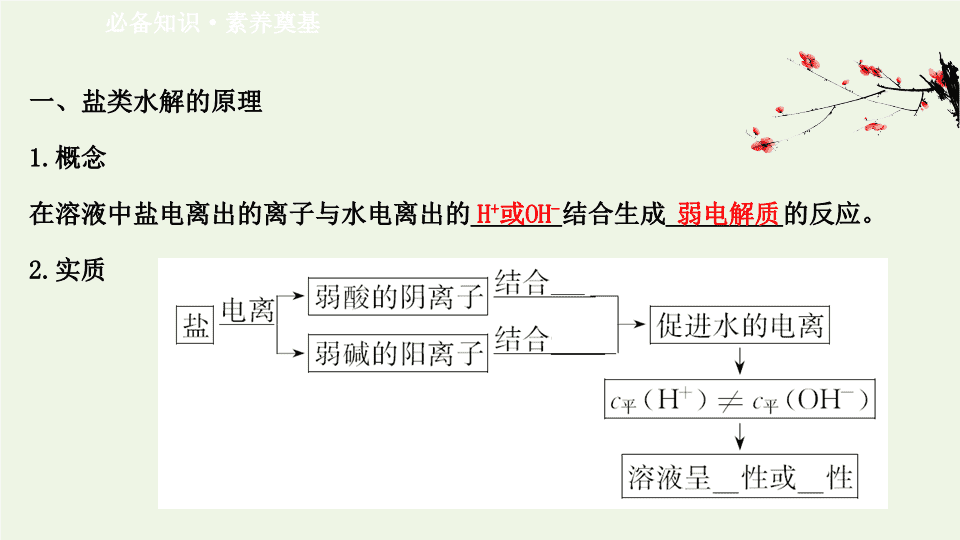
一、盐类水解的原理
1.
概念
在溶液中盐电离出的离子与水电离出的
_______
结合生成
_________
的反应。
2.
实质
必备知识
·
素养奠基
H
+
或
OH
-
弱电解质
3.
特点
4.
盐类的水解规律及溶液酸碱性
(1)
在可溶性盐溶液中
:
有弱才水解
,
无弱不水解
,
越弱越水解
,
都弱都水解
,
谁强显谁性。
(2)
盐类水解的类型
盐的类型
实例
是否水解
水解的离子
溶液的
酸碱性
强酸强碱盐
NaCl
、
KNO
3
否
无
_____
强酸弱碱盐
NH
4
Cl
、
Cu(NO
3
)
2
是
、
Cu
2+
_____
弱酸强碱盐
CH
3
COONa
、
Na
2
CO
3
是
CH
3
COO
-
、
_____
弱酸弱碱盐
CH
3
COONH
4
、
NH
4
HCO
3
是
CH
3
COO
-
、
、
谁强显
谁性
中性
酸性
碱性
【
情境
·
思考
】
判断盐类是否发生水解以及水解后溶液的酸碱性
,
要看盐的离子所对应的酸和碱的相对强弱。已知常温下有下列溶液
:①Na
2
S
溶液 ②
AlCl
3
溶液 ③
Na
2
CO
3
溶液 ④
NaNO
3
溶液。据此思考
:
(1)
溶液①中哪种离子发生了水解反应
,
水溶液呈什么性
?
溶液④能否发生水解反应
?
提示
:
溶液①中
S
2-
发生了水解反应
,Na
2
S
溶液呈碱性
;
溶液④不能发生水解反应。
(2)
溶液③和
NaOH
溶液都呈碱性
,
它们对水的电离影响是否相同
?
提示
:
Na
2
CO
3
溶液由于 的水解呈碱性
,
促进了水的电离
;NaOH
电离出的
OH
-
抑
制了水的电离。
(3)
已知相同温度下
,CH
3
COOH
的电离常数与
NH
3
·H
2
O
的电离常数相等
,
请判断
CH
3
COONH
4
溶液的酸碱性。
提示
:
CH
3
COONH
4
溶液呈中性。
5.
表示方法
(1)
用化学方程式表示
:
盐
+
水 酸
+
碱。
如
NH
4
Cl
的水解
:__________________________
。
(2)
用离子方程式表示
:
盐的离子
+
水 酸
(
或碱
)+OH
-
(
或
H
+
)
。
如
NH
4
Cl
的水解
:_________________________
。
NH
4
Cl+H
2
O NH
3
·H
2
O+HCl
+H
2
O NH
3
·H
2
O+H
+
(3)
多元弱酸酸根离子的水解应分步书写
:
如
Na
2
CO
3
的水解
:________________________,_______________________,
多元
弱碱阳离子的水解实际是分步进行的
,
习惯只写一步
,
如
Fe
3+
的水解
:
_________________________
。
+H
2
O +OH
-
+H
2
O H
2
CO
3
+OH
-
Fe
3+
+3H
2
O Fe(OH)
3
+3H
+
【
巧判断
】
判断下列盐类水解离子方程式的正误
,
正确的打“√”
,
错误的打“
×”
。
(1)FeCl
3
溶液
:Fe
3+
+3H
2
O Fe(OH)
3
↓+3H
+
(
)
提示
:
×
。水解反应不加↓或↑。
(2)NaHS
溶液
:HS
-
+H
2
O H
2
S+OH
-
(
)
提示
:
√
。
NaHS
溶液中
HS
-
发生水解反应
,
水解反应离子方程式正确。
(3)K
2
CO
3
溶液
:
+2H
2
O
H
2
CO
3
+2OH
-
(
)
提示
:
×
。水解反应是分步进行的
,
正确的水解反应离子方程式为
+H
2
O
+OH
-
。
(4)NH
4
NO
3
溶液
: +H
2
O NH
3
·H
2
O+H
+
(
)
提示
:
√
。
NH
4
NO
3
是强酸弱碱盐
,
发生水解。
(5)NaHCO
3
溶液
: +H
2
O CO
2
↑+H
2
O (
)
提示
:
×
。
HCO
3
的水解离子方程式为
+H
2
O H
2
CO
3
+OH
-
。
二、影响盐类水解平衡的因素
1.
盐类水解的特征
(1)
盐类的水解是
_____
反应。
(2)
加水稀释能
_____
盐类的水解。
吸热
促进
2.
影响因素
因素
对盐类水解程度的影响
内因
组成盐的弱酸根离子或弱碱阳离子越弱
,
水解程度越
___
外因
温度
升高温度能够
_____
水解
浓度
盐溶液的浓度越小
,
水解程度越
___
外加
酸碱
水解显酸性的盐溶液
,
加碱会
_____
水解
,
加酸会
_____
水解
,
反之亦然
外加
盐
加入与盐的水解性质相反的盐会
_____
盐的水解
大
促进
大
促进
抑制
促进
3.
相互促进的水解反应
(1)
相互促进能进行彻底的水解反应
①如 与
Al
3+
水解反应的离子方程式
:
______________________________
。
②如
S
2-
与
Al
3+
水解反应的离子方程式
:
__________________________________
。
3 +Al
3+
====3CO
2
↑+Al(OH)
3
↓
3S
2-
+2Al
3+
+6H
2
O====3H
2
S↑+2Al(OH)
3
↓
(2)
相互促进不能进行彻底的水解反应
如铵盐与醋酸盐水解反应的离子方程式
:
_______________________________________
。
CH
3
COO
-
+ +H
2
O CH
3
COOH+NH
3
·H
2
O
【
做一做
】
有下列盐溶液
:①KNO
3
②
AgNO
3
③
K
2
CO
3
④
FeCl
3
⑤
K
2
SO
4
⑥
NaClO
⑦
NH
4
Cl
提示
:
AgNO
3
、
FeCl
3
、
NH
4
Cl
属于强酸弱碱盐
,
溶液呈酸性
;K
2
CO
3
、
NaClO
属于强碱弱酸盐
,
溶液呈碱性
;KNO
3
、
K
2
SO
4
属于强酸强碱盐
,
溶液呈中性。
答案
:
②④⑦
③⑥ ①⑤
类型
呈酸性
呈碱性
呈中性
序号
关键能力
·
素养形成
知识点一 外界条件对盐类水解平衡的影响
【
重点释疑
】
1.
外界条件对盐类水解平衡的影响
以
Fe
3+
+3H
2
O Fe(OH)
3
+3H
+
ΔH>0
为例
体系
变化
条件
平衡
移动
方向
n(H
+
)
pH
水解
程度
现象
升温
向右
增多
减小
增大
颜色变深
通
HCl
向左
增多
减小
减小
颜色变浅
加
H
2
O
向右
增多
增大
增大
颜色变浅
加
FeCl
3
固体
向右
增多
减小
减小
颜色变深
加
NaHCO
3
向右
减小
增大
增大
生成红褐色
沉淀
,
放出
气体
2.
溶液中其他离子对盐类水解的影响
(1)
水解相互抑制。
如溶液
(NH
4
)
2
Fe(SO
4
)
2
中的
Fe
2+
与 水解时都显酸性
,
所以两者的水解相互抑
制。同浓度的
(NH
4
)
2
Fe(SO
4
)
2
溶液与
FeSO
4
溶液相比
,FeSO
4
溶液中的
Fe
2+
的水解
程度更大。
(2)
水解相互促进。
① 与
S
2-
、 、 、
CH
3
COO
-
等组成的盐虽然水解相互促进
,
但水解程
度较小
,
仍是部分水解
,
书写时仍用“ ”表示。如
+CH
3
COO
-
+H
2
O
CH
3
COOH+NH
3
·H
2
O
。
②
Al
3+
和 、 、
S
2-
、
HS
-
、
[Al(OH)
4
]
-
等组成的盐水解相互促进非常彻
底
,
生成气体和沉淀
,
书写时用“
====”
表示。如
Al
3+
+3 ====Al(OH)
3
↓
+3CO
2
↑
。
【
思考
·
讨论
】
(1)pH=4
的醋酸和氯化铵溶液中
,
水的电离程度前者与后者比较是什么关系
?
提示
:
小于。醋酸电离出的
H
+
抑制水的电离
,
使水的电离程度减小
;NH
4
Cl
电离出
的 结合水电离出的
OH
-
,
生成弱电解质
NH
3
·H
2
O,
促进水的电离
,
使水的电
离程度增大。
(2)
室温下
,
将碳酸钠溶液加热至
70 ℃,
溶液中
c
平
( )
、水的电离程度、
K
w
以及溶液的碱性将如何变化
?
提示
:
对于水解平衡
+H
2
O +OH
-
,
升温
,
平衡右移
,c
平
( )
减小
,
水的电离程度增大
,K
w
变大
,
溶液的碱性增强。
【
拓展深化
】
(1)
盐类水解易受温度、浓度、溶液的酸碱性等因素的影响
,
以氯化铁水解为例
,
当改变条件如升温、通入
HCl
气体、加水、加铁粉、加碳酸氢钠等时
,
应从平衡移动方向、
pH
的变化、水解程度、现象等方面归纳总结
,
分析掌握。
(2)
多元弱酸的酸式盐问题。酸式盐一般既存在水解
,
又存在电离。如果酸式盐的电离程度大于其水解程度
,
溶液显酸性
,
如
NaHSO
3
溶液
;
如果酸式盐的水解程度大于其电离程度
,
则溶液显碱性
,
如
NaHCO
3
溶液。
【
案例示范
】
【
典例
】
(2018·
北京高考
)
测定
0.1 mol·L
-1
Na
2
SO
3
溶液先升温再降温过程中的
pH ,
数据如下
:
时刻
①
②
③
④
温度
/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中
,
取①④时刻的溶液
,
加入盐酸酸化的
BaCl
2
溶液做对比实验
,④
产生
白色沉淀多。下列说法不正确的是
(
)
A.Na
2
SO
3
溶液中存在水解平衡
:
+ H
2
O + OH
-
B.④
的
pH
与①不同
,
是由于 浓度减小造成的
C.①→③
的过程中
,
温度和浓度对水解平衡移动方向的影响一致
D.①
与④的
K
w
相等
【
解题指南
】
解答本题时要注意以下两点
:
(1)
注意亚硫酸钠这种盐的类型。
(2)
注意外界条件对盐类水解平衡的影响。
【
解析
】
选
C
。
Na
2
SO
3
属于弱酸强碱盐
,
溶液中存在水解平衡
+ H
2
O
+ OH
-
,A
正确
;④
的
pH
与①不同
,
是由于 被
O
2
氧化生成
,
浓度减
小
,
水解平衡左移
,OH
-
浓度减小
,B
正确
;
水解反应为吸热反应
,
升高温度
,
水解平
衡右移
,pH
应当升高
,
而①→③的过程中
pH
下降
,
说明温度和浓度对水解平衡移
动方向的影响不一致
,C
错误
;
离子积常数
K
w
只受温度影响
,①
与④的温度相同
,
故
K
w
相等
,D
正确。
【
母题追问
】
(1)
上题将
0.1 mol·L
-1
Na
2
SO
3
溶液改为同浓度
Na
2
CO
3
溶液先升温再降温过程中的
pH
如何变化
?
提示
:
水解反应为吸热反应
,
升高温度
,
水解平衡右移
,pH
升高
;
降低温度
,
水解平衡左移
,pH
降低。
(2)D
项①与④的水解平衡常数相等吗
?
提示
:
水解平衡常数只受温度影响
,①
与④的温度相同
,
水解平衡常数相等。
【
迁移
·
应用
】
1.(2020·
杭州高二检测
)
向三份
0.1 mol·L
-1
CH
3
COONa
溶液中分别加入少量
NH
4
NO
3
、
Na
2
SO
3
、
FeCl
3
固体
(
忽略溶液体积变化
),
则
CH
3
COO
-
浓度的变化依次为
(
)
A.
减小、增大、减小
B.
增大、减小、减小
C.
减小、增大、增大
D.
增大、减小、增大
【
解析
】
选
A
。
CH
3
COO
-
水解显碱性
,
水解也呈碱性
,
会抑制
CH
3
COO
-
的水解
,
CH
3
COO
-
浓度增大。 和
Fe
3+
水解呈酸性
,
会促进
CH
3
COO
-
水解
,CH
3
COO
-
浓度会
减小。
2.0.1 mol·L
-1
K
2
CO
3
溶液中
,
由于 的水解
,
使得
c
平
( )<0.1 mol·L
-1
。
如果要使
c
平
( )
更接近
0.1 mol·L
-1
,
可以采取的措施是
(
)
A.
加入适量水
B.
加入少量盐酸
C.
加入适量
KOH
固体
D.
加热
【
解析
】
选
C
。要使
c
平
( )
更接近于
0.1 mol·L
-1
,
需要抑制碳酸根离子的水
解。
A
项
,
加入水稀释会导致溶液中离子浓度减小
,
错误
;B
项
,
加入盐酸会和碳酸
根反应生成水和二氧化碳
,
碳酸根离子浓度减小
,
错误
;C
项
,
加入氢氧化钾固体
,
会抑制碳酸根水解
,
使得碳酸根浓度接近
0.1 mol·L
-1
,
正确
;D
项
,
加热会促进碳
酸根离子水解
,
导致离子浓度减小
,
错误。
知识点二 溶液中离子浓度大小的比较
【
重点释疑
】
1.
理解两大平衡
,
树立“微弱”意识
(1)
电离平衡→建立电离过程是“微弱”的意识。
弱电解质
(
弱酸、弱碱、水
)
的电离是微弱的
,
且水的电离能力远远小于弱酸和
弱碱的电离能力。如在稀醋酸溶液中
:CH
3
COOH CH
3
COO
-
+H
+
,H
2
O OH
-
+H
+
,
在溶液中微粒浓度由大到小的顺序
:c
平
(CH
3
COOH)>c
平
(H
+
)>c
平
(CH
3
COO
-
) >
c
平
(OH
-
)
。
(2)
水解平衡→建立水解过程是“微弱”的意识。
弱酸阴离子或弱碱阳离子的水解是微弱的
,
但水的电离程度远远小于盐的水解
程度。如稀的
CH
3
COONa
溶液中
,
CH
3
COONa====CH
3
COO
-
+Na
+
,CH
3
COO
-
+H
2
O CH
3
COOH+OH
-
,H
2
O H
+
+OH
-
,
所以
CH
3
COONa
溶液中
,c
平
(Na
+
)>c
平
(CH
3
COO
-
)>c
平
(OH
-
)>c
平
(CH
3
COOH)>c
平
(H
+
)
。
2.
明确“三个”守恒原理
(1)
电荷守恒
:
即电解质溶液中阴离子所带电荷总数等于阳离子所带电荷总
数。如
Na
2
CO
3
溶液中的电荷守恒为
c
平
(Na
+
)+c
平
(H
+
)=c
平
(OH
-
)+2c
平
( )+
c
平
( )
。
(2)
物料守恒
:
是指物质发生变化前后
,
有关元素的存在形式不同
,
但元素的种
类和原子数目在变化前后保持不变。如
Na
2
CO
3
溶液中
n(Na)=2n(C):
故物料守恒
式为
c
平
(Na
+
)=2c
平
( )+2c
平
( )+2c
平
(H
2
CO
3
)
。
(3)
质子守恒
:
是指在电离或水解过程中
,
会发生质子
(H
+
)
转移
,
但在质子转移过程中其数量保持不变。
3.
正确理解质子守恒
以
Na
2
CO
3
和
NaHCO
3
溶液为例
,
可用下图所示帮助理解质子守恒
:
(1)Na
2
CO
3
溶液
所以
c
平
(OH
-
)=c
平
( )+2c
平
(H
2
CO
3
)+c
平
(H
3
O
+
),
即
c
平
(OH
-
)=c
平
( )+2c
平
(H
2
CO
3
)+c
平
(H
+
)
。
(2)NaHCO
3
溶液
所以
c
平
(OH
-
)+c
平
( )=c
平
(H
2
CO
3
)+c
平
(H
+
)
。
另外
,
将混合溶液中的电荷守恒式和物料守恒式相联立
,
通过代数运算消去其中某离子
(
如
Na
+
、
Cl
-
等
),
即可推出该溶液中的质子守恒。
【
思考
·
讨论
】
(1)
相同物质的量浓度的
a:NH
4
Cl
溶液、
b:CH
3
COONH
4
溶液、
c:NH
4
HSO
4
溶液
,
三
种溶液中
c
平
( )
由大到小的顺序是什么
?
提示
:
c
中
H
+
对 水解有抑制作用
,b
中
CH
3
COO
-
的水解对 水解有促进作用
,
所以三种溶液中
c
平
( )
由大到小的顺序是
c>a>b
。
(2)
已知
,
在
HClO
溶液中存在的平衡有
HClO H
+
+ClO
-
,H
2
O H
+
+OH
-
,
则溶
液中存在哪些微粒
?
各微粒之间的大小关系是什么
?
提示
:
溶液中微粒有
H
2
O
、
HClO
、
H
+
、
OH
-
、
ClO
-
,
由于
HClO
电离程度小
,
且
H
2
O
的
电离程度更小
,
所以溶液中微粒浓度由大到小的顺序
(H
2
O
除外
)
是
c
平
(HClO)>
c
平
(H
+
)>c
平
(ClO
-
)>c
平
(OH
-
)
。
【
案例示范
】
【
典例
】
(2020·
沈阳高二检测
)
常温时
,
体积均为
50 mL
物质的量浓度均为
0.10 mol·L
-1
的
HX
、
HY
、
HZ
三种弱酸
,
分别用
0.10 mol·L
-1
的
NaOH
溶液滴定
,
滴定曲线如图所示。下列有关说法错误的是
(
)
A.
浓度均为
0.10 mol·L
-1
时
,
酸的电离度
:HXHY>HZ
C.
图中当均滴入
50 mL NaOH
溶液时
,
所得溶液中水的电离程度
:HX>HY>HZ
D.
用
NaOH
溶液中和
pH
与体积均相等的三种酸时
,
消耗
n(NaOH):HXHY>HZ,
正确
;C.
当均滴入
50 mL NaOH
溶液时
,
恰好生成盐
NaX
、
NaY
、
NaZ,
对应的酸性越弱
,
酸根离子的水解程度越大
,
水的电离程度越大
,
正确
;D.
当
pH
相等时
,
酸性越弱
,
酸的浓度越大
,
用
NaOH
溶液中和
pH
与体积均相等的三种酸时
,
消耗
n(NaOH):HX>HY>HZ,
错误。
【
母题追问
】
(1)B
项改为
pH
均为
3.0
的三种酸加水稀释相同倍数
,pH
如何变化
?
提示
:
pH
均为
3.0
的三种弱酸
,
酸性越弱
,
浓度越大
,
加水稀释相同倍数
,pH
变化越小
,
故
pH:HXc(K
+
)>c(OH
-
)
【
解析
】
选
C
。邻苯二甲酸氢钾为二元弱酸酸式盐
,
溶液呈酸性
,
向邻苯二甲酸
氢钾溶液中加入氢氧化钠溶液
,
两者反应生成邻苯二甲酸钾和邻苯二甲酸钠
,
溶液中离子浓度增大
,
导电性增强
,
邻苯二甲酸钾和邻苯二甲酸钠为强碱弱酸
盐
,
邻苯二甲酸根在溶液中水解使溶液呈碱性。根据图示可知
,
混合溶液在不
同的反应阶段含有的离子的种类和浓度不同
,
故混合溶液的导电能力与离子浓
度和种类有关
,A
正确
;
根据图示可知
,
随着反应的进行
,
溶液的导电能力逐渐增
强
,
加入的碱的量越多
,
溶液中的
HA
-
的浓度越小
,Na
+
与
A
2-
的量越多
,
故
Na
+
与
A
2-
的导电能力之和大于
HA
-
的
,B
正确
;b
点滴定终点应该是二者恰好反应生成
Na
2
A
和
K
2
A,
根据邻苯二甲酸
H
2
A
的
K
a1
和
K
a2
值可知
,
邻苯二甲酸是弱酸
,
所以到达滴定终点时溶液应该呈碱性
,
故
b
点的
pH
应该大于
7,C
不正确
;b
点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成等物质的量的邻苯二甲酸钾和邻苯二甲酸钠
,
溶液中
c(Na
+
)
和
c(K
+
)
相等
,c
点是继续加入氢氧化钠溶液后
,
得到邻苯二甲酸钾、邻苯二甲酸钠、氢氧化钠的混合溶液
,
则溶液中
c(Na
+
)>c(K
+
),
由图可知
,a
点到
b
点加入氢氧化钠溶液的体积大于
b
点到
c
点加入氢氧化钠溶液的体积
,
则溶液中
c(K
+
)>c(OH
-
),
溶液中三者大小顺序为
c(Na
+
)>c(K
+
)>c(OH
-
),
故
D
正确。
【
补偿训练
】
1.
将等体积的
0.2 mol·L
-1
CH
3
COONa
溶液与
0.1 mol·L
-1
HNO
3
混合
,
混合
溶液中离子浓度由大到小顺序正确的是
(
)
A.c
平
(Na
+
)>c
平
(CH
3
COO
-
)>c
平
( )>c
平
(OH
-
)>c
平
(H
+
)
B.c
平
(Na
+
)>c
平
(CH
3
COO
-
)>c
平
( )>c
平
(H
+
)>c
平
(OH
-
)
C.c
平
(Na
+
)>c
平
(CH
3
COO
-
)>c
平
(OH
-
)>c
平
( )>c
平
(H
+
)
D.c
平
(CH
3
COO
-
)>c
平
(Na
+
)>c
平
(H
+
)>c
平
( )>c
平
(OH
-
)
【
解析
】
选
B
。反应后溶液中溶质是
CH
3
COONa
、
CH
3
COOH
和
NaNO
3
,
且浓度都是
0.05 mol·L
-1
,c
平
(Na
+
)=0.1 mol·L
-1
,c
平
( )=0.05 mol·L
-1
,
此时醋酸的
电离程度大于醋酸钠的水解程度
,
故溶液中
c
平
(CH
3
COO
-
)>0.05 mol·L
-1
,
c
平
(H
+
)>c
平
(OH
-
),
故选
B
。
2.(2020·
武汉高二检测
)
已知乙酸
(HA)
的酸性比甲酸
(HB)
弱
,
在物质的量浓度均为
0.1 mol·L
-1
的
NaA
和
NaB
的混合溶液中
,
下列排序正确的是
(
)
A.c
平
(OH
-
)>c
平
(HA)>c
平
(HB)>c
平
(H
+
)
B.c
平
(OH
-
)>c
平
(A
-
)>c
平
(B
-
)>c
平
(H
+
)
C.c
平
(OH
-
)>c
平
(B
-
)>c
平
(A
-
)>c
平
(H
+
)
D.c
平
(OH
-
)>c
平
(HB)>c
平
(HA)>c
平
(H
+
)
【
解析
】
选
A
。在
NaA
和
NaB
的混合液中存在
A
-
和
B
-
的水解平衡
:A
-
+H
2
O HA+
OH
-
、
B
-
+H
2
O HB+OH
-
,
由于
HA
比
HB
酸性弱
,
因此
A
-
的水解程度大于
B
-
的水解
程度
,
故
c
平
(HA)>c
平
(HB)
、
c
平
(B
-
)>c
平
(A
-
)>c
平
(OH
-
),
因此
A
项正确。
【
课堂回眸
】
课堂检测
·
素养达标
1.(2020·
济南高二检测
)
下列说法正确的是
(
)
A.
盐溶液都是中性的
B.
盐溶液的酸碱性与盐的类型无关
C.
碳酸钠溶液显碱性
,
是因为溶液中
c
平
(OH
-
)>c
平
( H
+
)
D.NaHCO
3
溶液显酸性
【
解析
】
选
C
。盐溶液有的显酸性
,
有的显碱性
,
并不是所有的盐溶液都是中性
,A
错误
;
盐溶液的酸碱性和盐的类型有密切关系
,B
错误
;
溶液的酸碱性取决于溶液中
c
平
(OH
-
)
和
c
平
( H
+
)
的相对大小
,
碳酸钠溶液显碱性
,
则说明溶液中
c
平
(OH
-
)> c
平
( H
+
),C
正确
;
虽然
NaHCO
3
是酸式盐
,
但其水溶液显碱性
,D
错误。
2.(2020·
德州高二检测
)
用物质的量都是
0.1 mol
的
HCN
和
NaCN
配成
1 L
混合溶液
,
已知其中
c
平
(CN
-
)
小于
c
平
(Na
+
),
则下列判断正确的是
(
)
A.c
平
(H
+
)>c
平
(OH
-
)
B.c
平
(HCN)>c
平
(CN
-
)=0.2 mol· L
-1
C.c
平
(HCN)>c
平
(CN
-
) D.c
平
(CN
-
)>c
平
(OH
-
)=0.1 mol· L
-1
【
解析
】
选
C
。由
c
平
(CN
-
)
小于
c
平
(Na
+
)
知
,CN
-
水解的程度大于
HCN
电离的程度
,C
正确。
3.
下图表示的是某离子
X
的水解过程示意图
,
则离子
X
可能是
(
)
【
解析
】
选
D
。离子
X
水解显酸性
,
所以只能是 。
4.(2020·
珠海高二检测
)
物质的量浓度相同的下列溶液中
,
按
pH
由小到大的顺序排列的是
(
)
A.Na
2
CO
3
、
NaHCO
3
、
NaCl
、
NH
4
Cl
B.Na
2
CO
3
、
NaHCO
3
、
NH
4
Cl
、
NaCl
C.(NH
4
)
2
SO
4
、
NH
4
Cl
、
NaNO
3
、
Na
2
S
D.NH
4
Cl
、
(NH
4
)
2
SO
4
、
Na
2
S
、
NaNO
3
【
解析
】
选
C
。 的水解程度大于 的
,
则
pH:Na
2
CO
3
>NaHCO
3
,
故选项
A
、
B
不符合要求
;
水解使
NH
4
Cl
溶液、
(NH
4
)
2
SO
4
溶液显酸性
,
物质的量浓度相同
时
,(NH
4
)
2
SO
4
溶液中 浓度大于
NH
4
Cl
溶液中 浓度
,
则
pH:(NH
4
)
2
SO
4
”“<”
或
“
=”)③
。
(3)
在溶液④中
,
________
(
填离子
)
的浓度为
0.1 mol·L
-1
。
NH
3
·H
2
O
和
________
(
填离子
)
的物质的量浓度之和为
0.2 mol·L
-1
。
(4)
室温下
,
测得溶液②的
pH=7,
则说明
CH
3
COO
-
的水解程度
________
(
填“
>”
“<”
或“
=”,
下同
)
的水解程度
,CH
3
COO
-
与 浓度的大小关系是
c
平
(CH
3
COO
-
)
__________
c
平
( )
。
【
解析
】
(1)NH
4
Cl
溶液中存在
的水解平衡
: +H
2
O NH
3
·H
2
O+H
+
,
所以溶液呈酸性。
(2)
溶液②、③中均存在
+H
2
O NH
3
·H
2
O+H
+
,
而溶液
②中阴离子也发生水解
:CH
3
COO
-
+H
2
O CH
3
COOH+OH
-
,
这样 与
CH
3
COO
-
相互
促进水解
,
而溶液③中
NH
4
HSO
4
电离出的
H
+
抑制了 的水解
,
所以
c
平
( )
大
小关系为②
<③
。
(3)
在溶液④中
,c
平
(Cl
-
)=0.1 mol·L
-1
,
根据原子守恒知
c
平
(NH
3
·H
2
O)+c
平
( )=0.1 mol·L
-1
+0.1 mol·L
-1
=0.2 mol·L
-1
。
(4)
由于
CH
3
COO
-
水解生成
OH
-
,
水解生成
H
+
,
而溶液的
pH=7,
说明
CH
3
COO
-
与 的水
解程度相同
,
根据电荷守恒可知溶液中二者浓度也相同。
答案
:
(1)
酸
+H
2
O NH
3
·H
2
O+H
+
(2)<
(3)Cl
-
(4)=
=
相关文档
- 【化学】吉林省通化市梅河口市博文2021-07-0914页
- 2020-2021学年新教材化学人教版必2021-07-093页
- 人教版化学必修二1-1-3课件第一章 2021-07-0960页
- 【化学】河北省石家庄市辛集市第二2021-07-0910页
- 2021届高考化学一轮复习化学平衡状2021-07-098页
- 2021届高考化学一轮复习滴定原理的2021-07-099页
- 2020-2021学年高二化学重难点训练:2021-07-097页
- 2020-2021年新高三化学一轮复习讲2021-07-0919页
- 高中化学人教必修2课件-第四节 基2021-07-0926页
- 人教版高二化学十三章 高三化学章2021-07-092页