- 1.65 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点 27 元素周期律及其应用
一、元素周期律一、元素周期律
1.定义
元素的性质随着原子序数的递增而呈周期性变化的规律。
2.实质
元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。
3.元素周期表中主族元素性质的递变规律
内容 同周期(从左到右) 同主族(从上到下)
原子半径 逐渐减小 逐渐增大
电子层结构
电子层数相同,最外层电子数
逐渐增多
电子层数逐渐增多,最外层电
子数相同
得电子能力 逐渐增强 逐渐减弱
失电子能力 逐渐减弱 逐渐增强
金属性 逐渐减弱 逐渐增强
非金属性 逐渐增强 逐渐减弱
最高价氧化物对
应水化物的酸碱性
酸性逐渐增强,碱性逐渐减弱 酸性逐渐减弱,碱性逐渐增强
非金属元素气态氢化
物的形成及稳定性
气态氢化物的形成越来越容
易,其稳定性逐渐增强
气态氢化物的形成越来越困
难,其稳定性逐渐减弱
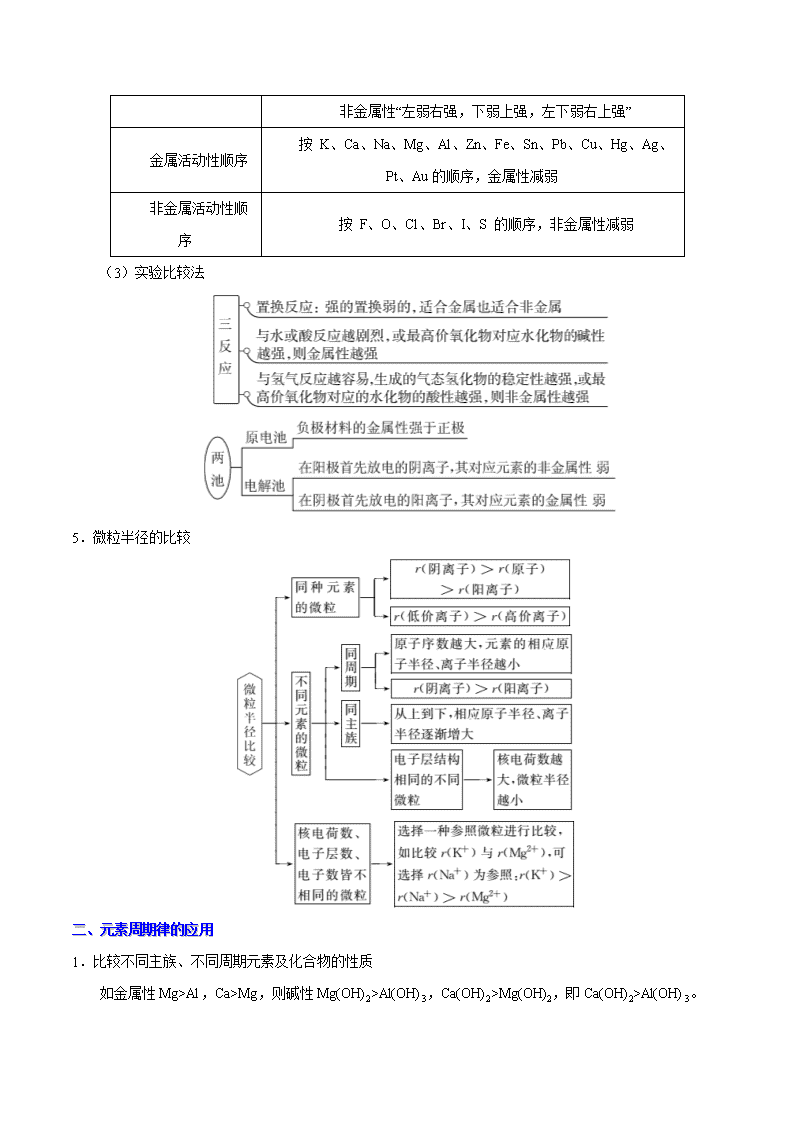
4.元素金属性和非金属性的比较
比较金属性和非金属性的强弱,主要有以下 3 种方法:
(1)结构比较法
最外层电子数越少,电子层数越多,元素金属性越强;最外层电子数越多,电子层数越少,非金属性
越强。
(2)位置比较法
元素周期表 金属性“右弱左强,上弱下强,右上弱左下强”
非金属性“左弱右强,下弱上强,左下弱右上强”
金属活动性顺序
按 K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、
Pt、Au 的顺序,金属性减弱
非金属活动性顺
序
按 F、O、Cl、Br、I、S 的顺序,非金属性减弱
(3)实验比较法
5.微粒半径的比较
二、元素周期律的应用二、元素周期律的应用
1.比较不同主族、不同周期元素及化合物的性质
如金属性 Mg>Al,Ca>Mg,则碱性 Mg(OH)2>Al(OH)3,Ca(OH)2>Mg(OH)2,即 Ca(OH)2>Al(OH)3。
2.推测未知元素及化合物的某些性质
如:已知 Ca(OH)2 微溶,Mg(OH)2 难溶,可推知 Be(OH)2 难溶;再如:已知卤族元素的性质递变规律,
可推知元素砹(At)应为有色固体,与氢难化合,HAt 不稳定,水溶液呈酸性,AgAt 不溶于水等。
考向一 元素金属性和非金属性的比较
典例 1 下列事实不能说明元素的金属性或非金属性相对强弱的是
选项 事实 推论
A 与冷水反应,Na 比 Mg 剧烈 金属性:Na>Mg
B Ca(OH)2 的碱性强于 Mg(OH)2 金属性:Ca>Mg
C SO2 与 NaHCO3 溶液反应生成 CO2 非金属性:S>C
D
t ℃时,Br2+H2 2HBr K=5.6×107
I2+H2 2HI K=43
非金属性:Br>I
【答案】C
【解析】金属元素金属性越强,其单质化学性质越活泼,其最高价氧化物对应的水化物的碱性越强,A、
B 正确;非金属性越强,其单质越易与 H2 发生化合反应,D 正确;C 中 SO2 并不是 S 元素的最高价氧化物,
无法以此为依据判断 S、C 元素的非金属性强弱,错误。
1.下列实验操作不能达到实验目的的是
选项 实验操作 实验目的
A Cl2、Br2 分别与 H2 反应 比较氯、溴的非金属性强弱
B 向 MgCl2、AlCl3 溶液中分别滴加氨水 比较镁、铝的金属性强弱
C
测定相同物质的量浓度的 Na2CO3、Na2SO4
的溶液的 pH
比较碳、硫的非金属性强弱
D Fe、Cu 分别放入稀盐酸中 比较铁、铜的金属性强弱
【答案】B
【解析】A 项,Cl2、Br2 分别与 H2 反应,根据反应条件的难易,即可判断出氯、溴的非金属性强弱;
B 项,MgCl2 与 NH3·H2O 反应生成 Mg(OH)2,AlCl3 与 NH3·H2O 反应生成 Al(OH)3,但无法比较两者
的金属性强弱;C 项,测定相同物质的量浓度的 Na2CO3、Na2SO4 溶液的 pH,根据 pH 可判断出 Na2CO3
与 Na2SO4 水解程度的大小,即判断出酸性 H2CO3Sn,而金属活动性 Sn>Pb。
(4)利用原电池原理比较元素金属性时,不要忽视介质对电极反应的影响。如 Al−Mg−NaOH 溶液构
成原电池时,Al 为负极,Mg 为正极;Fe−Cu−HNO3(浓)构成原电池时,Cu 为负极,Fe 为正极。
考向二 微粒半径大小的比较
典例 2 已知 1-18 号元素的离子 aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
A.质子数:c>b B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
【答案】B
【解析】
A. X 在 Y 的下一周期,所以质子数 b>c,A 错误;
B. Z 在 Y 元素的右侧,Z 元素的非金属性比 Y 强,所以阴离子的还原性 Y2->Z-,B 正确;
C. Z 元素的非金属性比 Y 强,所以 Z 的氢化物比 Y 的氢化物稳定,C 错误;
D. X 与 W 是同周期元素,X 的原子序数小于 W,所以 X 的原子半径大于 W,D 错误。
答案选 B。
2.五种短周期元素的某些性质如表所示(其中只有 W、Y、Z 为同周期元素)。下列说法正确的是
元素代号 X W Y Z Q
原子半径(×10-12m) 37 64 66 70 154
主要化合价 +1 -1 -2 +5、-3 +1
A.W 的最高正价为十 7
B.由 Q 与 Y 形成的化合物中只存在离子键
C.Z 与 X 之间形成的化合物具有还原性
D.由 X、Y、Z 三种元素形成的化合物的水溶液一定呈碱性
【答案】C
【解析】
A. W 是 F 元素,F 没有正价,故 A 错误;
B. Y 是 O 元素、Q 是 Na 元素,二者能形成 Na2O、Na2O2,Na2O 中只存在离子键,Na2O2 中存在离子键和
共价键,故 B 错误;
C. Z 与 X 之间形成的化合物是 NH3,氨气中 N 元素处于最低价态,所以氨气具有还原性,故 C 正确;
D. 由 H、O、N 三种元素形成的化合物中硝酸铵和硝酸的水溶液均为酸性,故 D 错误;
故选 C。
“三看”法快速判断简单微粒半径的大小
1.短周期主族元素 X、Y、Z.、W 的原子序数依次增大,元素 Y 是地壳中含量最多的元素。X 与 Z 同主族
且二者可形成离子化合物,W 最外是电子数是其电子层数的 2 倍。下列说法正确的是
A.非金属性:XS>O,故 B 正确;
C.根据上述分析:W 为 S 元素,它形成的 H2SO3 为弱酸,故 C 错误;
D.根据上述分析:Z 为 Na 元素,Z 的氧化物有氧化钠和过氧化钠,氧化钠对应的水化物为 NaOH,属于强
减,过氧化钠和水反应生成 NaOH 和氧气,故 D 错误;故答案:B。
2.下列说法正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O ④氧化性:Li+HCl
A.①②③ B.①②⑤
C.②③④ D.①②④⑤
【答案】B
【解析】①都是相应元素的最高价含氧酸,非金属性越强,其酸性越强,非金属性:Cl>Br>I,因此酸性:
HClO4>HBrO4>HIO4,正确;②元素金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:
Ba>Mg>Be,碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,正确;③同周期从左向右,元素非金属性增强(稀有
气体元素除外),错误;④金属性:K>Na>Li,氧化性:Li+>Na+>K+,错误;⑤HF 分子之间形成分子
间氢键,而 HCl 分子间不存在氢键,存在分子间氢键的物质沸点较高,正确。
3 . 同 主 族 中 常 见 的 三 种 元 素 X 、 Y 、 Z , 它 们 最 高 价 氧 化 物 对 应 水 化 物 的 酸 性 强 弱 的 顺 序 为
HXO4Y-
C.气态氢化物的稳定性:HXZ
【答案】D
【解析】从元素最高价氧化物对应水化物的化学式可知,三种元素的最高化合价均为+7 价,故为第ⅦA
族元素,由元素最高价氧化物对应水化物的酸性强弱可知,非金属性:XBr-,B
项正确;气态氢化物的稳定性:HIBr2,D 项错误。
4.几种短周期元素的原子半径及主要化合价如图所示,下列叙述不正确的是
A.X、Y 的最高价氧化物都可以作耐火材料
B.Z 的非金属性小于 W
C.Y 的最高价氧化物对应的水化物能溶于稀氨水
D.X 的单质可分别与 Z、W 的单质发生氧化还原反应
【答案】C
【解析】依据题图可知元素 X、Y、Z、W 分别为 Mg、Al、N、O。氧化镁和氧化铝的熔点都较高,都可
作耐火材料,A 项正确;同一周期主族元素从左到右,非金属性逐渐增强,O 的非金属性强于 N 的,B
项正确;氢氧化铝不能溶于稀氨水,C 项错误;镁能分别与氮气、氧气发生氧化还原反应,D 项正确。
5.部分短周期元素原子半径、最高正化合价或最低负化合价随原子序数的变化关系如图所示,下列说法正
确的是
A.离子半径的大小顺序:dz>d
C.除去实验后试管中残留的 g 的单质,可用热的氢氧化钠溶液
D.g、h 的氧化物对应的水化物的酸性:h>g
【答案】C
【解析】根据题图中元素化合价、原子半径和原子序数的关系可确定 x 是 H,y 是 C,z 是 N,d 是 O,e
是 Na,f 是 Al,g 是 S,h 是 Cl。核外电子排布相同的离子,核电荷数越大离子半径越小,故离子半径:
O2->Na+>Al3+,A 项错误;常温下,水为液体,甲烷、氨气均为气体,三者中水的沸点最高,又氨气分
子间存在氢键,其沸点高于甲烷,故 B 项错误;除去实验后试管中残留的单质硫,可用热的 NaOH 溶液
洗涤,反应的化学方程式为 3S+6NaOH=====
△
2Na2S+Na2SO3+3H2O,C 项正确;Cl 的氧化物对应的水
化物的酸性不一定大于 S 的氧化物对应的水化物的酸性,D 项错误。
6.下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
【答案】C
【解析】
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前 7 种元素处于第二周期,后 7 种元素
处于第三周期,由原子序数可以知道 X 为 O 元素,Y 为 F 元素,Z 为 Na 元素,M 为 Al 元素,N 为 Si 元
素,R 为 Cl 元素。
A.同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,
所以碱性强弱为:Z>M,A 错误;
B.X、N 两种元素组成的化合物为二氧化硅,二氧化硅是由原子组成,属于共价化合物,B 错误;
C.气态氢化物的稳定性和非金属性有关,非金属性越强,气态氢化物越稳定,非金属性 Y>R,Y、R 两
种元素气态氢化物的稳定性:Y>R,C 正确;
D.离子电子层结构相同,核电荷数越大,离子半径越小,所以简单离子的半径:MI
【答案】A
【解析】A 项,F2 极易与水反应生成氟化氢和氧气,所以 F2 不能与 NaCl 溶液反应置换出氯气,正确。B
项,氯气易与水反应生成次氯酸和盐酸,所以不能用水吸收氯气中的杂质,错误。C 项,苯的密度比水
的小,应在上层,所以装置 E 上层呈现紫红色,错误。D 项,溴单质和碘化钾反应生成碘单质,但过量
氯气也会氧化碘离子生成碘单质,造成干扰,所以不能证明非金属性:Br>I,错误。
8.X、Y、Z、W 为原子序数递增的 4 种短周期元素,其中 Y、Z 为金属元素。X、Y、Z、W 的最高价氧化
物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“—”相连的两种物质能发生反应)。下
列判断正确的是
A.X 是元素周期表中非金属性最强的元素
B.冶炼 Z 的单质可通过电解其氯化物的方式获得
C.4 种元素形成的简单离子中,Y 离子半径最小
D.W 的阴离子可能促进水的电离
【答案】D
【解析】根据 X、Y、Z、W 为原子序数递增的 4 种短周期元素,金属元素 Z 的最高价氧化物对应的水
化物丙能分别与金属元素 Y,非金属元素 X、W 的最高价氧化物对应的水化物反应,推知 Z 为 Al,Y 为
Na;X、W 为非金属元素,其最高价氧化物对应的水化物能与 Al(OH)3 反应,结合原子序数关系推知,
X 为 N,W 为 P 或 S 或 Cl。元素周期表中非金属性最强的元素为 F,A 项错误;工业上冶炼铝,通过电
解熔融 Al2O3 的方式获得,而 AlCl3 为共价化合物,熔融时不导电,B 项错误;W 的离子有 3 个电子层,
而 X、Y、Z 的离子有 2 个电子层,且具有相同电子层结构,离子半径:N3->Na+>Al3+,4 种元素形成的
简单离子中 Al3+的离子半径最小,C 项错误;若 W 为 S,S2-在溶液中能水解,促进水的电离,D 项正
确。
9.某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图 1 所示的装置来一次性完成同
主族元素碳与硅的非金属性强弱比较的实验。
乙同学设计了如图 2 所示的装置来验证卤族元素性质的递变规律,A、B、C 三处分别是蘸有 NaBr 溶
液的棉花、湿润的淀粉 KI 试纸、湿润的红色试纸。
已知常温下浓盐酸与高锰酸钾反应能够生成氯气。可供选择的试剂有:大理石、碳酸钠粉末、浓盐酸、
稀硝酸、硅酸钠溶液
图 1 图 2
根据图 1 回答:
(1)甲同学设计实验的依据是 。从所给试剂中选出最合适的物质:A ,
B ,C 。(写化学式)
(2)烧瓶中发生反应的离子方程式为 ;烧杯中发生反应的离子方程式
为 。
根据图 2 回答:
(3)乙同学的实验原理是 。
(4)B 处的实验现象是 。
(5)B 处主要发生的反应的离子方程式为 。
(6)乙同学设计的装置能否验证卤族元素性质的递变规律? (填“能”或“不能”),理由
是 。
【答案】(1)较强酸制较弱酸 HNO3 CaCO3 Na2SiO3
(2)CaCO3+2H+ Ca2++CO2↑+H2O
2
3SiO +2CO2+2H2O H2SiO3↓+2 3HCO 或 2
3SiO +CO2+H2O H2SiO3↓+ 2
3CO
(3)强氧化剂生成弱氧化剂(或活泼的非金属单质置换不活泼的非金属单质)
(4)湿润的淀粉 KI 试纸变蓝
(5)2I-+Cl2 2Cl-+I2
(6)不能 不能验证 Br2 的氧化性强于 I2
【解析】(1)由题意可知,可以通过比较 C、Si 的最高价氧化物对应水化物的酸性强弱来判断碳和硅两
种元素的非金属性强弱。观察图 1,B 为块状固体,则可判断 B 为大理石,应采用稀硝酸(不能使用浓盐
酸,因为浓盐酸有挥发性)与大理石反应制取 CO2,则 A 是 HNO3,B 是 CaCO3,C 是 Na2SiO3。
( 2 ) 烧 瓶 中 发 生 的 是 大 理 石 与 稀 硝 酸 之 间 的 反 应 , 反 应 的 离 子 方 程 式 是
CaCO3+2H+ Ca2++CO2↑+H2O。烧杯中发生的是硅酸钠和二氧化碳之间的反应,反应的离子方程式
是 2
3SiO +CO2+H2O H2SiO3↓+ 2
3CO (CO2 不足),或 2
3SiO +2CO2+2H2O H2SiO3↓+2 3HCO
(CO2 过量)。
(3)浓盐酸与高锰酸钾反应会生成氯气,氯气经过 B 处会与 KI 反应生成 I2,由此可知,验证卤族元素
性质的递变规律的实验原理是强氧化剂生成弱氧化剂(或活泼的非金属单质可置换出不活泼的非金属单
质)。
(4)氯气在 B 处与 KI 反应生成单质碘,碘单质与淀粉作用使其变蓝。
(5)B 处主要发生的是氯气与 KI 的反应,其离子方程式是 Cl2+2I- 2Cl-+I2。
1.(2020·新课标Ⅱ)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素 W、
X、Y、Z 的原子序数依次增大、且总和为 24。下列有关叙述错误的是
A.该化合物中,W、X、Y 之间均为共价键
B.Z 的单质既能与水反应,也可与甲醇反应
C.Y 的最高化合价氧化物的水化物为强酸
D.X 的氟化物 XF3 中原子均为 8 电子稳定结构
【答案】D
【解析】一种由短周期主族元素形成的化合物,具有良好的储氢性能,其中元素 W、X、Y、Z 的原子序数
依次增大,且总和为 24,根据图示,W 为 1 价形成共价键,W 为氢,Z 为+1 价阳离子,Z 为 Na,Y 为 3
价,Y 为 N,24−1−11−7=5,X 为 B 元素。该化合物中,H、B、N 之间均以共用电子对形成共价键,故 A
正确;Na 单质既能与水反应生成氢氧化钠和氢气,也能与甲醇反应生成甲醇钠和氢气,故 B 正确;N 的最
高价氧化物的水化物 HNO3 为强酸,故 C 正确;B 的氟化物 BF3 中 B 原子最外层只有 6 个电子,达不到 8
电子稳定结构,故 D 错误;故选 D。
2.(2020·浙江卷)X、Y、Z、M、Q 五种短周期元素,原子序数依次增大。Y 元素的最高正价为+4 价,Y
元素与 Z、M 元素相邻,且与 M 元素同主族;化合物 2 4Z X 的电子总数为 18 个;Q 元素的原子最外层电子
数比次外层少一个电子。下列说法不正确...的是( )
A.原子半径: Z Y M
B.最高价氧化物对应水化物的酸性: Z Y M
C. 2 2X Z ZX 易溶于水,其水溶液呈碱性
D.X、Z 和 Q 三种元素形成的化合物一定是共价化合物
【答案】D
【解析】X、Y、Z、M、Q 为五种短周期元素,原子序数依次增大。Y 元素的最高正价为+4 价,则证明该
元素为第 IVA 族元素,又知 Y 元素与 Z、M 元素相邻,且与 M 同族,则在元素周期表位置应为
IVA 族 VA 族
Y Z
M
,故推知 Y 为 C 元素,Z 为 N 元素,M 为 Si 元素;化合物 Z2X4 的电子总数为 18,则推知,X 为 H,该化
合物为 N2H4;Q 元素的原子最外层电子总数比次外层电子数少一个电子,推出 Q 为 Cl 元素,据此结合元
素周期律与物质的结构与性质分析作答。根据上述分析可知,X 为 H、Y 为 C 元素、Z 为 N 元素、M 为 Si
元素、Q 为 Cl 元素,则同周期元素从左到右原子半径依次减小,同主族元素从上到下原子半径依次增大,
则原子半径比较:Z(N)Y>Z
C.Y 的最高价氧化物的水化物是中强酸
D.该新化合物中 Y 不满足 8 电子稳定结构
【答案】C
【解析】由 W、X、Y、Z 为同一短周期元素,Z 的核外最外层电子数是 X 核外电子数的一半可知,Z 为
Cl、X 为 Si,由化合价代数和为 0 可知,Y 元素化合价为−3 价,则 Y 为 P 元素;由 W 的电荷数可知,
W 为 Na 元素。
A 项、氯化钠为强酸强碱盐,水溶液呈中性,故 A 错误;
B 项、同周期元素从左到右,非金属性依次增强,则非金属性的强弱顺序为 Cl>P>Si,故 B 错误;
C 项、P 元素的最高价氧化物对应水化物为磷酸,磷酸是三元中强酸,故 C 正确;
D 项、新化合物中 P 元素化合价为−3 价,满足 8 电子稳定结构,故 D 错误。故选 C。
4.[2019 新课标Ⅲ]X、Y、Z 均为短周期主族元素,它们原子的最外层电子数之和为 10,X 与 Z 同族,Y
最外层电子数等于 X 次外层电子数,且 Y 原子半径大于 Z。下列叙述正确的是
A.熔点:X 的氧化物比 Y 的氧化物高
B.热稳定性:X 的氢化物大于 Z 的氢化物
C.X 与 Z 可形成离子化合物 ZX
D.Y 的单质与 Z 的单质均能溶于浓硝酸
【答案】B
【解析】Y 的最外层电子数等于 X 次外层电子数,由于均是主族元素,所以 Y 的最外层电子数不可能是
8 个,则 X 只能是第二周期元素,因此 Y 的最外层电子数是 2 个,又因为 Y 的原子半径大于 Z,则 Y 只
能是第三周期的 Mg,因此 X 与 Z 的最外层电子数是(10-2)/2=4,则 X 是 C,Z 是 Si。
A、碳的氧化物形成的分子晶体,Y 的氧化物是离子化合物氧化镁,则氧化镁的熔点高于碳的氧化物熔
点,A 错误;
B、碳元素的非金属性强于硅元素,非金属性越强,氢化物越稳定,则碳的氢化物稳定性强于硅的氢化
物稳定性,B 正确;
C、C 与 Si 形成的是共价化合物 SiC,C 错误;
D、单质镁能溶于浓硝酸,单质硅不溶于浓硝酸,D 错误;答案选 B。
5.[2018 天津卷]下列有关物质性质的比较,结论正确的是
A.溶解度:Na2CO3c>b>a B.4 种元素中 b 的金属性最强
C.c 的氧化物的水化物是强碱 D.d 单质的氧化性比 a 单质的氧化性强
【答案】B
【解析】a、b、c、d 分别为 O、Na 或 Mg、Al、S。A、一般电子层数越多,半径越大,同周期从左向右原
子半径减小,因此半径大小顺序是 Na(Mg)>Al>S>O,故 A 错误;B、同周期从左向右金属性减弱,因此 Na
或 Mg 在 4 种元素中金属性最强,故 B 正确;C、c 的氧化物的水化物为氢氧化铝,为两性氢氧化物,属于
弱碱,故 C 错误;D、同主族从上到下非金属性减弱,因此 S 的氧化性比氧气弱,故 D 错误。
7.[2017 天津]根据元素周期表和元素周期律,判断下列叙述不正确...的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图 1 所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“ ”(ào)命名的第 118 号元素在周期表中位于第七周期 0 族
【答案】C
【解析】A、气态氢化物稳定性与非金属性一致,非金属性 O>N>Si,所以气态氢化物稳定性 H2O>NH3
>SiH4,A 正确;B、氢元素可与非金属元素形成共价化合物如 H2O 等,也可以与某些金属生成离子化
合物如 NaH 等,B 正确;C、不能用氢化物的酸性来验证非金属性强弱,可以采用最高价含氧酸酸性强
弱来验证,C 错误;D、根据元素周期表知识判断,各周期 0 族元素的原子序数依次为 2、10、18、36、
54、86、118,所以第 118 号元素在周期表中位于第七周期 0 族,D 正确。故选 C。
8.[2016·全国Ⅲ]四种短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、X 的简单离子具有相同电子
层结构,X 的原子半径是短周期主族元素原子中最大的,W 与 Y 同族,Z 与 X 形成的离子化合物的水溶
液呈中性。下列说法正确的是
A.简单离子半径:WZ
【答案】B
【解析】X 的原子半径是短周期主族元素原子中最大的,为钠元素,ZX 形成的化合物为中性,说明为氯
化钠,则 Y 为硫元素,W 为氧元素。A、钠离子和氧离子电子层结构相同,核电荷数越大,半径越小,
故钠离子半径小于氧离子半径,故错误;B、氧和钠形成的化合物为氧化钠或过氧化钠,其水溶液都为
氢氧化钠,显碱性,故正确;C、水和硫化氢比较,水稳定性强,故错误;D、最高价氧化物对应的水化
物中高氯酸是最强酸,故错误。
9.[2015·上海]不能作为判断硫、氯两种元素非金属性强弱的依据是
A.单质氧化性的强弱
B.单质沸点的高低
C.单质与氢气化合的难易
D.最高价氧化物对应的水化物酸性的强弱
【答案】B
【解析】A.元素的非金属性越强,其单质获得电子的能力就越强,因此单质氧化性就越强。故可以通
过比较单质氧化性的强弱,判断元素的非金属性的强弱,正确。B.S 单质、Cl2 都是由分子组成的,分
子之间通过分子间作用力结合,分子间作用力越大,物质的熔、沸点就越高,这与元素的非金属性强弱
无关,错误。C.元素的非金属性越强,其单质与氢气化合形成氢化物就越容易,形成的氢化物的稳定
性就越强。因此可以比较元素的非金属性的强弱,正确。D.元素的非金属性越强,其最高价氧化物对
应的水化物的酸性就越强,因此可以通过比较硫、氯两种元素最高价氧化物对应的水化物酸性的强弱比
较元素的非金属性的强弱,正确。
10.[2015·全国Ⅰ]W、X、Y、Z 均为短周期主族元素,原子序数依次增加,且原子核外 L 电子层的电子数
分别为 0、5、8、8,它们的最外层电子数之和为 18。下列说法正确的是
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y
相关文档
- 备战2021 高考化学 考点23 常见气2021-07-0918页
- 高考化学5年高考真题精选与最新模2021-07-0921页
- 2020届高考化学一轮复习元素周期表2021-07-0916页
- 备战2021 高考化学 考点58 分子结2021-07-0938页
- 重庆市2021高考化学一轮复习专题一2021-07-0960页
- 高考化学二轮复习专题03氧化还原反2021-07-0931页
- 2019届高考化学一轮复习化学反应中2021-07-0914页
- 高考化学第一轮复习课件第1讲 弱2021-07-098页
- 2020-2021年高考化学一轮复习第六2021-07-0918页
- 备战2021 高考化学 考点14 钠及其2021-07-0928页