- 614.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题强化训练(七)
能力练(20分钟)
一、选择题
1.(2019·长春市质量监测一)在一定温度和压强下,往容积可变的密闭容器中通入物质的量相等的X、Y气体,发生反应:X(g)+3Y(g)2Z(g) ΔH=-m kJ·mol-1(m>0)。下列说法正确的是( )
A.密闭容器的体积保持不变,说明反应已达到平衡
B.密闭容器中X的体积分数不变,说明反应已达到平衡
C.反应达到平衡时,X和Y的转化率相等
D.反应达到平衡时,放出的热量不可能为m kJ
[解析] 该反应为气体分子数发生变化的反应,一定温度和压强下,当容器体积不变时,说明反应已达平衡,A项正确;设X和Y起始的物质的量均为a mol,反应进行到某时刻,X转化x mol,则Y转化3x mol,此时X的物质的量为(a-x)mol,Y为(a-3x)mol,Z为2x mol,X的体积分数为=,该值始终不变,所以X的体积分数不变时不能表明反应已达平衡,B项错误;相同条件下,X和Y的转化量不等,又二者起始投入量相等,则平衡时X和Y的转化率肯定不相等,C项错误;因X和Y起始投入量未知,故平衡时反应放出的热量可能达到m kJ,D项错误。
[答案] A
2. (2019·合肥市质检二)在恒温密闭容器中发生反应:CaCO3(s)CaO(s)+CO2(g) ΔH>0,反应达到平衡后,t1时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是( )
A.v逆(逆反应速率) B.ρ(容器内气体密度)
C.m(容器内CaO质量) D.Qc(浓度商)
[解析] t1时缩小容器体积,压强增大,v逆瞬时增大,增大压强,平衡逆向移动,故v逆逐渐减小,A项不符合题意;容器内只有CO2一种气体,缩小容器体积,气体密度瞬时增大,随着平衡逆向移动,CO2的质量逐渐减小,容器内气体密度也逐渐减小,B项不符合题意;缩小容器体积,容器内CaO的质量瞬时不变,随着平衡逆向移动,CaO的质量逐渐减小,C项符合题意;浓度商Qc=c(CO2),缩小容器体积,CO2的浓度瞬时增大,随着平衡逆向移动,CO2的浓度逐渐减小,则浓度商Qc也先瞬时增大,后逐渐减小,D项不符合题意。
[答案] C
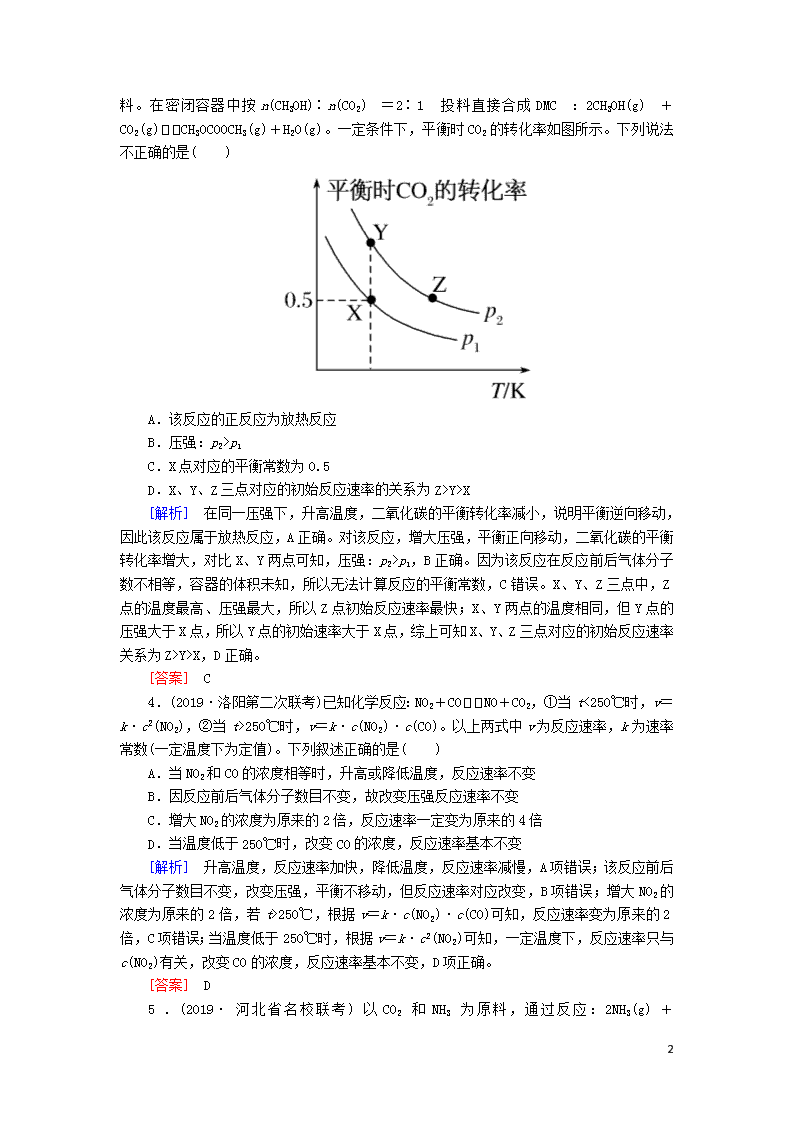
3.(2019·湖南六校联考)碳酸二甲酯(CH3OCOOCH3
13
,简称DMC)是一种应用前景广泛的材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1投料直接合成DMC:2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)。一定条件下,平衡时CO2的转化率如图所示。下列说法不正确的是( )
A.该反应的正反应为放热反应
B.压强:p2>p1
C.X点对应的平衡常数为0.5
D.X、Y、Z三点对应的初始反应速率的关系为Z>Y>X
[解析] 在同一压强下,升高温度,二氧化碳的平衡转化率减小,说明平衡逆向移动,因此该反应属于放热反应,A正确。对该反应,增大压强,平衡正向移动,二氧化碳的平衡转化率增大,对比X、Y两点可知,压强:p2>p1,B正确。因为该反应在反应前后气体分子数不相等,容器的体积未知,所以无法计算反应的平衡常数,C错误。X、Y、Z三点中,Z点的温度最高、压强最大,所以Z点初始反应速率最快;X、Y两点的温度相同,但Y点的压强大于X点,所以Y点的初始速率大于X点,综上可知X、Y、Z三点对应的初始反应速率关系为Z>Y>X,D正确。
[答案] C
4.(2019·洛阳第二次联考)已知化学反应:NO2+CONO+CO2,①当t<250℃时,v=k·c2(NO2),②当t>250℃时,v=k·c(NO2)·c(CO)。以上两式中v为反应速率,k为速率常数(一定温度下为定值)。下列叙述正确的是( )
A.当NO2和CO的浓度相等时,升高或降低温度,反应速率不变
B.因反应前后气体分子数目不变,故改变压强反应速率不变
C.增大NO2的浓度为原来的2倍,反应速率一定变为原来的4倍
D.当温度低于250℃时,改变CO的浓度,反应速率基本不变
[解析] 升高温度,反应速率加快,降低温度,反应速率减慢,A项错误;该反应前后气体分子数目不变,改变压强,平衡不移动,但反应速率对应改变,B项错误;增大NO2的浓度为原来的2倍,若t>250℃,根据v=k·c(NO2)·c(CO)可知,反应速率变为原来的2倍,C项错误;当温度低于250℃时,根据v=k·c2(NO2)可知,一定温度下,反应速率只与c(NO2)有关,改变CO的浓度,反应速率基本不变,D项正确。
[答案] D
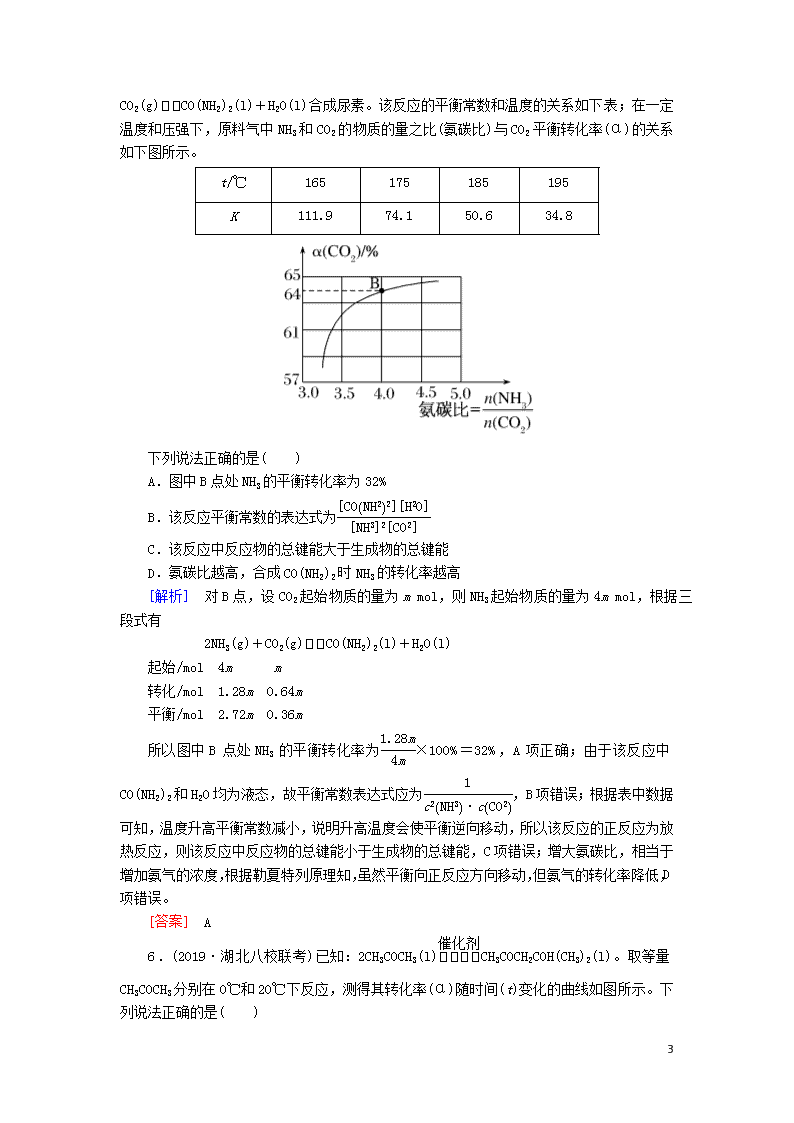
5.(2019·河北省名校联考)以CO2和NH3为原料,通过反应:2NH3
13
(g)+CO2(g)CO(NH2)2(l)+H2O(l)合成尿素。该反应的平衡常数和温度的关系如下表;在一定温度和压强下,原料气中NH3和CO2的物质的量之比(氨碳比)与CO2平衡转化率(α)的关系如下图所示。
t/℃
165
175
185
195
K
111.9
74.1
50.6
34.8
下列说法正确的是( )
A.图中B点处NH3的平衡转化率为32%
B.该反应平衡常数的表达式为
C.该反应中反应物的总键能大于生成物的总键能
D.氨碳比越高,合成CO(NH2)2时NH3的转化率越高
[解析] 对B点,设CO2起始物质的量为m mol,则NH3起始物质的量为4m mol,根据三段式有
2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)
起始/mol 4m m
转化/mol 1.28m 0.64m
平衡/mol 2.72m 0.36m
所以图中B点处NH3的平衡转化率为×100%=32%,A项正确;由于该反应中CO(NH2)2和H2O均为液态,故平衡常数表达式应为,B项错误;根据表中数据可知,温度升高平衡常数减小,说明升高温度会使平衡逆向移动,所以该反应的正反应为放热反应,则该反应中反应物的总键能小于生成物的总键能,C项错误;增大氨碳比,相当于增加氨气的浓度,根据勒夏特列原理知,虽然平衡向正反应方向移动,但氨气的转化率降低,D项错误。
[答案] A
6.(2019·湖北八校联考)已知:2CH3COCH3(l)CH3COCH2COH(CH3)2(l)。取等量CH3COCH3分别在0℃和20℃下反应,测得其转化率(α)随时间(t)变化的曲线如图所示。下列说法正确的是( )
13
A.曲线Ⅱ表示20℃时的转化反应
B.升高温度能提高反应物的平衡转化率
C.在a点时,曲线Ⅰ和Ⅱ表示反应的化学平衡常数相等
D.化学反应速率的大小顺序为:d>b>c
[解析] 根据“先拐先平数值大”可知,曲线Ⅰ先达到平衡状态,因此曲线Ⅰ对应的温度较高,曲线Ⅰ表示20℃时的转化反应,A项错误;曲线Ⅰ温度较高,但平衡转化率较低,故升高温度能降低反应物的平衡转化率,B项错误;a点时,虽然曲线Ⅰ和Ⅱ表示的CH3COCH3的转化率相等,但化学平衡常数仅与温度有关,对应温度不同,平衡常数不相等,C项错误;d、b点处温度比c点处高,反应速率比c点快,d点处比b点处转化率低,故d点处反应物浓度大,反应速率快,故化学反应速率的大小顺序为:d>b>c,D项正确。
[答案] D
7.(2019·保定一模)下列图示与对应的叙述相符的是( )
A.图1表示反应CH4(g)+H2O(g)===CO(g)+3H2(g)的能量变化,使用催化剂可改变Eb-Ea的值
13
B.图2在密闭容器中发生可逆反应:A(g)+2B(g)2C(g) ΔH>0,其他条件不变,改变温度,若p1T2,温度升高,平衡向左移动,吸收热量,所以W点放出的热量大于M点放出的热量,故D正确。
[答案] D
二、非选择题
8.(2019·开封市定位考试)羰基硫(COS)是全球硫循环的重要中间体,也是有机合成中的重要原料,是化学工作者重要的研究对象。已知:
Ⅰ.COS(g)+H2(g)H2S(g)+CO(g) ΔH1=-17 kJ·mol-1;
Ⅱ.COS(g)+H2O(g)H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1;
回答下列问题:
(1)反应CO(g)+H2O(g)H2(g)+CO2(g)的ΔH=________。
(2)在充有催化剂的恒压密闭容器中进行反应Ⅰ。设起始充入的n(H2)∶n(COS)=m,相同时间内测得COS转化率与m和(T)的关系如图所示。
①m1________(填“>”、“<”或“=”)m2。
②温度高于T0℃时,COS转化率减小的可能原因为________。
A.有副反应发生
B.反应的ΔH增大
C.催化剂活性降低
D.逆反应速率增大的倍数小于正反应速率增大的倍数
(3)在恒温、恒容密闭容器中,进行反应Ⅰ。下列说法中能说明反应Ⅰ已达到平衡状态的是________。
A.c(H2S)=c(CO)
B.v正(H2)=v逆(H2S)
C.容器中气体密度保持不变
13
D.容器中混合气体平均摩尔质量保持不变
E.c(COS)保持不变
(4)某温度下,向体积为2 L的恒容密闭容器中通入5 mol COS(g)和5 mol H2O(g),发生反应Ⅱ,5 min末反应达到平衡,测得COS(g)的转化率为80%。
①反应从起始至5 min内,用H2S浓度变化表示的平均反应速率v(H2S)=________。
②该温度下,上述反应的平衡常数K=________。
③其他条件相同时,既能使上述反应中COS的平衡转化率降低,又能使反应速率加快的做法是________。
A.缩小容器容积 B.升高温度
C.分离出硫化氢 D.加入一定量H2O(g)
[解析] (1)根据盖斯定律,由Ⅱ-Ⅰ得到:CO(g)+H2O(g)H2(g)+CO2(g) ΔH=-18 kJ·mol-1。(2)①其他条件相同时,n(H2)∶n(COS)=m越大,COS的转化率越大。图中m1对应COS的转化率大,则m1>m2。②T0℃前,升温,正反应速率加快,COS转化率增大;当温度高于T0℃时,有副反应发生,可导致反应物的转化率减小,A项符合题意;该反应的ΔH不变,不影响反应物的转化率,B项不符合题意;虽然催化剂对平衡移动无影响,但催化剂活性降低后,反应可能停止,可导致反应物的转化率减小,C项符合题意;逆反应速率增大的倍数小于正反应速率增大的倍数,平衡正向移动,反应物转化率增大,D项不符合题意。(3)判断化学反应是否达到平衡状态,可通过观察正反应速率和逆反应速率是否相等、混合物中各组分的浓度是否变化等来确定;c(H2S)和c(CO)相等不能说明反应达到平衡状态,A项错误;H2的正反应速率与H2S的逆反应速率相等能说明反应达到平衡状态,B项正确;该恒容密闭容器中全部为气体,气体质量始终不变,体积不变,则密度始终不变,密度保持不变不能说明反应达到平衡状态,C项错误;该反应在反应前后气体分子数不变,质量不变,混合气体的平均摩尔质量始终不变,故混合气体平均摩尔质量不变不能说明反应达到平衡状态,D项错误;COS浓度保持不变,能说明反应达到平衡状态,E项正确。(4)5 min末反应达到平衡,测得COS的转化率为80%,则
COS(g)+H2O(g)H2S(g)+CO2(g)
开始/mol 5 5 0 0
转化/mol 5×80% 5×80% 5×80% 5×80%
平衡/mol 1 1 4 4
①v(H2S)==0.4 mol·L-1·min-1。②K===16。③其他条件相同时,要使COS的平衡转化率降低,可采用升高温度的方法;使反应速率加快,可采用缩小容器容积、升高温度、加入一定量H2O(g)等方法,综合分析,可采用升高温度的方法,答案选B。
[答案] (1)-18 kJ·mol-1
(2)①> ②AC (3)BE
(4)①0.4 mol·L-1·min-1
②16 ③B
拔高练(25分钟)
13
一、选择题
1.(2019·湖北重点中学联考)工业上利用Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN)的同时有氢气生成。反应中,每生成3 mol H2放出30.8 kJ的热量。在恒温恒容密闭体系内进行上述反应,下列有关表达正确的是( )
A.Ⅰ图像中如果纵轴为正反应速率,则t时刻改变的条件可以为升温或加压
B. Ⅱ图像中纵轴可以为镓的转化率
C. Ⅲ图像中纵轴可以为化学反应速率
D. Ⅳ图像中纵轴可以为体系内混合气体的平均相对分子质量
[解析] 升温或加压均能加快化学反应速率,即升温或加压正反应速率均加快,A项正确;增大压强,平衡逆向移动,Ga的转化率降低,B项错误;镓是固体,增大镓的质量,对化学反应速率无影响,C项错误;温度相同时,加压,平衡逆向移动,混合气体的平均相对分子质量增大,压强相同时,升温,平衡逆向移动,混合气体的平均相对分子质量增大,D项错误。
[答案] A
2. (2019·成都摸底测试)一定温度下,在一密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),
13
c(SO2)随时间(t)变化如图所示。
400℃时压强对SO2的转化率的影响如表。
0.1 MPa
0.5 MPa
1 MPa
10 MPa
99.2%
99.6%
99.7%
99.9%
下列说法正确的是( )
A.a点的v逆大于b点的v逆
B.t2时刻改变的条件一定是增大c(SO2)
C.化学平衡常数d点与e点相等
D.硫酸工业中,SO2催化氧化制SO3时采用高压提高生产效益
[解析] a点时平衡向正反应方向进行,b点时反应达到平衡状态,从a点到b点,正反应速率逐渐减小,逆反应速率逐渐增大,故a点的v逆小于b点的v逆,A项错误;t2时c(SO2)突然增大,随后逐渐减小,说明平衡向正反应方向移动,故t2时刻改变的条件可以是增大c(SO2),还可以是增大压强,B项错误;化学平衡常数只与温度有关,反应温度不变,平衡常数不变,因此d点和e点的化学平衡常数相等,C项正确;根据表中提供的数据可知,增大压强对SO2的转化率影响不大,但增大压强,对工业设备要求高,同时生产成本增大,因此硫酸工业中,SO2催化氧化制SO3时采用高压不能提高生产效益,D项错误。
[答案] C
3.(2019·河北名校联盟2月联考)下列有关平衡移动的方向以及转化率的变化判断正确的是( )
13
[解析] A项,反应平衡后再充入一定量NO2,平衡正向移动,此时NO2的总量以及转化量均增大,但恒容条件通入气体相当于在恒压基础上加压,NO2转化率减小,错误。B项,反应平衡后再充入一定量NO,平衡正向移动,Cl2的转化率增大,NO的转化率减小,错误。C项,充入少量N2O4,反应(2)向右移动,吸热导致体系温度降低,反应(1)向右移动,故CO2和H2转化率增大,而N2O4转化率可由“相当于在恒压基础上加压”来分析,所以N2O4转化率减小,正确。D项,反应平衡后再充入少量CO(g),平衡向右移动,Ni的转化率增大,但由于K不变,所以c(CO)不变,可认为所加CO完全转化为生成物Ni(CO)4,CO的转化率增大,错误。
[答案] C
4. (2019·河北衡水七调)N2O5为新型硝化剂。一定条件下可发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0,在温度为T1、T2时,一定量的N2O5在密闭容器中发生反应,平衡时体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B、C三点的平衡常数大小关系:KA=KC>KB
13
D.A、C两点气体的平均相对分子质量:A>C
[解析] A项,A、C两点温度相同,所以影响二者速率的因素是压强,C点压强大,反应速率快,错误。B项,易因平衡逆向移动而判断A颜色深。气体颜色取决于NO2的浓度,由图像可知,C点平衡压强大,与A点相比可看作平衡会逆向移动,但根据勒夏特列原理,平衡移动只能减弱这种改变,不能消除这种改变,故C点颜色更深,错误。C项,由于A、C两点温度相同,所以K值相同;温度升高,平衡正向移动,NO2的体积分数增大,由A、B两点可知,T2>T1,则KA>KB,正确。D项,由图像可知,A、C两点都在等温线上,C点压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,则平衡相对分子质量大,即A0。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,只受温度影响。实验数据如下:
下列说法正确的是( )
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B.达平衡时,容器Ⅱ中比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
13
[解析] 容器Ⅰ 2NO2(g)2NO(g)+O2(g)
起始量(mol/L) 0.6 0 0
变化量(mol/L) 0.4 0.4 0.2
平衡量(mol/L) 0.2 0.4 0.2
可以求出平衡常数K==0.8,平衡时气体的总物质的量为0.8 mol,其中NO的体积分数为50%,=1。在平衡状态下,v正=v逆,所以k正c2(NO2)=k逆c2(NO)·c(O2),=K=0.8。根据容器Ⅱ的起始投料,Qc==K,反应向逆反应方向移动,所以容器Ⅱ达平衡时,一定小于1,B项错误;若容器Ⅲ在t′时刻,NO的体积分数为50%,设O2的变化量为y mol/L,则有
2NO2(g)2NO(g) + O2(g)
起始量(mol/L) 0 0.5 0.35
变化量(mol/L) 2y 2y y
t′时刻的量(mol/L) 2y 0.5-2y 0.35-y
则0.5-2y=2y+0.35-y,解得y=0.05,Qc==4.8>K,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,C项错误;温度为T2时,=K2=1>0.8,因为正反应是吸热反应,升高温度,平衡正向移动,化学平衡常数变大,所以T2>T1,D项正确。
[答案] D
二、非选择题
8.(2019·河北唐山调研)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
Ⅰ.4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH=-906 kJ·mol-1
Ⅱ.4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH=-1266 kJ·mol-1
13
将固定比例的NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
(1)催化氧化步骤中,最适宜的温度为________(填“T1”或“T2”)℃。
(2)温度低于T1℃时,NO的产率较低的原因为______________。
(3)温度高于T2℃时,NO的产率降低的可能原因为________(填标号)。
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
(4)T3℃(T3>T2)时,向20 L恒容密闭容器中充入2 mol NH3和2.75 mol O2,发生反应Ⅰ。反应过程中各物质的物质的量随时间(t)的变化关系如图2所示。
T3℃时,该反应的平衡常数K=________;5 min时,改变了某一外界条件,所改变的条件可能为_____________。
[解析] (1)工业制硝酸时,催化氧化步骤是为了将NH3转化为NO,根据图1知,T2℃时NO的产率最高,故该步骤最适宜的温度为T2℃。
(2)温度较低时,反应速率慢,同时部分反应物生成N2,因此NO的产率较低。
(3)高于T2℃时NO的产率降低,可能原因为催化剂活性降低或平衡逆向移动,平衡常数减小。
(4)根据图2知,T3℃反应达平衡时,NH3的物质的量为1 mol,O2的物质的量为1.5 mol,NO的物质的量为1 mol,H2O的物质的量为1.5 mol,则平衡常数K==÷=0.075。根据图2知,5 min瞬间各物质的物质的量不变,根据5 min后各物质物质的量的变化之比可知,NO、H2O的物质的量减少,NH3、O2的物质的量增加,说明平衡向逆反应方向移动,逆反应为气体分子数减小的吸热反应,故改变的条件可能为升高温度。
[答案] (1)T2 (2)温度较低时,反应速率慢,同时部分反应物生成N2 (3)AB (4)0.075 升高温度
13
相关文档
- 2019届一轮复习苏教版化学反应速率2021-07-0927页
- 2021版新高考化学一轮复习专题7化2021-07-0972页
- 2019届江苏专版化学反应速率与化学2021-07-0913页
- 全国通用2021高考化学一轮复习第七2021-07-098页
- 2020年高考化学一轮复习化学反应速2021-07-0913页
- 全国通用2021高考化学一轮复习第七2021-07-096页
- 2018届高考一轮复习人教版化学反应2021-07-0920页
- 高考化学5年高考真题精选与最新模2021-07-08104页
- 2021版新高考化学一轮复习专题7化2021-07-0849页
- 2018届二轮复习高考第Ⅰ卷得分方略2021-07-085页