- 441.42 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微考点60 新情景下的综合图像及适宜条件的优化
1.一定条件下合成乙烯:6H2(g)+2CO2(g)CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
A.该反应的逆反应为吸热反应
B.平衡常数:KM>KN
C.生成乙烯的速率:v(N)一定大于v(M)
D.当温度高于250℃,升高温度,催化剂的催化效率降低
2.反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
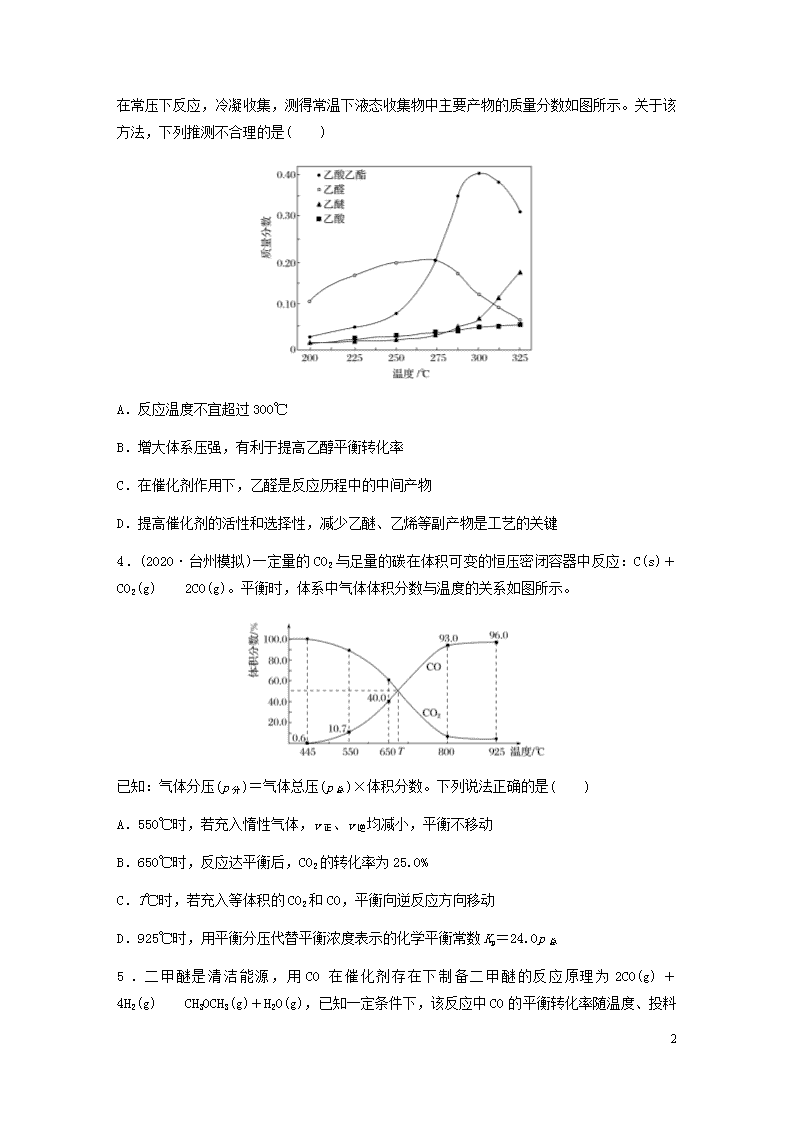
3.近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:
2C2H5OH(g)CH3COOC2H5(g)+2H2(g)
8
在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是( )
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
4.(2020·台州模拟)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后,CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
5.二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为2CO(g)+4H2(g)CH3OCH3(g)+H2
8
O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比的变化曲线如图所示。
(1)a、b、c按从大到小的顺序排序为__________________________________________。
(2)根据图像可以判断该反应为放热反应,理由是_____________________________________
_______________________________________________________________________________。
6.[2016·全国卷Ⅱ,27]丙烯腈(CH2==CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2==CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g)
ΔH=-515kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g)
ΔH=-353kJ·mol-1
两个反应在热力学上趋势均很大,其原因是_______________________________________;
有利于提高丙烯腈平衡产率的反应条件是________________________________________;
提高丙烯腈反应选择性的关键因素是____________________________________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃,低于460℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________________________________________________________________;
高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
8
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与的关系如图(b)所示。由图可知,最佳约为________,理由是____________________________________________________________
________________________________________________________________________,
进料气氨、空气、丙烯的理论体积比约为________。
7.(1)某科研小组根据反应2NO(g)+2CO(g)N2(g)+2CO2(g)来探究起始反应物的碳氮比对污染物去除率的影响。T℃时,向体积为1L的恒容密闭容器中充入总物质的量为4mol的NO和CO混合气体,并加入一定量的固体催化剂进行反应,实验测得平衡体系中气体组分的转化率和氮气的体积分数的变化如图所示。
①根据图像推测曲线转化率1表示的是____________(填“CO”或“NO”)。
②A点时,=____________,此时反应的平衡常数K=________________。
(2)煤炭在O2/CO2的气氛中燃烧会产生CO,有人提出,可以设计反应2CO(g)===2C(s)+O2(g)来消除CO的污染。该提议________________(填“可行”或“不可行”),理由是________________________________________________________________________
________________________________________________________________________。
8.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3
8
与NO的物质的量之比分别为1∶3、3∶1、4∶1时,NO脱除率随温度变化的曲线如图所示。
(1)曲线a中,NO的起始浓度为6×10-4mg·m-3,从A点到B点经过0.8s,该时间段内NO的脱除速率为____________mg·m-3·s-1。
(2)曲线b对应的NH3与NO的物质的量之比是______,其理由是________________________________________________________________________。
9.(1)将燃煤废气中的CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),已知在压强为aMPa下,该反应在不同温度、不同投料比时,CO2的转化率如图:
此反应________(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”“减小”或“不变”)。
(2)[2018·江苏,20(4)②]NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。
8
反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______________________________;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是________________________________________________________________________
________________________________________________________________________。
8
答案精析
1.C 2.B 3.B
4.B [550℃时,若充入惰性气体,由于恒压,相当于扩大了体积,v正、v逆均减小,平衡正向移动,A项错误;根据图示可知,在650℃时,CO的体积分数为40%,根据反应方程式:C(s)+CO2(g)2CO(g),设开始加入1molCO2,反应掉了xmolCO2,则有:
C(s)+CO2(g)2CO(g)
始态: 1mol 0
变化:xmol2xmol
平衡: (1-x) mol 2xmol
因此有×100%=40%,解得x=0.25,则CO2的平衡转化率为×100%=25%,故B项正确;由图可知,T℃时,CO与CO2的体积分数相等,在等压下充入等体积的CO和CO2,对原平衡条件无影响,平衡不移动,C项错误;Kp===23.04p总,D项错误。]
5.(1)a>b>c (2)投料比相同,温度越高,α(CO)越小,平衡左移,该反应为放热反应
6.(1)两个反应均为放热量大的反应 降低温度、减小压强 催化剂
(2)不是 该反应为放热反应,平衡产率应随温度升高而降低
AC
(3)1.0 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1
7.(1)①NO ②1 80
(2)不可行 该反应ΔH>0、ΔS<0,则ΔH-TΔS>0,该反应在任何情况下都不能自发进行
解析 (1)①起始反应物的碳氮比越大,NO的转化率越大,根据图像推测曲线转化率1表示的是NO。②反应2NO(g)+2CO(g)N2(g)+2CO2(g)中NO和CO的化学计量数相等,A点时,两者的转化率相等,均为80%,故=1,此时各物质的浓度分别为0.4 mol·L-1、0.4 mol·L-1、0.8 mol·L-1、1.6 mol·L-1,反应的平衡常数K=
8
=80。(2)设计反应2CO(g)===2C(s)+O2(g)来消除CO的污染的提议不可行,理由是该反应ΔH>0、ΔS<0,则ΔH-T ΔS>0,该反应在任何情况下都不能自发进行。
8.(1)1.5×10-4 (2)3∶1 NH3与NO的物质的量之比越大,NH3的量越多,促使平衡向正反应方向移动,NO的脱除率越大
解析 (1)从A点到B点的浓度变化为(0.75-0.55)×6×10-4mg·m-3=1.2×10-4mg·m-3,脱除速率为=1.5×10-4mg·m-3·s-1。(2)根据勒夏特列原理,NH3与NO的物质的量之比越大,NH3的量越多,促使平衡向正反应方向移动,NO的脱除率越大,由图像可推得曲线b对应的NH3与NO的物质的量之比为3∶1。
9.(1)放热 不变
(2)温度升高,反应速率增大,同时催化剂的活性增大也会提高反应速率。一段时间后催化剂活性增大幅度变小,主要是温度升高使反应速率增大 当温度超过一定值时,催化剂的活性下降,同时氨气与氧气能够反应生成NO而使反应速率减小
解析 (1)当投料比一定时,温度升高,CO2的转化率降低,所以升温,平衡左移,正反应为放热反应,平衡常数只与温度有关,不随投料比的变化而变化,故K不变。
8
相关文档
- 2021届高考化学一轮复习镁、铝及其2021-07-096页
- 人教版高二化学第一单元复习与总结2021-07-096页
- 2020届高考化学一轮复习化学反应速2021-07-094页
- 【化学】河南省平顶山市鲁山县第一2021-07-0911页
- 高三化学上学期期中试题扫描版22021-07-097页
- 2020届高考化学一轮复习糖类、油脂2021-07-0917页
- 人教版化学必修二3-2-1课件第三章 2021-07-0966页
- 2020届一轮复习人教版有机化学基础2021-07-0911页
- 【化学】江苏省靖江高级中学2020-22021-07-097页
- 化学人教版必修1练习:1-2-2气体摩尔2021-07-093页