- 632.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2011年9月理科综合化学实验部分(1)
1.(17分)某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
序号
实验内容
实验现象
离子方程式
实验结论
①
在FeCl2溶液中滴入适量氯水
溶液由浅绿色变为棕黄色
Fe2+具有还原性
②
在FeCl2溶液中加入锌片
20090512
Zn+Fe2+=Zn2++Fe
③
在FeCl3溶液中加入足量铁粉
Fe+2Fe3+=3 Fe2+
Fe具有还原性Fe3+具有氧化性
④
Cu+Fe3+=Cu2++Fe2+
Fe3+具有氧化性
实验结论: 。
(2)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有: 。(填序号)
A.Cl2 B.Na C.Na+
D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化 。
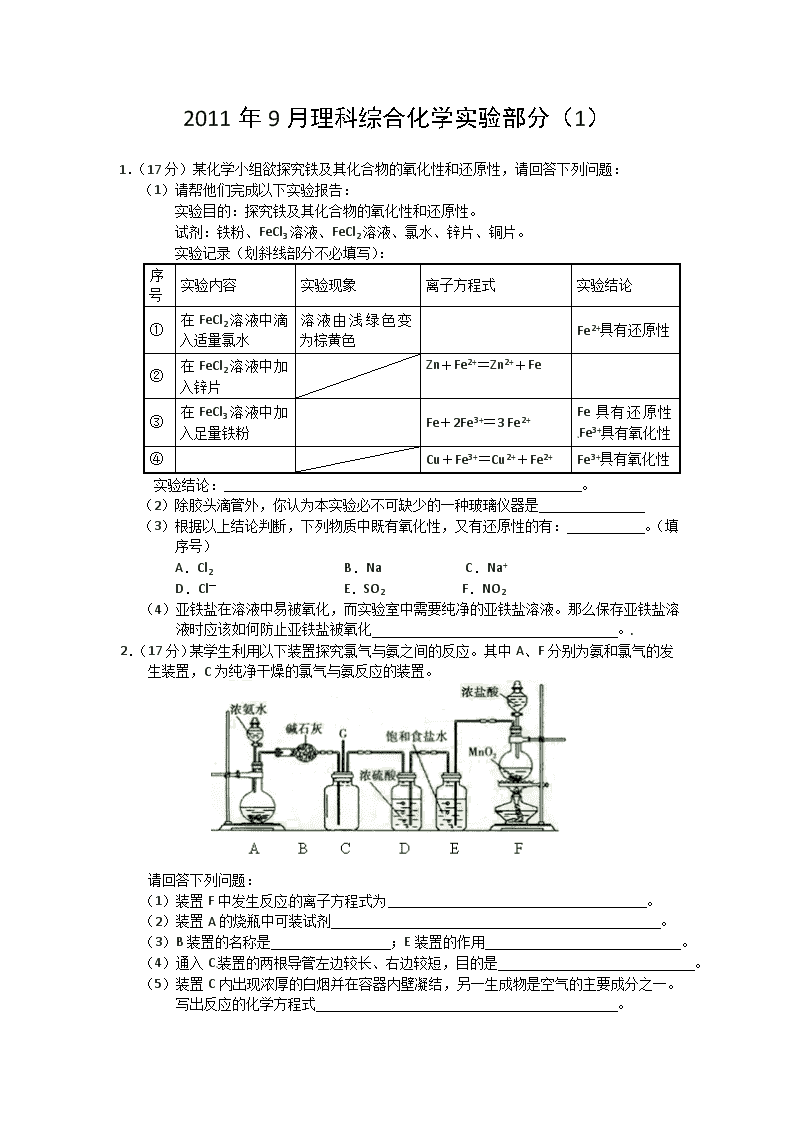
2.(17分)某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂 。
(3)B装置的名称是 ;E装置的作用 。
(4)通入C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式 。
当有a mol氯气参加反应时,转移的电子总数为b个,阿伏加德罗数常数为(用含a、b的代数式表示) 。
(6)从装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
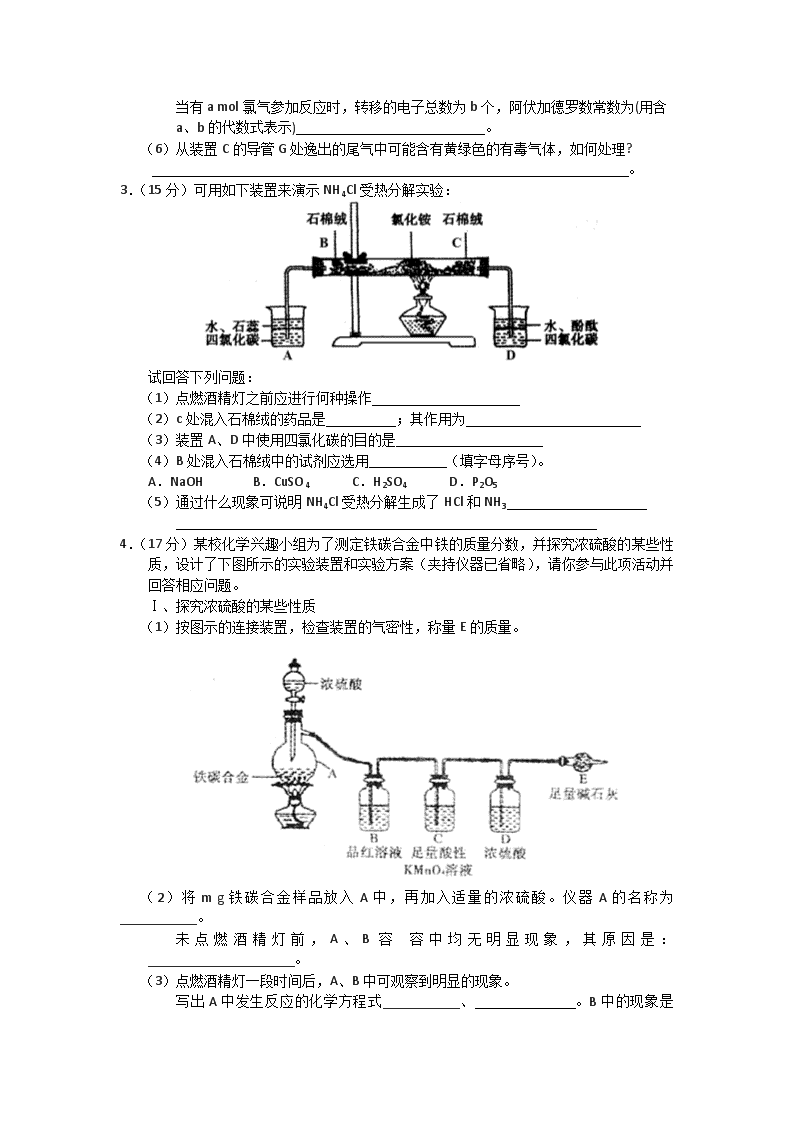
3.(15分)可用如下装置来演示NH4Cl受热分解实验:
试回答下列问题:
(1)点燃酒精灯之前应进行何种操作
(2)c处混入石棉绒的药品是 ;其作用为
(3)装置A、D中使用四氯化碳的目的是
(4)B处混入石棉绒中的试剂应选用 (填字母序号)。
A.NaOH B.CuSO4 C.H2SO4 D.P2O5
(5)通过什么现象可说明NH4Cl受热分解生成了HCl和NH3
4.(17分)某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
Ⅰ、探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为___________。
未点燃酒精灯前,A、B容 容中均无明显现象,其原因是: _____________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式___________、
。B中的现象是______________,由此可知浓硫酸具有_________性。
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ、测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。则铁碳合金中铁的质量分数为_____________________(用含m、b的表达式表示)。
(6)某同学认为上述方法较复杂,使用下图所示的装置和其他常用实验仪器测定某些数据即可。为了快速准确的计算出铁的质量分数,最简便的实验操作是_____________(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量
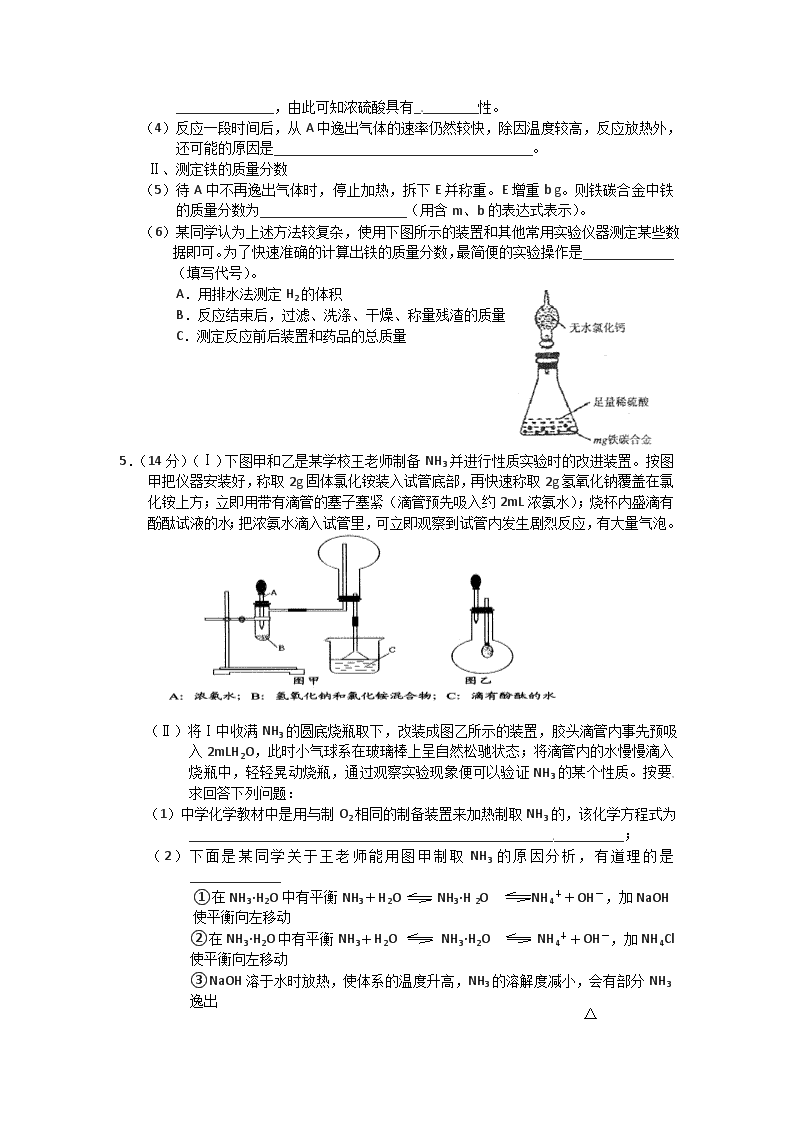
5.(14分)(Ⅰ)下图甲和乙是某学校王老师制备NH3并进行性质实验时的改进装置。按图甲把仪器安装好,称取2g固体氯化铵装入试管底部,再快速称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水;把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡。
(Ⅱ)将Ⅰ中收满NH3的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预吸入2mLH2O,此时小气球系在玻璃棒上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问题:
(1)中学化学教材中是用与制O2相同的制备装置来加热制取NH3的,该化学方程式为______________________________________________________________;
(2)下面是某同学关于王老师能用图甲制取NH3的原因分析,有道理的是_____________
①在NH3·H2O中有平衡NH3+H2O NH3·H 2O NH4++OH-,加NaOH使平衡向左移动
②在NH3·H2O中有平衡NH3+H2O NH3·H2O NH4++OH-,加NH4Cl使平衡向左移动
△
③NaOH溶于水时放热,使体系的温度升高,NH3的溶解度减小,会有部分NH3逸出
④NH4Cl与NaOH在此情况下可反应生成NH3,即NH4++OH- NH3↑+H2O
⑤NH4Cl会分解释放出NH3
(3)图甲中的NH4Cl与NaOH固体混合物能否用CaO固体代替?______(填“能”或“不能”)。
(4)如何判断图甲中烧瓶已收满NH3?________________________________________。
(5)图乙中胶头滴管中的水挤入烧瓶中,观察到的现象是_________,它说明了NH3__________。
参考答案
1.(17分)
(1)①Cl2+2Fe2+=2Cl-+2Fe3+ (2分)
②Fe2+有氧化性(2分)
③铁粉逐渐溶解,溶液由棕黄色变为浅绿色 (2分)
④在FeCl3溶液中加入铜片 (2分)
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。(3分)
(2)试管(2分)
(3)A E F (2分)
(4)在亚铁盐溶液中加入少量稀硫酸和铁粉。(2分)
2.(17分)(1)MnO2+4H++2C1一Mn2++C12↑+2H2O (2分,条件1分)
(2)生石灰或固体氢氧化钠(2分)
(3)干燥管(2分) 除去氯气中的氯化氢(2分)
(4)使密度大的氯气与密度小的氨较快地均匀混合(2分)
(5)3C12+8NH3=N2+6NH4C1(2分) b/2a mol-1 (3分)
(6)在G连接导管直接通入盛有烧碱的烧杯中(2分)
3.(1)检查装置气密性(2分)
(2)药品:碱石灰或氢氧化钠固体 (2分)
作用:吸收NH4Cl 受热分解产生的HCl(3分)
(3)防止倒吸(2分) (4)D (2分)
(5)A中石蕊变红且不褪色说明生成了HCl;(2分)D中酚酞变红说明生成了NH3
4.(共16分)
(2)蒸馏烧瓶;常温下,Fe被浓硫酸钝化,碳不与浓硫酸反应(各2分,共4分)
△
△
(3)2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O (2分)
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (2分)
品红溶液逐渐褪色 ;强氧化 (各1分,共2分)
(4)铁碳在溶液中形成原电池 (2分)
(5) (3分)
(6)C (1分)
5.(14)分 ⑴ Ca(OH)2 +2NH4Cl=CaCl2 +2NH3↑ +2H2O 3分
⑵ ①②③④ 3分 ⑶ 能 2分
⑷ 烧杯中的水变成红色 2分
⑸ 小气球膨胀 极易溶于水 各2分共4分
相关文档
- 高考化学二轮专题复习综合训练一基2021-07-097页
- 2019届高考化学二轮专题复习专题九2021-07-0826页
- 高考化学二轮专题复习第二编专题八2021-07-0827页
- 2018届高考化学二轮专题复习课件:专2021-07-0843页
- 高考化学二轮专题复习第一编专题五2021-07-0734页
- 2012届高考化学二轮专题复习:实验专2021-07-074页
- 2012届高考化学二轮专题复习:实验专2021-07-065页
- 2012届高考化学二轮专题复习:实验专2021-07-066页
- 高考化学二轮专题复习第二编专题六2021-07-0632页
- 2012届高考化学二轮专题复习:实验专2021-07-056页