- 601.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012届高考化学二轮专题复习:实验专题训练(九)
1.(15分)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解,向生成的沉淀中加入 试剂,出现
现象时,就可得出结论。则Na2CO3溶液和CuSO4溶液反应的化学反应方程式为
。
Ⅱ.定量探究生成物的成分。
在定量探究沉淀物成分前,须将沉淀从溶液中分离出来,其操作方法为:
① ② ③ 。
Ⅲ.若沉淀中CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其质量(设每一装置中的反应或吸收均完全)。
(1)各装置连接顺序为 → → → → ;
(2)装置C中碱石灰的作用是 ,实验结束时要通入过量的空气其作用是 ;
(3)若沉淀样品的质量为m克,装置D质量增加了n克,则沉淀中Cu(OH)2的质量分数为: ;
(4)能证明甲同学说法的实验现象是 。
2.(18分)有关铜的性质研究
(Ⅰ)铜在一定条件下也能被腐蚀变为Cu2(OH)2CO3。下列图一装置中,铜腐蚀的速度最慢的是(填图一装置序号) ,久置装置Ⅱ中观察到的现象是 。
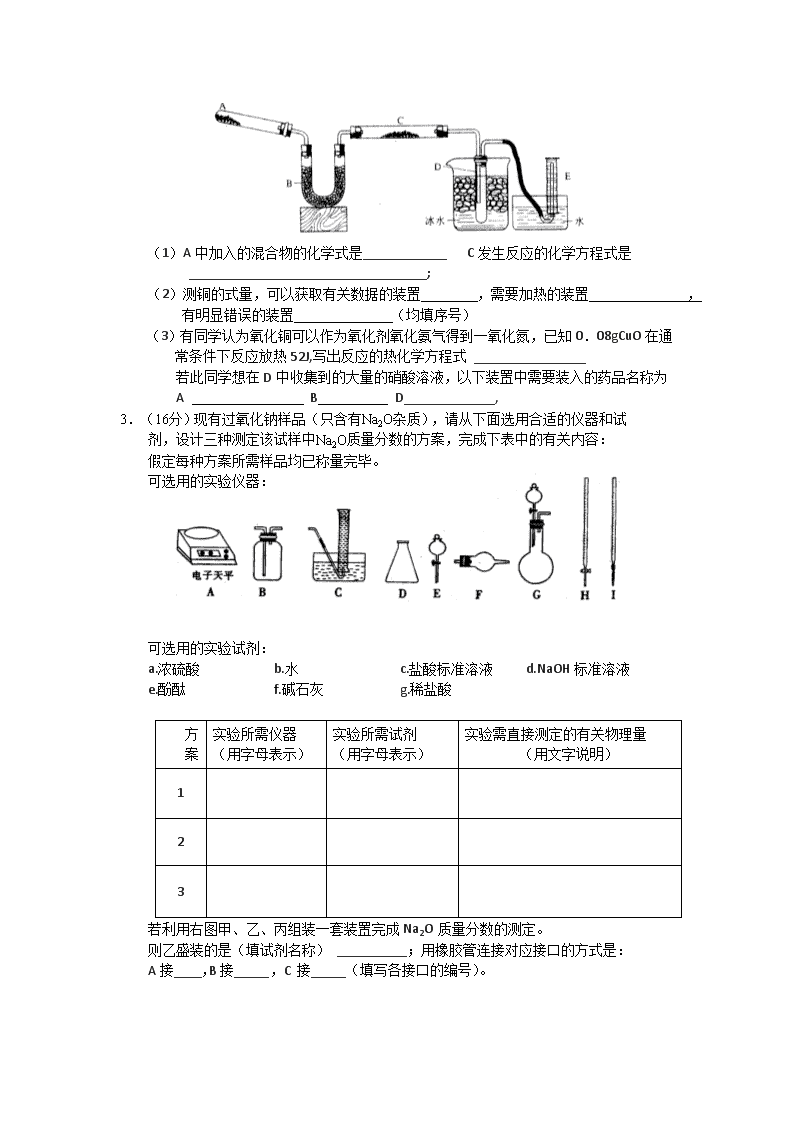
(Ⅱ)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应,同时可以测定铜的式量。(夹持装置省略)
(1)A中加入的混合物的化学式是____________ C发生反应的化学方程式是
__________________________________;
(2)测铜的式量,可以获取有关数据的装置 ,需要加热的装置 ,
有明显错误的装置 (均填序号)
(3)有同学认为氧化铜可以作为氧化剂氧化氨气得到一氧化氮,已知0.08gCuO在通常条件下反应放热52J,写出反应的热化学方程式 ________________
若此同学想在D中收集到的大量的硝酸溶液,以下装置中需要装入的药品名称为
A B D_____________,
3.(16分)现有过氧化钠样品(只含有Na2O杂质),请从下面选用合适的仪器和试剂,设计三种测定该试样中Na2O质量分数的方案,完成下表中的有关内容:
假定每种方案所需样品均已称量完毕。
可选用的实验仪器:
可选用的实验试剂:
a.浓硫酸 b.水 c.盐酸标准溶液 d.NaOH标准溶液
e.酚酞 f.碱石灰 g.稀盐酸
方
案
实验所需仪器
(用字母表示)
实验所需试剂
(用字母表示)
实验需直接测定的有关物理量
(用文字说明)
1
2
3
若利用右图甲、乙、丙组装一套装置完成Na2O质量分数的测定。
则乙盛装的是(填试剂名称) __________;用橡胶管连接对应接口的方式是:
A接____,B接_____,C接_____(填写各接口的编号)。
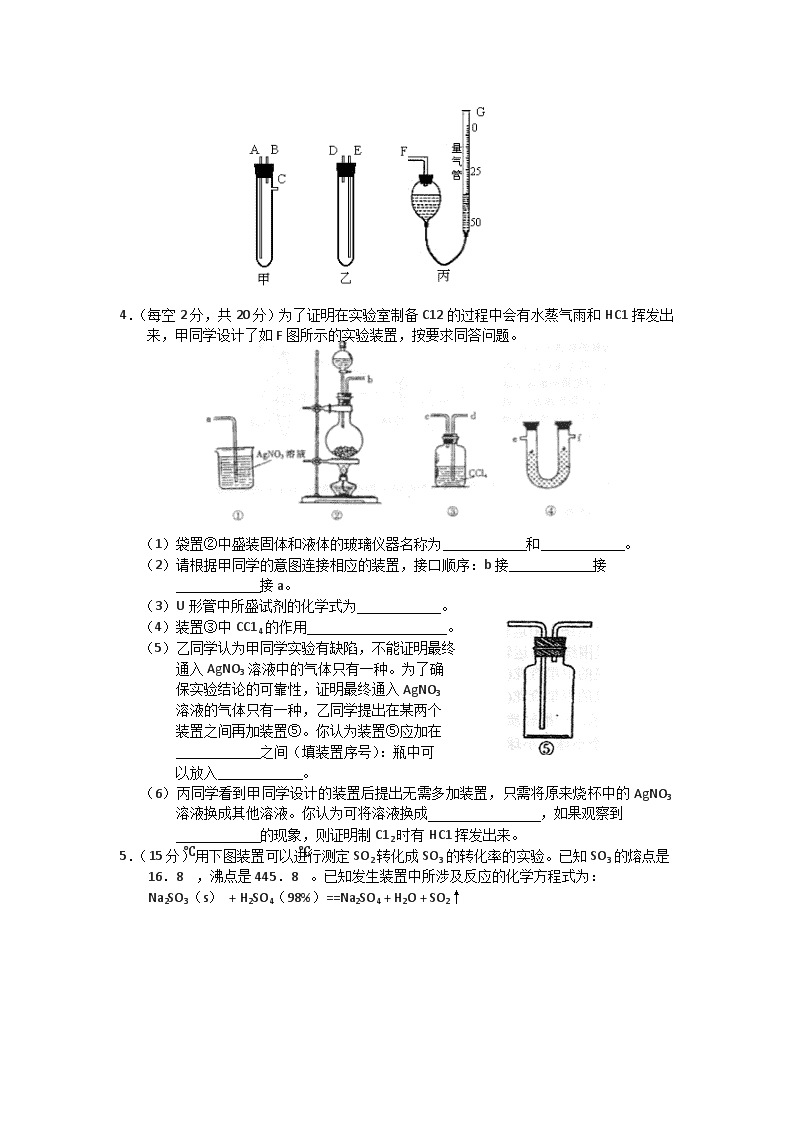
4.(每空2分,共20分)为了证明在实验室制备C12的过程中会有水蒸气雨和HC1挥发出来,甲同学设计了如F图所示的实验装置,按要求同答问题。
(1)袋置②中盛装固体和液体的玻璃仪器名称为 和 。
(2)请根据甲同学的意图连接相应的装置,接口顺序:b接 接
接a。
(3)U形管中所盛试剂的化学式为 。
(4)装置③中CC14的作用 。
(5)乙同学认为甲同学实验有缺陷,不能证明最终
通入AgNO3溶液中的气体只有一种。为了确
保实验结论的可靠性,证明最终通入AgNO3
溶液的气体只有一种,乙同学提出在某两个
装置之间再加装置⑤。你认为装置⑤应加在
之间(填装置序号):瓶中可
以放入 。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成 ,如果观察到
的现象,则证明制C12时有HC1挥发出来。
5.(15分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式 。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)若去掉尾端球形干燥管则会导致测量结果 (偏低或偏高)。
参考答案
1.(15分)
Ⅰ.稀盐酸 (1分) 无气体产生 (1分)
Na2CO3 + CuSO4 + H2O = Na2SO4 + Cu(OH)2↓ + CO2↑ (2分)
Ⅱ.①过滤 (1分) ②洗涤 (1分) ③干燥(1分)
Ⅲ.(1) C → A → B → D → E (2分)
(2)吸收空气中的H2O 和CO2气体(1分),排出装置中滞留的H2O 和CO2气体(1分)
(3)1 -(31n/11m) (2分)
(4)装置B质量不增加(或不变)(2分)
2.(18分(各2分)
(Ⅰ)Ⅲ 铜被腐蚀,左边液面高于右边液面
(Ⅱ)
(2)CE 或C AC E
(3)5CuO(S) +2NH3(g)==5Cu(s) + 2NO(g) + 3H2O(l) ;△H=-260kJ/mol
(4) 碳酸铵或碳酸酸氢铵 过氧化钠 水
3.答案:(每种方案4分,共12分)
方案
实验所需仪器
(用字母表示)
实验所需试剂
(用字母表示)
实验需直接测定的有关物理量
(用文字说明)
1
A、D
b
①反应前锥形瓶和水的总质量
②反应后锥形瓶和溶液的总质量
2
G、C
b
量筒中收集到的气体的体积
3
D、H
b、c、e
中和锥形瓶中试样与水反应后所得
溶液中使用的盐酸标准溶液的体积
水(1分) D、E、F(3分,全对给分)
4.(每空2分,共20分)(1)圆底烧瓶 分液漏斗
(2)b接e,f接d,c接a。
(3)CuSO4
(4)吸收氯气
(5)①③(填装置序号);湿润的红布条或淀粉碘化钾试纸
(6)紫色石蕊试液,紫色石蕊试液变红而不褪色
5.(15分)
(1) B A E或B A C(3分)
(2)先加热催化剂再滴入浓硫酸 (3分)
(3)SO2 + 2HClO3 = H2SO4 + 2ClO2(3分)
(4) %(或者% 3分
(5)偏低 3分
相关文档
- 2012届高考化学二轮专题复习:实验专2021-07-066页
- 高考化学二轮专题复习第二编专题六2021-07-0632页
- 2012届高考化学二轮专题复习:实验专2021-07-056页
- 2018届高考化学二轮专题复习微观结2021-07-033页
- 2012届高考化学二轮专题复习:实验专2021-07-025页
- 2012届高考化学二轮专题复习:实验专2021-07-025页
- 2012届高考化学二轮专题复习:实验专2021-07-026页
- 高考化学二轮专题复习资料汇总题型2021-05-1426页
- 高考化学二轮专题复习精选——电化2021-05-138页
- 高考化学二轮专题复习选考模块化学2021-05-1314页