- 912.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012届高考化学二轮专题复习:实验专题训练(十一)
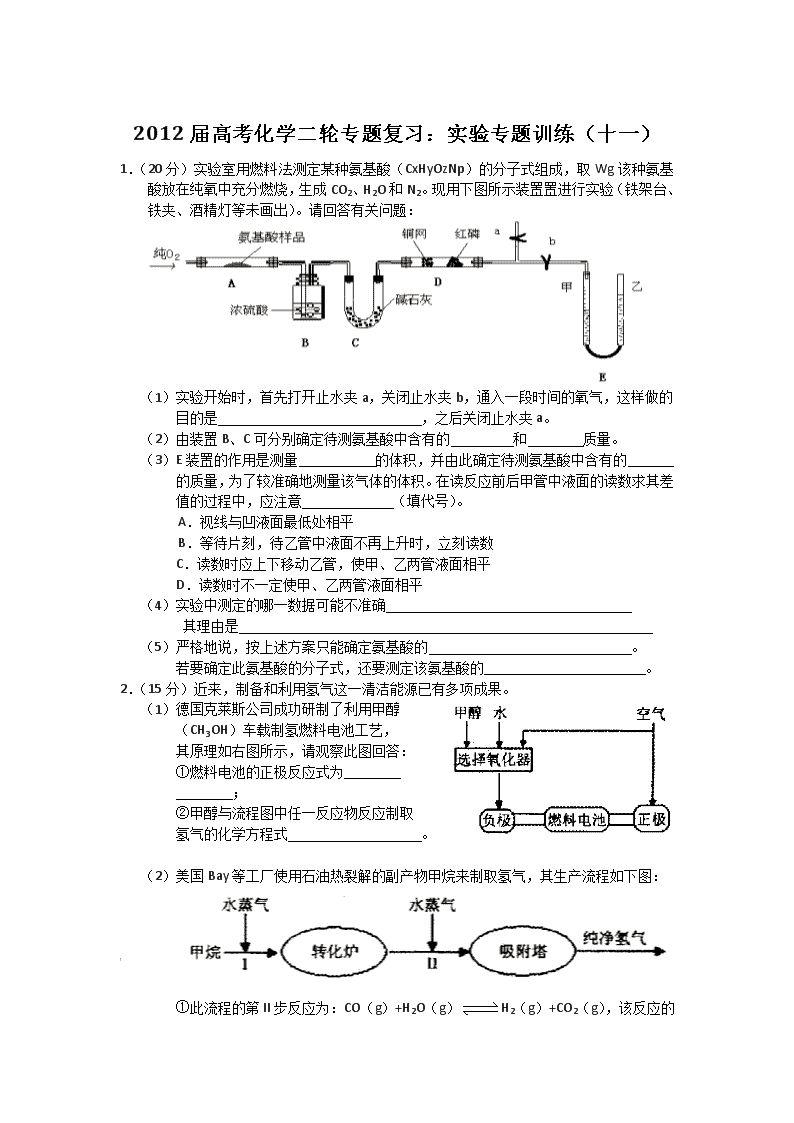
1.(20分)实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出)。请回答有关问题:
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的
目的是 ,之后关闭止水夹a。
(2)由装置B、C可分别确定待测氨基酸中含有的 和 质量。
(3)E装置的作用是测量 的体积,并由此确定待测氨基酸中含有的
的质量,为了较准确地测量该气体的体积。在读反应前后甲管中液面的读数求其差值的过程中,应注意 (填代号)。
A.视线与凹液面最低处相平
B.等待片刻,待乙管中液面不再上升时,立刻读数
C.读数时应上下移动乙管,使甲、乙两管液面相平
D.读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确
其理由是
(5)严格地说,按上述方案只能确定氨基酸的 。
若要确定此氨基酸的分子式,还要测定该氨基酸的 。
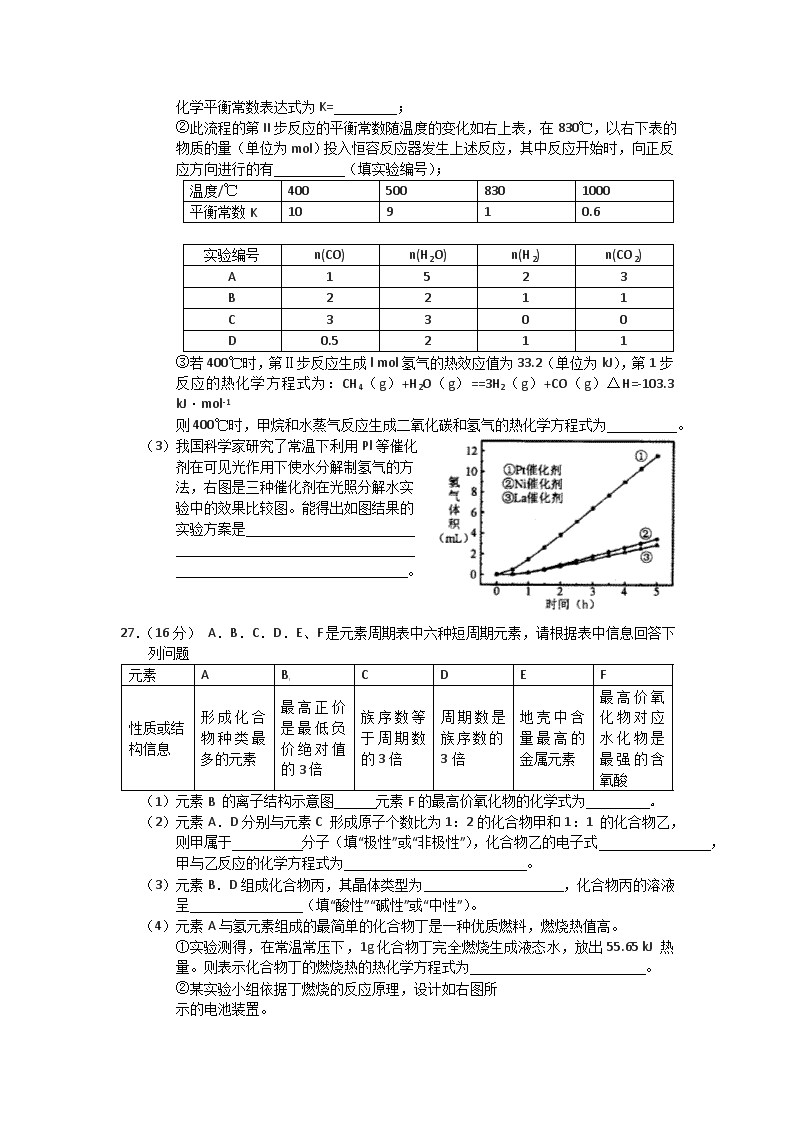
2.(15分)近来,制备和利用氢气这一清洁能源已有多项成果。
(1)德国克莱斯公司成功研制了利用甲醇
(CH3OH)车载制氢燃料电池工艺,
其原理如右图所示,请观察此图回答:
①燃料电池的正极反应式为
;
②甲醇与流程图中任一反应物反应制取
氢气的化学方程式 。
(2)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
[
①此流程的第II步反应为:CO(g)+H2O(g)H2(g)+CO2
(g),该反应的化学平衡常数表达式为K= ;
②此流程的第II步反应的平衡常数随温度的变化如右上表,在830℃,以右下表的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有 (填实验编号);
温度/℃
400
500
830
1000
平衡常数K
10
9
1
0.6
实验编号
n(CO)
n(H2O)
n(H2)
n(CO2)
A
1
5
2
3
B
2
2
1
1
C
3
3
0
0
D
0.5
2
1
1
③若400℃时,第Ⅱ步反应生成l mol氢气的热效应值为33.2(单位为kJ),第1步反应的热化学方程式为:CH4(g)+H2O(g)==3H2(g)+CO(g)△H=-103.3 kJ·mol-1
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
(3)我国科学家研究了常温下利用Pl等催化
剂在可见光作用下使水分解制氢气的方
法,右图是三种催化剂在光照分解水实
验中的效果比较图。能得出如图结果的
实验方案是
。
27.(16分) A.B.C.D.E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
元素
A
B[
C
D
E
F
性质或结
构信息
形成化合物种类最多的元素
最高正价是最低负价绝对值的3倍
族序数等于周期数的3倍
周期数是族序数的3倍
地壳中含量最高的金属元素
最高价氧化物对应水化物是最强的含氧酸
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为 。
(2)元素A.D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于 分子(填“极性”或“非极性”),化合物乙的电子式 ,甲与乙反应的化学方程式为 。
(3)元素B.D组成化合物丙,其晶体类型为 ,化合物丙的溶液呈 (填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为 。
②某实验小组依据丁燃烧的反应原理,设计如右图所
示的电池装置。
A
KOH溶液
O2
导管
惰性电极
惰性电极
a.该电池正极的电极反应为 。
b.工作一段时间后,测得溶液的pH减小,该电池总
反应的离子方程式为 。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式: 。若E的氯化物熔沸点较低、易升华,则E的氯化物是 化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择 。
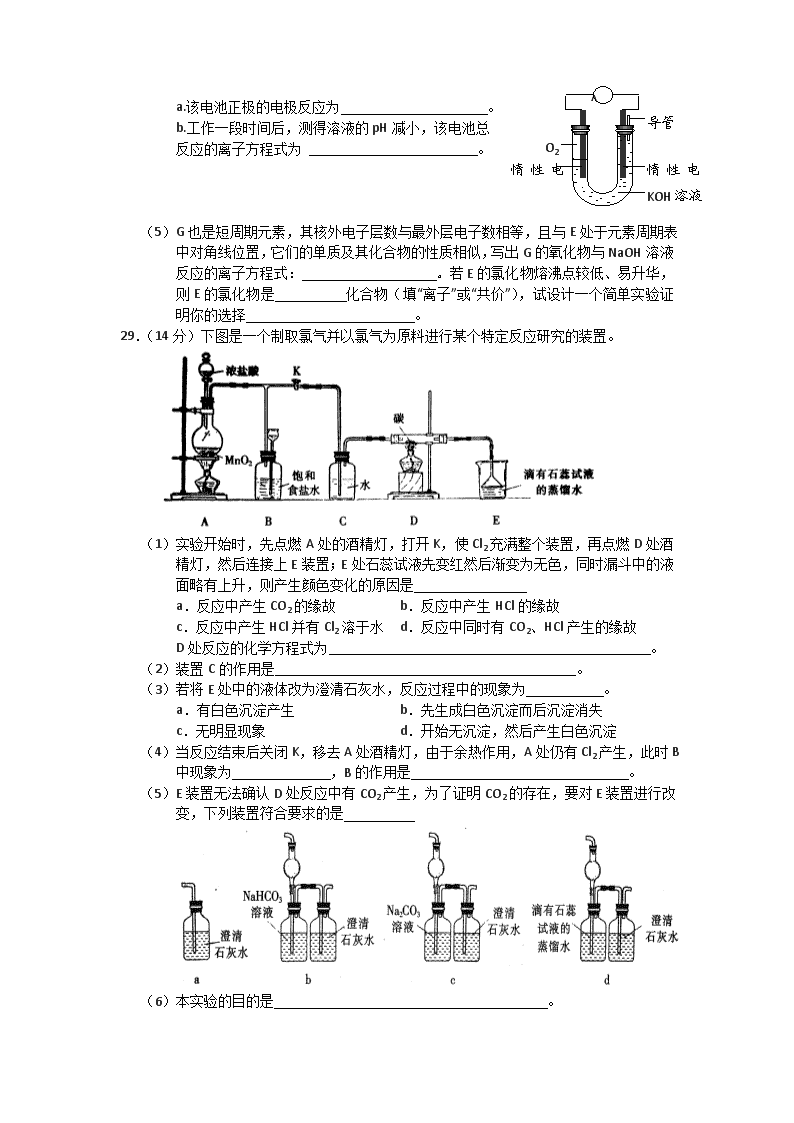
29.(14分)下图是一个制取氯气并以氯气为原料进行某个特定反应研究的装置。
(1)实验开始时,先点燃A处的酒精灯,打开K,使Cl2充满整个装置,再点燃D处酒精灯,然后连接上E装置;E处石蕊试液先变红然后渐变为无色,同时漏斗中的液面略有上升,则产生颜色变化的原因是
a.反应中产生CO2的缘故 b.反应中产生HCl的缘故
c.反应中产生HCl并有Cl2溶于水 d.反应中同时有CO2、HCl产生的缘故
D处反应的化学方程式为 。
(2)装置C的作用是 。
(3)若将E处中的液体改为澄清石灰水,反应过程中的现象为 。
a.有白色沉淀产生 b.先生成白色沉淀而后沉淀消失
c.无明显现象 d.开始无沉淀,然后产生白色沉淀
(4)当反应结束后关闭K,移去A处酒精灯,由于余热作用,A处仍有Cl2产生,此时B中现象为 ,B的作用是 。
(5)E装置无法确认D处反应中有CO2产生,为了证明CO2的存在,要对E装置进行改变,下列装置符合要求的是
(6)本实验的目的是 。
5.(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
A.50mL烧杯 B.50mL量筒
C.25mL碱式滴定管 D.25mL酸式滴定管
(2)洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是_________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
参考答案
1.(1)排净装置中的N2
(2)H元素;C元素
(3)N2;N元素; ac
(4)N2的体积; 多余的O2在D中没有被吸收完全
(5)最简式; 相对分子质量
2.(15分)
(1)①O2+2H2O+4e+=4OH-(2分)
②CH3OH+H2O=CO2+3H2或2CH3OH+O2=2CO2+4H2
或2CH3OH+H2O=CO2+CO+5H2或4CH3OH—O2=2CO2+2CO+8H2
[其他合理答案参照给分,3分]
(2)① (2分)
②BC(2分)
③CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=—136.5kJ·mol-1(3分)
(3)控制其它条件不变,(1分)
每小时测定一次不同催化剂分解水产生氢气的体积(1分),
记录数据,作图分析(1分)。(共3分)
2
8
8
+16
3.(16分)
(1) (1分) Cl2O7 (1分)
(2)非极性 Na+ Na+ ,2CO2 + 2Na2O2 = 2Na2CO3 +O2 (各1分,3分)
(3)离子晶体 ,碱性(各1分)
(4)① CH4(g) + 2O2 (g) = CO2(g) + 2H2O(l) ;ΔH=890.4KJ/mol (2分)
②A.O2 + 2H2O + 4e- = 4OH- (1分)B.CH4 + 2O2 + 2OH- = CO32- + 3H2O (1分)
(5) BeO + 2OH- = BeO22- + H2O (2分)共价 (1分)
将其加热到熔融状态,做导电性实验,看其能否导电 (2分)
===
△
4.(14分)
(1)c (2分) 2Cl2+C+2H2O CO2+ 4HCl (2分)
(2)提供水蒸汽(2分) (3)c(2分)
(4)B中液体被压入长颈漏斗中(1分),储存多余氯气,防止污染(1分)。
(5)d(2分)
(6)探究潮湿的氯气与碳在加热条件下的反应(探究Cl2和C.H2O特定反应及产物的实验)(2分其他合理也给分)
5.(每空2分,共14分)
(1)250mL容量瓶.胶头滴管;D (2)NH+4、Cl-、OH-
(3)取少量最后一次洗涤液于试管中,滴加硝酸酸化的AgNO3溶液,若无沉淀生成,则 证明原沉淀洗涤干净。(合理的答案均可得分)
(4)再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1g为止。
(5)
(6)4Fe(OH)2+2H2O+O2=4Fe(OH)3
相关文档
- 2012届高考化学二轮专题复习:实验专2021-07-095页
- 高考化学二轮专题复习综合训练一基2021-07-097页
- 2019届高考化学二轮专题复习专题九2021-07-0826页
- 高考化学二轮专题复习第二编专题八2021-07-0827页
- 2018届高考化学二轮专题复习课件:专2021-07-0843页
- 高考化学二轮专题复习第一编专题五2021-07-0734页
- 2012届高考化学二轮专题复习:实验专2021-07-074页
- 2012届高考化学二轮专题复习:实验专2021-07-065页
- 2012届高考化学二轮专题复习:实验专2021-07-066页
- 高考化学二轮专题复习第二编专题六2021-07-0632页