- 526.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
4-1 原电池
【学习目标】
1.以铜锌原电池为例,熟悉原电池的工作原理
2.会正确判断原电池的正极和负极
3.学会原电池电极反应式的书写方法
【学习重难点】
学习重点:原电池的工作原理及电极反应式的书写。
学习难点:原电池的工作原理及电极反应式的书写。
【自主预习】
一.1.氧化还原反应的本质是
2. 原电池是将 转化为 的装置。其本质是 原理的应用。
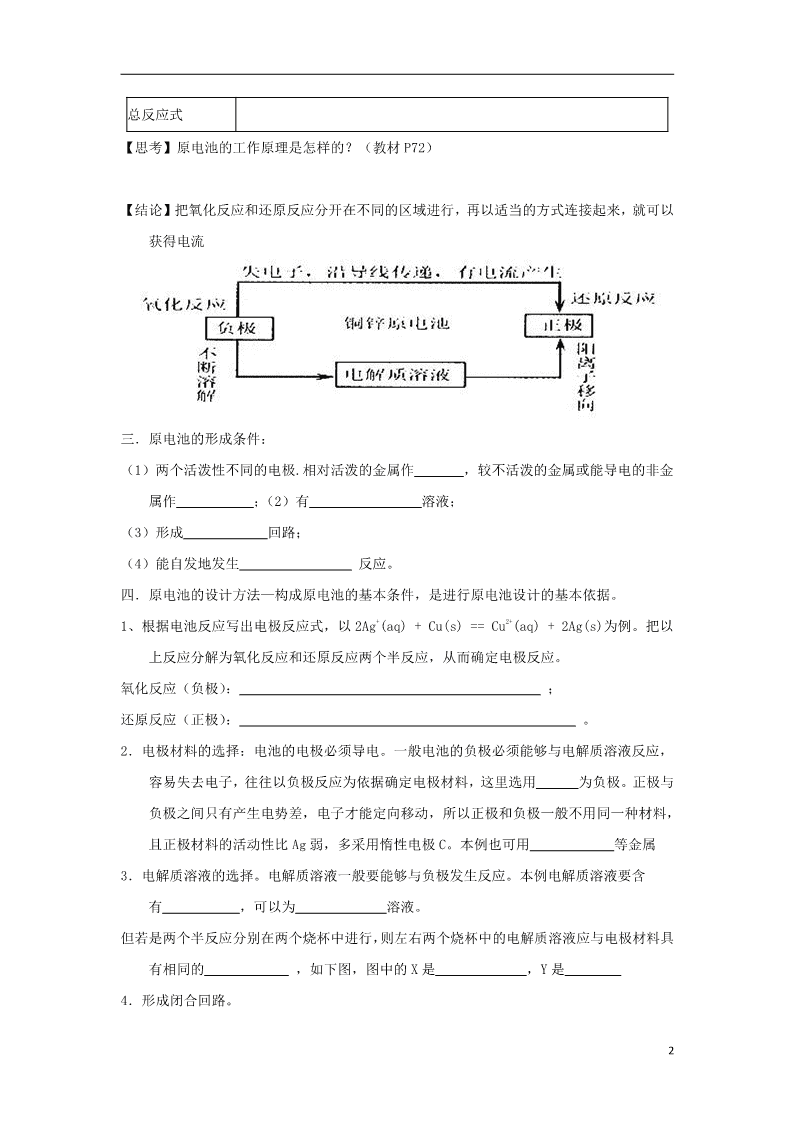
二.原电池工作原理:
1.知识回顾—以 Cu-Zn-硫酸铜原电池为例,如右图
锌片: 极,_________ 电子,发生________ 反应。
铜片: 极,_________ 电子,发生________ 反应。
外电路:电子从 极流入 极
内电路:________向负极移动,______ 向正极移动
思考:如果用以上装置作电源,能持续稳定地产生电流吗?怎样进行改进?
2.探究活动—有盐桥的原电池的工作原理:阅读课本 P71 页有关【实验 4-1】的论述,结合
图 4-1,和上述“题 1”的 Cu-Zn 原电池装置对照,实验装置有何变化
_____________________
根据实验,填写下表:
电极 Zn 电极 Cu 电极
现 象
得失电子
电极名称
电子流向
反应类型
电极反应式
2
总反应式
【思考】原电池的工作原理是怎样的?(教材 P72)
【结论】把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以
获得电流
三.原电池的形成条件:
(1)两个活泼性不同的电极.相对活泼的金属作 ,较不活泼的金属或能导电的非金
属作 ;(2)有 溶液;
(3)形成 回路;
(4)能自发地发生 反应。
四.原电池的设计方法—构成原电池的基本条件,是进行原电池设计的基本依据。
1、根据电池反应写出电极反应式,以 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)为例。把以
上反应分解为氧化反应和还原反应两个半反应,从而确定电极反应。
氧化反应(负极): ;
还原反应(正极): 。
2.电极材料的选择:电池的电极必须导电。一般电池的负极必须能够与电解质溶液反应,
容易失去电子,往往以负极反应为依据确定电极材料,这里选用 为负极。正极与
负极之间只有产生电势差,电子才能定向移动,所以正极和负极一般不用同一种材料,
且正极材料的活动性比 Ag 弱,多采用惰性电极 C。本例也可用 等金属
3.电解质溶液的选择。电解质溶液一般要能够与负极发生反应。本例电解质溶液要含
有 ,可以为 溶液。
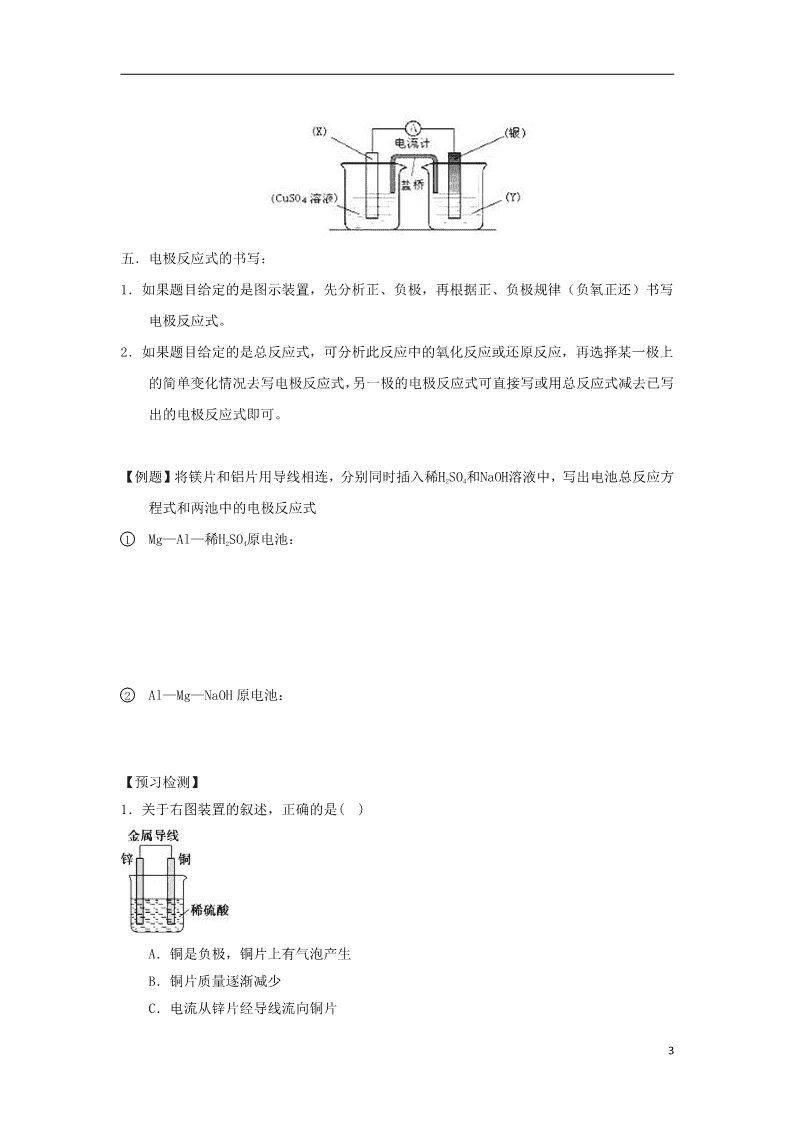
但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具
有相同的 ,如下图,图中的 X 是 ,Y 是
4.形成闭合回路。
3
五.电极反应式的书写:
1.如果题目给定的是图示装置,先分析正、负极,再根据正、负极规律(负氧正还)书写
电极反应式。
2.如果题目给定的是总反应式,可分析此反应中的氧化反应或还原反应,再选择某一极上
的简单变化情况去写电极反应式,另一极的电极反应式可直接写或用总反应式减去已写
出的电极反应式即可。
【例题】将镁片和铝片用导线相连,分别同时插入稀H2SO4和NaOH溶液中,写出电池总反应方
程式和两池中的电极反应式
1 Mg—Al—稀H2SO4原电池:
2 Al—Mg—NaOH 原电池:
【预习检测】
1.关于右图装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
4
D.氢离子在铜片表面被还原后生成 H2
2.关于原电池、电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
合作探究
探究活动一:原电池的工作原理
1.按右图所示装置,完成实验并回答下列问题:
(1)有关的实验现象是①锌片 ,铜片 ,CuSO4 溶液颜色 。②检流计的指
针 ,该装置中的能量变化是 。
(2)电子流动方向和电流方向
①外电路:电子由 电极经过导线流向铜电极,电流由铜电极流向 电极。
②内电路:电流由 电极流向 电极。
(3)电极反应:负极反应式是 ;正极反应式
是 ;
总反应式是 。
(4)用温度计测量溶液的温度,其变化是 ,原因是还
有 。
2.按下图所示装置,完成实验,并回答下列问题:
(1) 实验过程中,你能观察到的实验现象是
。
(2)用温度计测量溶液的温度,其结果是 ,由此可说
明 。
(3)离子移动方向
①硫酸锌溶液中: 向盐桥移动;
5
②硫酸铜溶液中: 向铜极移动;
③盐桥中:K+移向 区(CuSO4 溶液),Cl-移向 区(ZnSO4 溶液)。
(4)若取出装置中的盐桥,检流计的指针是否还会发生偏转?为什么?
3.实验结论:与问题 1 中的原电池装置相比较,问题 2 中双液原电池具有的特点是
(1)具有盐桥。取下盐桥, 。
(2)两个半电池完全隔开,Cu2+无法移向锌片,可以获
得 。
[归纳总结]
1.原电池原理是把 进行,还原剂在 极上失去电子发生 反应,
电子通过导线流向正极,氧化剂在 极上得到电子发生 反应。
2.原电池电极及电极反应特点
(1) 为电子流出极,相对活泼,通常是活动性 的金属或某些还原剂,电极被 ,
发生 。
(2) 为电子流入极,相对不活泼,通常是活动性 的金属或非金属导体,一般是电
解质溶液中的氧化性强的离子被还原或电极上附着物本身被 ,发生 。
3.原电池的设计
从理论上讲,任何一个自发的氧化还原反应都可以设计成原电池。关键是选择合适的电解质
溶液和两个电极。
(1)电解质溶液:一般能与 反应,或者溶解在溶液中的物质(如 O2)与 反应。
(2)电极材料:一般较活泼的金属作 ,较不活泼的金属或非金属导体作 。
【学以致用】
1.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正
确的是( )
A.由 Al、Cu、稀硫酸组成原电池,其负极反应式为:Al-3e-===Al3+
B.由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-===[Al(OH)4]-
C.由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
D.由 Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-===Cu2+
2.利用反应 Cu+2FeCl3===CuCl2+2FeCl2 设计一个原电池,正极为______,电极反应式为
________________________________________________________________________;
负极为________,电极反应式为_____________________________________________;电解
质溶液是______________。
探究活动二:原电池的电极判断及电极反应式的书写
1.原电池电极(正极、负极)的判断依据有多种。试填写下表:
判断依据 正极 负极
6
电极材料
电子流向
电极反应
电极现象
2.写出下表中原电池装置的电极反应和总的化学反应方程式:
负极材料 正极材料 电解质溶液
(1) 铁 铜 稀硫酸
(2) 铜 银 硝酸银
(1)正极反应_________________________________________________________;
负极反应_________________________________________________________;
总反应方程式_________________________________________________________。
(2)正极反应___________________________________________________________;
负极反应__________________________________________________________;
总反应方程式________________________________________________________。
3.有一纽扣电池,其电极分别为 Zn 和 Ag2O,以 KOH 溶液为电解质溶液,电池的总反应为
Zn+Ag2O+H2O===2Ag+Zn(OH)2。
(1)Zn 发生 反应,是 极,电极反应式是 。
(2)Ag2O 发生 反应,是 极,电极反应式
是 。
[归纳总结]
1.一般电极反应式的书写方法
(1)定电极,标得失。按照负极发生氧化反应,正极发生还原反应,判断出电极反应产物,
找出得失电子的数量。
(2)看环境,配守恒。电极产物在电解质溶液的环境中,应能稳定存在,如碱性介质中生
成的 H+应让其结合 OH-生成水。电极反应式要依据电荷守恒和质量守恒、得失电子守恒
等加以配平。
(3)两式加,验总式。两电极反应式相加,与总反应方程式对照验证。
2.已知电池总反应式,书写电极反应式
(1)分析化合价,确定正极、负极的反应物与产物。
(2)在电极反应式的左边写出得失电子数,使得失电子守恒。
(3)根据质量守恒配平电极反应式。
(4)=-
【学以致用】
3.如图所示,烧杯内盛有浓 HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电
7
池停止工作时,Fe、Pb 都有剩余。下列有关说法正确的是( )
A.Fe 比 Pb 活泼,始终作负极
B.Fe 在浓 HNO3 中钝化,始终不会溶解
C.电池停止工作时,烧杯中生成了 Fe(NO3)3
D.利用浓 HNO3 作电解质溶液不符合“绿色化学”思想
【学习小结】
【巩固练习】
1.锌铜原电池(如图)工作时,下列叙述正确的是( )
A.正极反应为 Zn-2e-===Zn2+
B.电池反应为 Zn+Cu2+===Zn2++Cu
C.在外电路中,电流从负极流向正极
D.盐桥中的 K+移向 ZnSO4 溶液
2.关于原电池的叙述中正确的是( )
A.构成原电池的两极必须是两种不同金属
B.原电池是将化学能转化为电能的装置
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
3.若某装置发生如下反应:Cu+2H+===Cu2++H2↑,关于该装置的有关说法正确的是( )
8
A.该装置一定为原电池
B.该装置为电解池
C.若为原电池,Cu 为正极
D.电解质溶液可能是硝酸溶液
4.如图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,记录如下:
①Zn 为正极,Cu 为负极 ②H+向负极移动 ③电子流动方向为 Zn―→Cu ④Cu 极有 H2 产生 ⑤
若有 1 mol 电子流过导线,则产生的 H2 为 0.5 mol ⑥正极反应式:Zn-2e-===Zn2+
则上述描述合理的是( )
A.①②③ B.③④⑤
C.①⑤⑥ D.②③④
5. (1)将 Al 片和 Cu 片用导线相连,插入稀 H2SO4 中组成原电池,写出电极名称及电极反
应式:
Al 片( )_________________________________________________________________,
Cu 片( )__________________________________________________________。
(2)若将 Al 片和 Cu 片用导线相连,插入浓 HNO3 中能否组成原电池?________(填“能”
或“不能”),若能组成原电池,写出电极名称及电极反应式:(若不能,此问不用作答)
Al 片( )_________________________________________________________________,
Cu 片( )_________________________________________________________________。
【总结与反思】
通过自评、互评、师评相结合对本节学习过程进行反思感悟。
9
【参考答案】
【自主预习】
一.1.反应物之间电子的转移;2.将化学能转化为电能能的装置;氧化还原反应
二.1.锌与 CuSO4 溶液发生置换反应,溶液中的 Cu2+在锌片表面被直接还原,析出的铜在锌
片表面构成原电池,逐渐使向外输出的电流强度减弱直至无电流再产生。
2.
电极 Zn 电极 Cu 电极
现象 锌片逐渐溶解 铜片上有红色铜沉积
得失电子 失电子 得电子
电极名称 负极 正极
电子流向 流出 流入
反应类型 氧化反应 还原反应
电极反应式 Zn-2e-===Zn2+ Cu2++2e-===Cu
总反应式 Zn+Cu2+===Cu+Zn2+
三.构成原电池的条件:负极 正极 电解质 闭合氧化还原
负极(Al):2Al-6e-+8OH-=2AlO2
-+4H2O(氧化反应)
正极(Mg):6H2O+6e-=3H2↑+6OH-(还原反应)
电池反应:2Al+2OH-+2H2O=2AlO2
-+3H2
【预习检测】1.D 2.C
【合作探究】
探究活动一:
1.(1) 溶解,加厚变亮,变浅,发生偏转,化学能转化为电能;
(2)锌,锌;锌,铜
(3)Zn-2e-===Zn2+; Cu2++2e-===Cu;Zn+Cu2+===Zn2++Cu。
(4)溶液的温度略有升高,部分 Cu2+直接在锌电极上得电子被还原,部分化学能转化成热
10
能。
2.(1)①锌片溶解,铜片加厚变亮;②检流计指针发生偏转;③CuSO4 溶液的颜色变浅。
(2)溶液的温度不升高(或无变化), CuSO4 溶液中的 Cu2+不能移向锌片得电子被还原。
(3)①Zn2+;②Cu2+;③正极,负极
(4) 不偏转。如果要使检流计指针发生偏转,则该装置中必须形成闭合回路,若取出盐桥,
很显然该装置未构成闭合回路,检流计指针不会发生偏转。
3. (1)无法形成闭合回路,反应不能进行,可控制原电池反应的进行。
(2)单纯的电极反应,有利于最大程度地将化学能转化为电能。
[归纳总结]
1.把氧化反应和还原反应分开,负,氧化,正还原。
2. (1)负极,较强,氧化,氧化反应。
(2)正极,较差,还原,还原反应。
3. (1)负极,负极 (2)负极,正极。
【学以致用】1. C 2.Pt(或 C) 2Fe3++2e-===2Fe2+ Cu Cu-2e-===Cu2+ FeCl3 溶液
探究活动二
1.
判断依据 正极 负极
电极材料 不活泼金属或非金属导体 活泼金属
电子流向 电子流入 电子流出
电极反应 还原反应 氧化反应
电极现象 电极增重或产生气体 电极减轻
2. (1)2H++2e-===H2↑ Fe-2e-===Fe2+
Fe+H2SO4===FeSO4+H2↑
(2)2Ag++2e-===2Ag Cu-2e-===Cu2+
Cu+2AgNO3===Cu(NO3)2+2Ag
3.(1)氧化,负,Zn-2e-===Zn2+。
(2)还原,正,Ag2O+2e-+H2O===2Ag+2OH-。
【学以致用】
3.D
【巩固练习】
1. B 2. B 3. B 4.B
5.(1)负极 2Al-6e-===2Al3+(或 Al-3e-===Al3+) 正极 6H++6e-===3H2↑(或 2H++2e-
===H2↑)
11
(2)能 正极 2NO
-
3 +4H++2e-===2NO2↑+2H2O
负极 Cu-2e-===Cu2+
相关文档
- 山东省菏泽市2019-2020学年高一下2021-08-067页
- 【化学】广东省湛江市第二十一中学2021-08-066页
- 化学卷·2019届江西省鄱阳县第二中2021-08-067页
- 【化学】山西省运城市景胜中学20192021-08-0617页
- 2017-2018学年重庆市第一中学高二2021-08-0619页
- 云南省新平县三中2019-2020学年高2021-08-069页
- 2019-2020学年天津市第一中学高二2021-08-067页
- 【化学】贵州省思南中学2019-20202021-08-068页
- 2017-2018学年辽宁省六校协作体高2021-08-0620页
- 2017-2018学年贵州省遵义市第四中2021-08-068页