- 1.88 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
模块
5
选考模块
第十一单元 物质结构与性质
(
选考
)
第
1
节
原子结构与性质
考纲点击:
1.
了解原子核外电子的运动状态、能级分布和
排布原理,能正确书写
1
~
36
号元素原子核外电子、价电子的
电子排布式和轨道表达式。
2.
了解电离能的含义,并能用以说
明元素的某些性质。
3.
了解电子在原子轨道之间的跃迁及其简
单应用。
4.
了解电负性的概念,并能用以说明元素的某些性质。
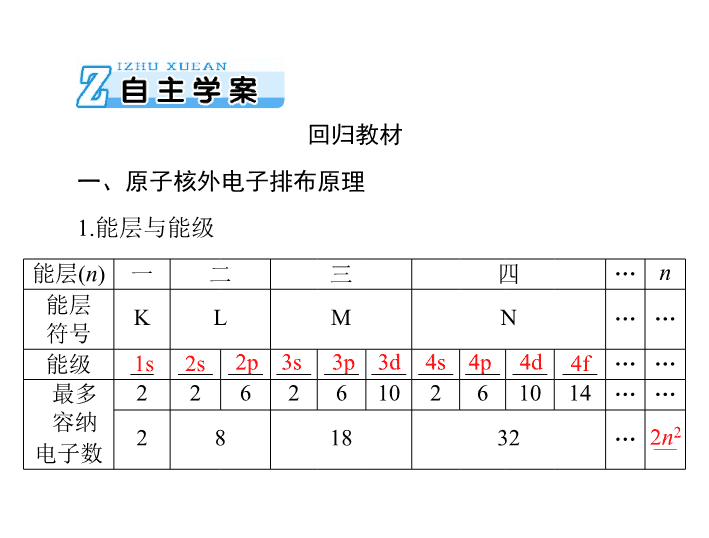
能层
(
n
)
一
二
三
四
…
n
能层
符号
K
L
M
N
…
…
能级
__
___
___
___
___
___
___
___
___
___
…
…
最多
容纳
电子数
2
2
6
2
6
10
2
6
10
14
…
…
2
8
18
32
…
__
回归教材
一、原子核外电子排布原理
1.
能层与能级
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
2
n
2
能级
n
s
n
p
n
d
n
f
…
原子轨道数
____
____
____
____
…
2.
原子轨道
球形
哑铃形
(1)
轨道形状
①
s
电子的原子轨道呈
________
。
②
p
电子的原子轨道呈
__________
。
(2)
各能级上的原子轨道数目
1
3
5
7
(3)
能量关系
①相同能层上原子轨道能量的高低:
n
s<
n
p<
n
d<
n
f
…
②
形状相同的原子轨道能量的高低:
1s<2s<3s<4s
…
③
同一能层内形状相同而伸展方向不
同的原子轨道的能量
相等,如
n
p
x
、
n
p
y
、
n
p
z
轨道的能量
______
。
相等
[
特别提醒
]
(1)
第一能层
(K)
,只有
s
能级;第二能层
(L)
,有
s
、
p
两种能级,
p
能级上有三个原子轨道
p
x
、
p
y
、
p
z
,它们具有
相同的能量;第三能层
(M)
,有
s
、
p
、
d
三种能级。
(2)
能层数=电子层数,每个能层所包含
的能级数=能层序
数。
3.
基态原子核外电子排布依据
(1)
能量最低原理
原子的核外电
子排布遵循构造原理,使整个原子的能量处
于
____________
。
最低状态
如图为构造原理示意图,亦即基态原子核外电子在原子轨
道上的排布顺序图:
(2)
泡利原理
2
相反
1
个原子轨道里最多容纳
____
个电子,且自旋方向
______
。
如
2s
轨道上的电子排布为 ,不能表示为 。
(3)
洪特规则
单独占据一个
全满
半满
电子排布在同一能级的不同轨道时,总是优先
___________
_________
,且自旋方向相同。如
2p
3
的电子排布为
,不
能表示为
或
。洪特规则特例:当能量相同的原子
轨道在
________(p
6
、
d
10
、
f
14
)
、
______(p
3
、
d
5
、
f
7
)
或
______(p
0
、
d
0
、
f
0
)
状态时,体系的能量最低,如基态
24
Cr
的电子排布式为
____________________
。
全空
轨道
1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
4.
基态原子核外电子排布的表示方法
表示方法
举例
电子排布式
S
:
________________
简化电子排布式
[Ne]3s
2
3p
4
电子排布图
(
轨道表达式
)
注意空轨道不能省略
外围
(
价层
)
电子排布式
3s
2
3p
4
1s
2
2s
2
2p
6
3s
2
3p
4
5.
基态原子、激发态原子和原子光谱
(1)
基态原子:处于
________
能量的原子。
(2)
激发态原子:当基态原子的电子
________
能量后,电子
会跃迁到较高能级,变成激发态原子。
(3)
基态、激发态及光谱示意图
最低
吸收
[
特别提醒
]
基态原子失电子生成金属阳离子时,应先失去
最外层上的电子。如
Fe
原子核外电子排布式为
[Ar]3d
6
4s
2
,失
电子变为
Fe
2
+
时,失去的不是能量较高的
3d
轨道上的电子,而
是能量较低的
4s
轨道上的电子。所以
Fe
2
+
的核外电子排布式为
[Ar]3d
6
,其他如
[Ar]3d
4
4s
2
、
[Ar]3d
5
4s
1
均错误。
二、原子结构与元素性质
1.
原子结构与周期表的关系
[Ne]3s
1
18
1s
2
2s
2
2p
6
3s
2
3p
6
[Ar]4s
1
36
周
期
能层
数
每周期第一个元素
每周期最后一个元素
原子
序数
基态原子的简化电子排布式
原子
序数
基态原子的电子排
布式
二
2
3
[He]2s
1
10
1s
2
2s
2
2p
6
三
3
11
________
____
_________________
四
4
19
________
____
_____________________
五
5
37
[Kr]5s
1
54
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
六
6
55
[Xe]6s
1
86
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
4f
14
5s
2
5p
6
5d
10
6s
2
6p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
主族
ⅠA
ⅡA
ⅢA
ⅣA
排布特点
________
________
________
________
主族
ⅤA
ⅥA
ⅦA
—
排布特点
________
________
________
—
n
s
1
n
s
2
n
s
2
n
p
1
n
s
2
n
p
2
n
s
2
n
p
3
n
s
2
n
p
4
n
s
2
n
p
5
2.
每族元素的价电子排布特点
(1)
主族
(2)0
族:
He______
;其他
_________
。
1s
2
n
s
2
n
p
6
(3)
过渡元素
(
副族和第
Ⅷ
族
)
:
(
n
-
1)d
1
~
10
n
s
1
~
2
。
3.
元素周期表的分区与价电子排布的关系
(1)
周期表的分区
(2)
各区元素化学性质及原子最外层电子排布特点
分区
元素分布
外围电子排布
元素性质特点
s
区
ⅠA
、
ⅡA
族
n
s
1
~
2
除氢外都是活泼金属元素,通常是最外层电子参与反应
p
区
ⅢA
族~
ⅦA
族、
0
族
n
s
2
n
p
1
~
6
(He
除外
)
通常是最外层电子参与反应
d
区
ⅢB
族~
ⅦB
族、
Ⅷ
族
(
镧系、锕系除外
)
(
n
-
1)d
1
~
9
n
s
1
~
2
(Pd
除外
)
d
轨道可以不同程度地参与化学键的形成
ds
区
ⅠB
族、
ⅡB
族
(
n
-
1)d
10
n
s
1
~
2
金属元素
f
区
镧系、锕系
(
n
-
2)f
0
~
14
(
n
-
1)d
0
~
2
n
s
2
镧系元素化学性质相近,锕系元素化学性质相近
4.
元素周期律
失去
最低能量
I
1
kJ·mol
-
1
(1)
电离能、电负性
①第一电离能:气态电中性基态原子
________
一个电子转
化为气态基态正离子所需的
____________
。符号:
____
,单位:
____________
。
吸引力
②
电负性:用来描述不同元素的原子对键合电子
_________
的大小。
③判断元素电负性大小的标准。
以氟的电负性为
4.0
和锂的电负性为
1.0
作为相对标准。电
负性没有单位,且均为正值。在元素周期表中氟的电负性数值
最大,铯的电负性数值最小,为
0.7(
放射性元素除外
)
。
项目
同周期
(
从左到右
)
同主族
(
从上到下
)
原子核外
电子排布
能层数
______
,最外
层电子
数
________
最外层电子数
______
,
能层数
________
原子半径
___________(0
族除外
)
__________
元素主要
化合价
最高正价由
_____________
(O
、
F
除外
)
,最低负价由
___________
最高正价=
__________
(O
、
F
除外
)
,非金属最
低负价=
____________
④
电负性的变化规律
小于
1.8
大于
1.8
金属元素的电负性一般
__________
,非金属元素的电负性
一般
____________
,而位于非金属三角区边界的“类金属”
(
如
锗、锑等
)
的电负性则在
1.8
左右。
相同
递增
(2)
原子结构与元素性质的递变规律
相同
递增
逐渐减小
逐渐增大
+
1→
+
7
-
4→
-
1
主族序数
主族序数-
8
项目
同周期
(
从左到右
)
同主族
(
从上到下
)
原子得、失电
子能力
得电子能力
________
失电力能力
________
得电力能力
__________
,
失电子
能力
__________
元素的第一
电离能
______________
______________
元素的电负
性
____________
____________
元素金属性、
非金属性
金属性
__________
,
非
金属性
__________
金属性
__________
,
非
金属性
__________
增大的趋势
逐渐减小
逐渐增大
逐渐减小
(
续表
)
逐渐减弱
逐渐增强
逐渐增强
逐渐减弱
逐渐增强
逐渐减弱
逐渐减弱
逐渐增强
(3)
对角线规则
右下方
在元素周期表中,某些主族元素与其
__________
主族元素
的有些性质是相似的。如:
[
特别提醒
]
一个原子的逐级电离能逐渐增大的原因:随着
核外电子的逐个失去,阳离子所
带的正电荷数越来越大,再失
去一个电子需克服的电性吸引力也越来越大,消耗的能量越来
越多。
基础测评
1.
下列电子排布图
所表示的元素原子中,其能量处于最低
)
。
B.
D.
状态的是
(
A.
C.
答案:
D
2.
现有三种元素的基态原子的电子排布式如下:
①1s
2
2s
2
2p
6
3s
2
3p
4
②1s
2
2s
2
2p
6
3s
2
3p
3
③1s
2
2s
2
2p
5
)
。
则下列有关比较中正确的是
(
A.
最高正化合价:③
>②>①
B.
原子半径:③
>②>①
C.
电负性:③
>②>①
D.
第一电离能:③
>②>①
解析:
根据核外电子排布式可知①是
S
,②是
P
,③是
F
。
F
无正价,
A
错误;同周期元素自左向右原子半
径逐渐减小,
同主族元素自上而下原子半径逐渐增大,则原子半径:
②
>①>③
,
B
错误;同周期元素自左向右电负性增大,同主族
元素自上而下电负性减小,则电负性:③
>①>②
,
C
错误;同
周期元素自左向右第一电离能呈增大趋势,但
P
的
3p
轨道电子
处于半充满状态,较稳定,第一电离能大于
S
,则第一电离能:
③
>②>①
,
D
正确。
答案:
D
3.
下列有关元素周期表分区的说法正确的是
(
)
。
A.s
区全部是金属元素
B.p
区全部是非金属元素
C.d
区内元素原子的价电子排布式必为
(
n
-
1)d
1
~
10
n
s
2
D.
除
ds
区外,以最后填入电子的轨道能级符号作为区的符
号
解析:
A
项,
s
区中
H
为非金属元素;
B
项,
p
区左下角的
元素为金属元素;
C
项,
d
区内
Cr
为
3d
5
4s
1
。
答案:
D
4.(1)[2016
年新课标
Ⅰ
卷,
37(1)]
基态
Ge
原子的核外电子
排布式为
[Ar]__________
,有
________
个未成对电子。
(2)[2016
年新课标
Ⅱ
卷,
37(1)]
镍元素基态原子的电子排布
式 为
____________________
,
3d
能 级上的未成对电子数为
________
。
(3)[2015
年新课标
Ⅰ
卷,
37(1)]
处于一定空间运动状态的电
子
在原子核外出现的概率密度分布可用
________
形象化描述。
在基态
14
C
原子中,核外存在
________
对自旋相反的电子。
(4)
下列核外电子排布式表示的是激发态原子的是
______
。
A.1s
1
2s
1
B.1s
2
2s
2
2p
1
C.1s
2
2p
5
3s
1
D.1s
2
2s
2
2p
6
3s
2
答案:
(1)3d
10
4s
2
4p
2
2
(2)1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
4s
2
或
[Ar]3d
8
4s
2
2
(3)
电子云
2
(4)AC
5.(2017
年新课标
Ⅰ
卷节选
)(1)
元素
K
的焰色反应呈紫红
色,其中紫色对应的辐射波长为
________nm(
填标号
)
。
A.404.4
C.589.2
B.553.5
D.670.8
E.766.5
(2)
基态
K
原子中,核外电子占据最高能层的符号是
______
,
占据该能层电子的电子云轮廓图形状为
________
。
解析:
(1)
当对金属钾或其化合物进行灼烧时,焰色反应显
紫红色,可见光的波长范围为
400 nm
~
760 nm
,紫色光波长较
短
(
钾原子中的电子吸收较多能量发生跃迁,但处于较高能级轨
道的电子
不稳定,跃迁到较低能级轨道时放出的能量较多,故
放出的光的波长较短
)
。
(2)
基态钾原子核外有
4
个能层:
K
、
L
、
M
、
N
,能量依次增高,处于
N
层的
1
个电子位于
4s
轨道,
s
电子云轮廓图形状为球形。
答案:
(1)A (2)N
球形
考点一
考向
1
原子核外电子的排布及其表示方法
原子核外电子排布原理
[
典例
1
](2018
年吉林长春模拟
)
如图是
s
能级和
p
能级的原
子轨道图,试回答下列问题:
是
________
。若元素
X
的原子最外层电子排布式为
n
s
n
-
1
n
p
n
+
1
,
(1)s
电子的原子轨道呈
________
形,每个
s
能级有
____
个
原子轨道;
p
电子的原子轨道呈
________
形,每个
p
能级有
____
个原子轨道。
(2)
元素
X
的原子最外层电子排布式为
n
s
n
n
p
n
+
1
,原子中能
量最高的是
_______
电子,其电子云在空间有
________________
的伸展方向;元素
X
的名称是
________
,它的氢化物的电子式
那么
X
的元素符号为
________
,原子的电子排布图为
_________
______________________________________________
。
解析:
(1)s
电子的原子轨道都是呈球形的,每个
s
能级有
1
个原子轨道;
p
电子的原子轨道都是呈哑铃形的,每个
p
能级
有
3
个原子轨道,它们相互垂直,分别以
p
x
、
p
y
、
p
z
表示。
(2)
因为元素
X
的原子最外层电子排布式为
n
s
n
np
n
+
1
,
n
p
轨道上
有电子,说明
n
s
轨道已排满电子,即
n
=
2
,则元素
X
的原子
核外电子排布式为
1s
2
2s
2
2p
3
,
X
是氮元素,其原子中能量最高
的是
2p
电子,其电子云在空间有三个互相垂直的伸展方向;氮
的氢化物是氨气,其电子式是
。当元素
X
的原子最外
n
=
3
,所以
X
元素的原子核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
4
,
X
是硫元素,其原子的电子排布图为
。
层电子排布式为
n
s
n
-
1
n
p
n
+
1
时,根据上述分析,有
n
-
1
=
2
,则
答案:
(1)
球
1
哑铃
3
(2)2p
三个互相垂直
氮
S
[
方法技巧
]
正确理解排布依据
(1)
在书写基态原子的轨道表示式时,常出现以下错误:
①
②
③
④
(
违反能量最低原理
)
(
违反泡利原理
)
(
违反洪特规则
)
(
违反洪特规则
)
(2)
半充满、全充满状态的原子结构稳定
如
n
s
2
、
n
p
3
、
n
p
6
、
n
d
5
、
n
d
10
Cr
:
3d
5
4s
1
Mn
:
3d
5
4s
2
Cu
:
3d
10
4s
1
Zn
:
3d
10
4s
2
Fe
3+
。
(3)
当出现
d
轨道时,虽然电子按
n
s
、
(
n
-
1)d
、
n
p
的顺序
填充,但在书写时,仍把
(
n
-
1)d
放在
n
s
前。
Fe
2+
(4)
基态原子失电子的顺序:以
Fe
为例,
Fe
考向
2
根据电子排布图理解电子能量状态
[
典例
2
]
下列电子
排布图所表示的元素原子中,其能量处于
最低状态的是
________
。
解析:
①不符合能量最低原理;②不符合洪特规则;④不
符合能量最低原理。
答案:
③⑤
[
方法技巧
]
(1)
符合核外电
子排布规律的原子,处于基态状
态,此状态下能量最低。
(2)
违背核外电子排布规律的原子所处的状态能量较高。
考向
3
根据基态原子核外电子排布推断元素
A.
该元素单
质可能是导体
B.
该元素的最高化合价呈+
6
价
C.
该元素能与氢气反应生成气态氢化物
D.
该元素基态原子的价电子排布图为
解析:
由原子最外层电子排布可知,该元素为
Po
,
Po
为金
属单质,具有导电性;最外层电子数为
6
,最高化合价为+
6
价;
位于元素周期表第六周期第
ⅥA
族,金属性较强,在化学反应
中易
失去电子,难以得到电子,不能形成氢化物;该元素基态
原子的价电子排布图正确。
答案:
C
[
方法技巧
]
3
种最外层电
子的排布特征
(1)
最外层有
3
个未成对电子的价层电子排布为
n
s
2
n
p
3
,
1
~
36
号元素中符合该情况的分别为
N
、
P
、
As
。
(2)
最外层有
2
个未成对电子的价层电子排布可能是
n
s
2
n
p
2
或
n
s
2
n
p
4
。短周期元素中符合该情况的分别为
C
、
Si
和
O
、
S
。
(3)
最外层有
1
个未成对电子的价层电子排布可能是
n
s
1
、
n
s
2
n
p
1
、
(
n
-
1)d
5
n
s
1
、
(
n
-
1)d
10
n
s
1
。第四周期中符合该情况的有
K
、
Ga
、
Cr
、
Cu
。
【
拓展演练
】
1.(1)(2018
年新课标
Ⅰ
卷节选
)Li
是
最轻的固体金属,采用
Li
作为负极材料的
电池具有小而轻、能量密度大等优良性能,
得到广泛应用。回答下列问题:
下列
Li
原子电子排布图表示的状态中,能量最低和最高的
分别为
____
、
____(
填标号
)
。
A.
C.
B.
D.
(2)(2018
年新课标
Ⅱ
卷节选
)
基态
Fe
原子价层电子
的
电子
排布图
(
轨道表达式
)
为
__________________
,基态
S
原子电子
占据最高能级的电子云轮廓图为
________
形。
(3)(2018
年新课标
Ⅲ
卷节选
)Zn
原子核外电子排布式为
________________
。
(4)(2018
年江苏卷节选
)Fe
2
+
基态核外电子排布式为
______
__________
。
解析:
(1)
根据核外电子排布规律可知
Li
的基态核外电子排
布式为
1s
2
2s
1
,则
D
中能量最低,选项
C
中有
2
个电子处于
2p
能 级上, 能量最高 。
(2)
基态
Fe
原子的核外电子排布 式 为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
,则其价层电子的电子排布图
(
轨道表达式
)
为
;基态
S
原子的核
外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
4
,则电子占据的最高能级是
3p
,其电子云轮廓图
为哑铃形。
(4)
基态
Fe
的核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
,
基态
Fe
2
+
的核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
。
答案:
(1)D C
(2)
哑铃
(3)1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
或
[Ar]3d
10
4s
2
(4)[Ar]3d
6
或
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
2.(1)(2018
年河北石家庄检测
)
化学作为一门基础自然科
学,在材料
科学、生命科学、能源科学等诸多领域发挥着重要
作用。
②
磁性材料在生活和科学技术中应用广泛。研究表明,若
构成化合物的阳离子有未成对电子,则该化合物具有磁性。下
列物质适合作录音磁带磁粉原料的为
______(
填选项字母
)
。
A.V
2
O
5
B.CrO
2
C.PbO
D.ZnO
(2)(2018
年河南中原名校仿真模拟联考
)
物质的结构决定物
质的性质。某元素位于第
四周期第
Ⅷ
族,其基态原子的未成对
电子数与基态碳原子的未成对电子数相同,则其基态原子的价
层电子排布式为
________
。
解析:
(1)
①
据元素周期表得,铜在周期表中位于第四周期第
Ⅰ
B
族;铜是
29
号元素,故
Cu
3
+
的核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
或
[Ar]3d
8
。
②
+
4
价
Cr
核外有未成对电子,故有磁性。
(2)
元素位于第四周期第
Ⅷ
族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,基态碳原子的电子排布式为
1s
2
2s
2
2p
2
,未成对电子数为
2
,则该元素为
Ni
,其基态原子的价层电子排布式为
3d
8
4s
2
。
答案
:
(1)
①
第四周期第
Ⅰ
B
族
1s
2
2s
2
2p
6
3s
2
3p
6
3d
8
或
[Ar]3d
8
②
B
(2)3d
8
4s
2
考点二
考向
1
原子结构与元素性质
电离能及其应用
)
。
下列关于元素
R
的判断中一定正确的是
(
A.R
的最高正价为+
3
价
B.R
元素位于元素周期表中第
ⅡA
族
C.R
元素的原子最外层共有
4
个电子
D.R
元素基态原子的电子排布式为
1s
2
2s
2
I
1
I
2
I
3
I
4
……
740
1500
7700
10 500
……
解析:
从
R
元素的各级电离能可以看出,
I
2
与
I
3
差别很大,
因此该元素原子最外层有
2
个电子,
C
错误;
R
为第
ⅡA
族元
素,
B
正确;最高正价为+
2
价,
A
错误;可能为
Be
或
Mg
,
D
错误。
答案:
B
[
方法技巧
]
电离能的应用
(1)
判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之越
弱。
(2)
判断元素的化合价
(
I
1
、
I
2
……
表示各级电离能
)
如果某元素的
I
n
+
1
≫
I
n
,则该元素的常见化合价为+
n
。如
钠元素
I
2
≫
I
1
,所以钠元素的常见化合价为+
1
。
(3)
判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐级增大,有一定的规
律性。当电离能的变化出现突变时,电子层数就可能发生变化。
(4)
反映元素原子的核外电子排布特点
同周期元素从左向右,元素的第一电离能并不是逐渐增大
的,当能量相同的原子轨道在全空、半充满或全充满状态时,
第一电离能就会反常的大,如
I
1
(N)>
I
1
(O)
,
I
1
(Mg)>
I
1
(Al)
。
考向
2
电负性及其应用
[
典例
5
](2018
年河北衡水模拟
)
根据信息回答下列问题
:
(1)
如图是部分元素原子的第一电离能
I
1
随原子序数变化的
曲线图
(
其中
12
号至
17
号元素的有关数据缺失
)
。
元素
Al
B
Be
C
Cl
F
Li
电负性
1.5
2.0
1.5
2.5
3.0
4.0
1.0
元素
Mg
N
Na
O
P
S
Si
电负性
3.0
0.9
3.5
2.1
2.5
1.8
①
认真分析图中同周期元素第一电离能的变化规律,推断
Na
~
Ar
元素中,
Al
的第一电离能的大小范围为
__________<
Al<________(
填元素符号
)
。
②
图中第一电离能最小的元素在周期表中的位置是第
______
周期第
______
族。
(2)
已知元素的电负性和元素的化合价一样,也是元素的一
种基本性质。下面给出常见元素的电负性。
已知:两成键元素间电负性差值大于
1.7
时,形成离子键;
两成键元素间电负性差值小于
1.7
时,形成共价键。
①根据表中给出的数据,可推知元素电负性的变化规律是
____________________________________
。
②通过分析电负性值变化规律,确定
Mg
元素电负性值的
最小范围:
____________
。
③判断下列物质是离子化合物还是共价化合物:
A.Li
3
N
B.BeCl
2
C.AlCl
3
D.SiC
Ⅰ.
属于离子化合物的是
____________
;
Ⅱ.
属于共价化合物的是
____________
;
请设计一个实验方案证明上述所得到的结论:
___________
_____________________________________________________
。
解析:
(1)①
由图可以看出,同周期元素中第
ⅠA
族元素的
第一电离能最小,而第
ⅢA
族元素的第一电离能小于第
ⅡA
族
元素的第一电离能,故
Al
的第一电离能:
NaMg>Ca(Ca
的电负性题
目未给出
)
,则
Mg
电负性的最小范围应为
0.9
~
1.5
。③根据已
知条件及表中数值:
Li
3
N
中
Li
、
N
的电负性差值为
2.0
,大于
1.7
,
形成离子键,
Li
3
N
为离子化合物。同理,
BeCl
2
、
AlCl
3
、
SiC
为
共价化合物。共价化合物和离子化合物最大的区别在于熔融状
态下能
否导电。离子化合物在熔融状态下以离子形式存在,可
以导电,但共价化合物在熔融状态下不能导电。
答案:
(1)①Na
Mg ②
五
ⅠA
(2)①
随着原子序数的递增,元素的电负性呈周期性变化
②
0.9
~
1.5
③A
BCD
测定各物质在熔融状态下能否导电,若导电
则为离子化合物,反之则为共价化合物
[
方法技巧
]
电负性的应用
【
拓展演练
】
3.(1)(2018
年新课标
Ⅰ
卷
)Li
+
与
H
-
具有相同的电子构型,
r
(Li
+
)
小于
r
(H
-
)
,原因是
____________________
。
Li
2
O
是离子
晶体,其晶格能可通过下图的
Born-Haber
循环计算得到。
可知,
Li
原子的第一电离能为
________ kJ·mol
-
1
,
O===O
键键能为
______ kJ·mol
-
1
,
Li
2
O
晶格能为
______ kJ·mol
-
1
。
(2)(2018
年新课标
Ⅲ
卷
)
黄铜是人类最早使用的合金之一,
主要由
Zn
和
Cu
组成。第一电离能
I
1
(Zn)________
I
1
(Cu)(
填
“大
于”或“小于”
)
。
原因是
____________________________
。
(3)(2017
年新课标
Ⅱ
卷
)
元素的基态气态原子得到一个电子
形成
气态负一价离子时所放出的能量称作第一电子亲和能
(
E
1
)
。
第二周期部分元素的
E
1
变化趋势如图所示,其中除氮元素外,
其他元素的
E
1
自左而右依次增大的原因是
_________________
_____________________________________________________
;
氮元素的
E
1
呈现异常的原因是
____________________________
____________________________________________
。
解析:
(1)
由于锂的核电荷数较大,原子核对最外层电子的吸引力较大,因此
Li
+
半径小于
H
-
;根据示意图可知
Li
原子的第一电离能是
1040 kJ·mol
-
1
÷2
=
520 kJ·mol
-
1
;
0.5 mol
氧气转化为氧原子时吸热
249 kJ
,所以
O==O
键的键能是
249 kJ·mol
-
1
2
=
498 kJ·mol
-
1
;根据晶格能的定义结合示意图可知
Li
2
O
的晶格能是
2908 kJ·mol
-
1
。
答案:
(1)Li
+
的核
电荷数较大
520
498 2908
(2)
大于
Zn
原子核外电子排布为全满稳定结构,较难失电
子
(3)
同周期元素
随着核电荷数的增大,原子半径逐渐减小,
故结合一个电子释放出的能量依次增大
N
原子的
2p
轨道为半
充满状态,较稳定,故不易再结合一个电子
4.(2018
年广东江门模拟
)
有
A
、
B
、
C
、
D
、
E5
种元素,它
们的核电荷数依次增大,且都小于
20
。其中
A
为非金属元素;
A
和
E
属同一族,它们原子最外层电子排布为
n
s
1
,
B
和
D
也
属同一族,它们原子最外层的
p
能级电子数是
s
能级电子数的
两倍。
C
原子最外层上电子数等于
D
原子最外层上电子数的一
半。
请回答下列问题:
(1)A
是
________
,
B
是
________
,
C
是
________
,
D
是
________
,
E
是
________
。
(2)
由这五种元素组成的一种化合物是
______________(
写
化学式
)
。写出该物质的一种主要用途:
____________________
__________________________________________________
。
(3)
写出
C
元素基态原子的电子排布式:
_______________
_____________________________________________________
。
(4)
用电子排布图表示
D
元素原子的价电子排布:
_________
_______________
。
(5)
元素
B
与
D
的电负性大小关系是
B______D
,
C
与
E
的
第一电离能的大小关系是
C____E
。
(
均
填“
>”“<”
或“=”
)
解析:
A
、
B
、
C
、
D
、
E5
种元素的核电荷数都小于
20
,
A
、
E
同主族且最外层电子排布式为
n
s
1
,故为第
ⅠA
族,而
A
为非
金属元素,则
A
为
H
;
B
、
D
同主族,其原子最外层的
p
能级
电子数是
s
能级电子数的两倍,故其最外层电子排布式为
n
s
2
n
p
4
,为第
ⅥA
族元素,
B
的核电荷数小于
D
,则
B
为
O
,
D
为
S
,
E
为
K
;
C
原子最外层上电子数为
S
原子最外层上电子数
的一半,则
C
为
Al
。同主族元素自上而下电负性逐渐减小,故
B(O)
的电负性大于
D(S)
;
E(K)
的第一电离能小于
Na
,
Na
的第
一电离能小于
C(Al)
,故第一电离能:
C(Al)>E(K)
。
答案:
(1)H O Al
S K(
写元素名称也可
)
(4)
(5)> >
(2)KAl(SO
4
)
2
·12H
2
O
作净水剂
(3)1s
2
2s
2
2p
6
3s
2
3p
1
或
[Ne]3s
2
3p
1
相关文档
- 化学卷·2018届河南省南阳市邓州市2021-08-0637页
- 【40套试卷合集】山西省山西大学附2021-08-0610页
- 上海市曹阳二中2020届高三上学期期2021-08-0619页
- 2017-2018学年辽宁省大连市高二上2021-08-067页
- 2018-2019学年江西省宜丰中学高一2021-08-069页
- 2018-2019学年湖北省部分重点中学2021-08-068页
- 【化学】河北省2020届高三全国Ⅰ卷2021-08-0614页
- 河南省信阳市罗山县2021届高三化学2021-08-0622页
- 陕西省渭南市韩城市司马迁中学20202021-08-068页
- 贵州省黔东南州凯里市第三中学20192021-08-068页