- 55.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
分子的性质
【巩固练习】
一、选择题
1.下列说法中不正确的是 ( )
A、共价化合物中不可能含有离子键
B、有共价键的化合物,不一定是共价化合物
C、离子化合物中可能存在共价键
D、原子以极性键结合的分子,肯定是极性分子
2.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。下列分子属极性分子的是( )
A、 H2O B、 CO2 C、 BCl3 D、 NH3
3.下列含氧酸中,酸性最弱的是 ( )
A.HClO B.HNO2 C.H2SO4 D.HIO4
4.下列物质在水中溶解性最好的是 ( )
A.CO2 B.NH3 C. O2 D.CH4
5.下列物质的沸点最高的是 ( )
A.H2O B.H2S C.H2Se D.HF
6.a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图
为 , b与c形成化合物的电子式为 。下列比较中正确的是( )
A.原子半径:a>c>d>b B.电负性a>b>d>c
C.原子序数:d>a>c>b D.最高价含氧酸的酸性c>d>a
7.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是 ( )
A.氯化硼液态时能导电而固态时不导电 B.硼原子以sp杂化
C.氯化硼遇水蒸气会产生白雾 D.氯化硼分子属极性分子
8.关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
9.下列说法不正确的是 ( )
A.互为手性异构体的分子互为镜像
B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同
4
D.手性异构体性质相同
10.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
11. X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是 ( )
A.② D.②④ C②⑤⑥ D.①②③④
12.下列物质中,含极性键和非极性键且分子有极性的是 ( )
A.乙烯 B.乙醛 C.甲醇 D.三氯甲烷
二、非选择题
1.A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:A_________________;B_________________;C___________________;
(2)BC2是由___________________键组成的___________________(填“极性”或“非极性”)分子。
2.PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构___________________
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体:___________________,
黄绿色固体:___________________
⑶淡黄色固体物质是由___________________分子组成,黄绿色固体物质是由___________________分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是_____________________________________。
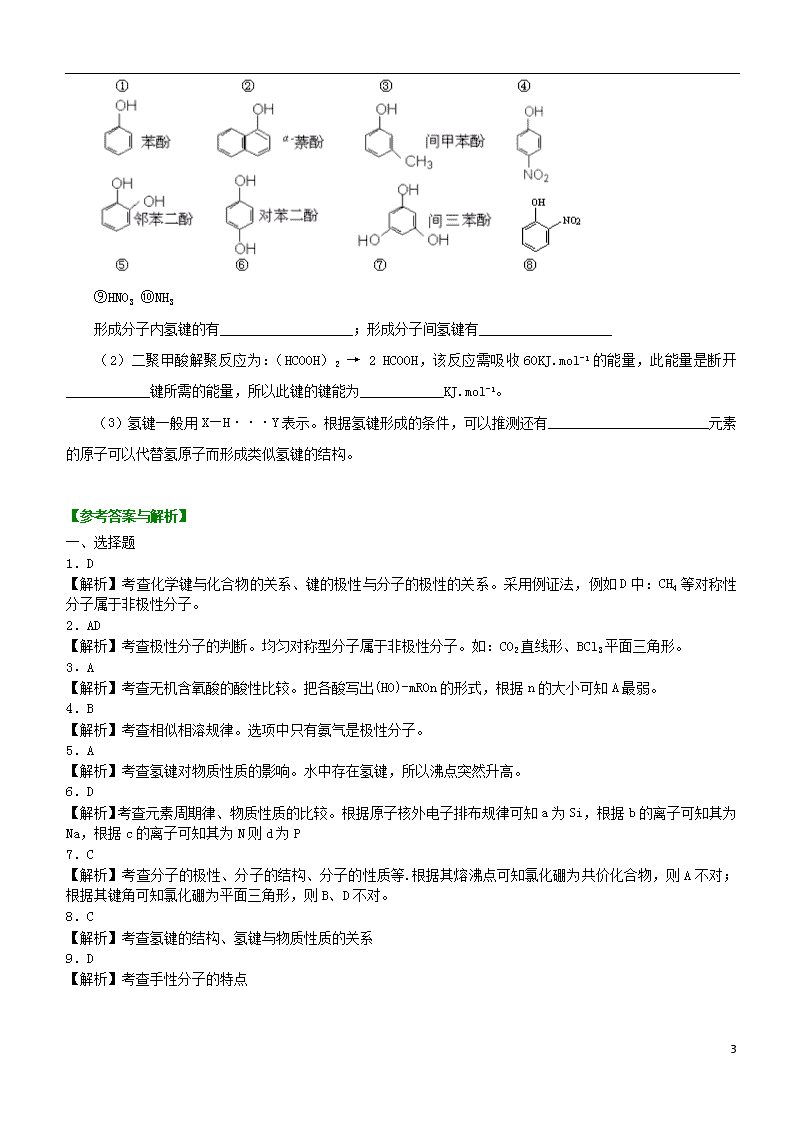
3.(1)下列物质中,哪些形成分子内氢键,哪些形成分子间氢键?(填序号)
4
⑨HNO3 ⑩NH3
形成分子内氢键的有___________________;形成分子间氢键有___________________
(2)二聚甲酸解聚反应为:(HCOOH)2 → 2 HCOOH,该反应需吸收60KJ.mol-1的能量,此能量是断开____________键所需的能量,所以此键的键能为____________KJ.mol-1。
(3)氢键一般用X—H···Y表示。根据氢键形成的条件,可以推测还有_______________________元素的原子可以代替氢原子而形成类似氢键的结构。
【参考答案与解析】
一、选择题
1.D
【解析】考查化学键与化合物的关系、键的极性与分子的极性的关系。采用例证法,例如D中:CH4等对称性分子属于非极性分子。
2.AD
【解析】考查极性分子的判断。均匀对称型分子属于非极性分子。如:CO2直线形、BCl3平面三角形。
3.A
【解析】考查无机含氧酸的酸性比较。把各酸写出(HO)-mROn的形式,根据n的大小可知A最弱。
4.B
【解析】考查相似相溶规律。选项中只有氨气是极性分子。
5.A
【解析】考查氢键对物质性质的影响。水中存在氢键,所以沸点突然升高。
6.D
【解析】考查元素周期律、物质性质的比较。根据原子核外电子排布规律可知a为Si,根据b的离子可知其为Na,根据c的离子可知其为N则d为P
7.C
【解析】考查分子的极性、分子的结构、分子的性质等.根据其熔沸点可知氯化硼为共价化合物,则A不对;根据其键角可知氯化硼为平面三角形,则B、D不对。
8.C
【解析】考查氢键的结构、氢键与物质性质的关系
9.D
【解析】考查手性分子的特点
4
10.B
【解析】考查同分异构体、同位素、极性键等概念的理解。氧化物属于化合物,该氧分子是单质,所以A不对;同位素是同种元素不同原子之间的关系,
所以C不对;同分异构体必须满足分子式相同,所以D不对。
11.D
【解析】考查元素的原子结构、有机物的分子结构等。X、Y、Z分别为H、C、O元素,根据碳的四价键原则来分析各分子式的正误。
12.B
【解析】考查键的极性与分子极性的关系
二、非选择题
1.(1)H C S(2)极性 非极性
【解析】考查利用元素周期律进行元素的推导。元素推导题关键是找突破口。本题中是:K层的电子数目只有一个的元素只有H。
2.⑴ 平面正方形结构
⑵
⑶ 非极性 极性
⑷ 根据相似相溶原理,因为淡黄色固体为非极性分子,较难溶于极性溶剂水;
而黄绿色固体为极性分子,易溶于极性溶剂水。
【解析】考查相似相溶规律、分子极性与空间结构的关系。
3.(1)⑤⑧⑨;①②③④⑥⑦⑩ (2)氢 30 (3)Li
【解析】考查氢键的理解与应用。氢键形成的条件,一是存在X—H强极性键,二是含有Y(N、O、F)电负性强的原子。如果分子内存在这些条件,则可以形成分子内氢键。二聚甲酸分子内存在两个氢键。
4
相关文档
- 高中化学 2_3 分子的性质习题课 新2021-08-065页
- 2020高中化学 分子的性质(提高)知识2021-08-066页
- 高中化学鲁科版选修3课后练习:2-2-22021-08-064页
- 2020版高中化学课时作业6分子的性2021-08-0610页
- 人教版高中化学选修三 2_3分子的性2021-07-0965页
- 2020版高中化学课时作业5分子的性2021-07-098页
- 高二化学2-3 分子的性质 优化训练(2021-07-096页
- 全国通用2021高考化学一轮复习第十2021-07-095页
- 2018届高考一轮复习人教版分子的性2021-07-0821页
- 2020届一轮复习通用版六十五)教材基2021-07-085页