- 78.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
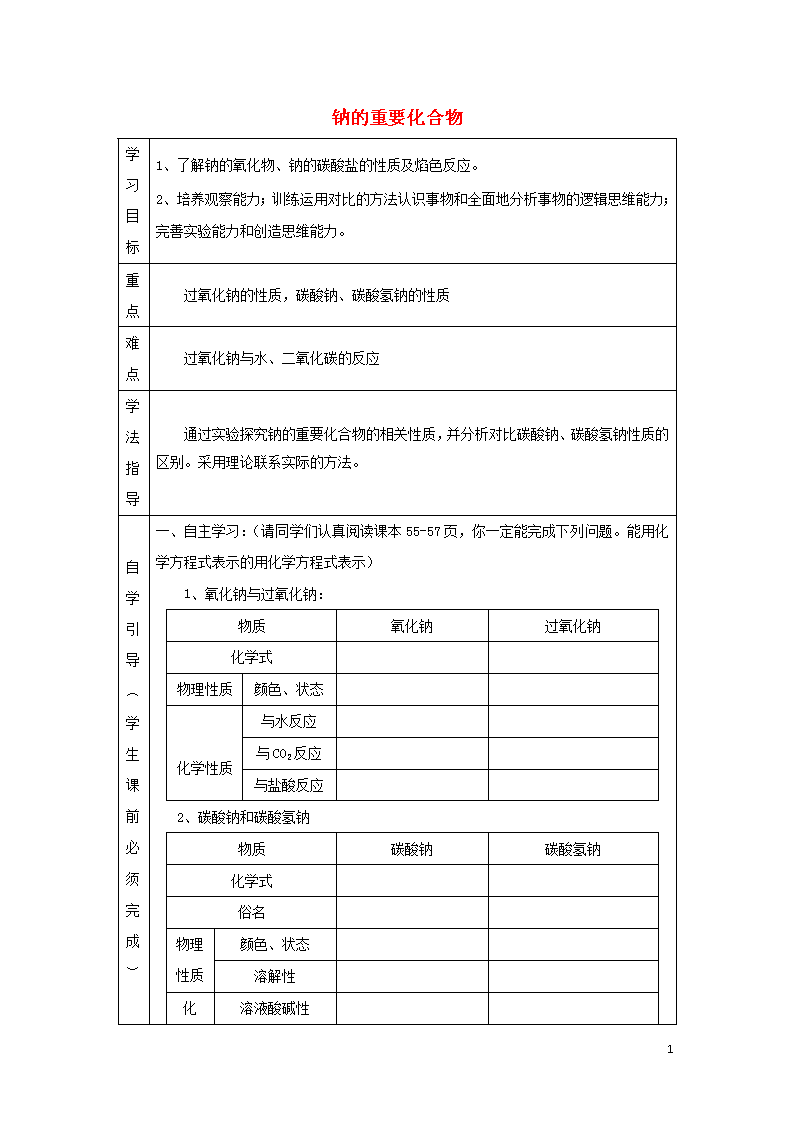
钠的重要化合物
学习目标
1、了解钠的氧化物、钠的碳酸盐的性质及焰色反应。
2、培养观察能力;训练运用对比的方法认识事物和全面地分析事物的逻辑思维能力; 完善实验能力和创造思维能力。
重点
过氧化钠的性质,碳酸钠、碳酸氢钠的性质
难点
过氧化钠与水、二氧化碳的反应
学法指导
通过实验探究钠的重要化合物的相关性质,并分析对比碳酸钠、碳酸氢钠性质的区别。采用理论联系实际的方法。
自学引导︵学生课前必须完成︶
一、自主学习:(请同学们认真阅读课本55-57页,你一定能完成下列问题。能用化学方程式表示的用化学方程式表示)
1、氧化钠与过氧化钠:
物质
氧化钠
过氧化钠
化学式
物理性质
颜色、状态
化学性质
与水反应
与CO2反应
与盐酸反应
2、碳酸钠和碳酸氢钠
物质
碳酸钠
碳酸氢钠
化学式
俗名
物理性质
颜色、状态
溶解性
化
溶液酸碱性
5
学
性
质
热稳定性
与盐酸反应
与CO2、H2O的反应
与NaOH的反应
相互转化
主要用途
3、 很多 或它们的 在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫 。如钠的焰色: ,钾的焰色:
二、自主练习:(通过自学,相信自己能解决下列问题)
1.下列关于Na2O与Na2O2的说法中,不正确的是
A Na2O2比Na2O稳定 B 均与水反应生成NaOH,因而均是碱性氧化物
C Na2O能被氧化成Na2O2 D 均可与H2O、CO2 反应
2.有关Na2CO3和NaHCO3的性质,下列叙述错误的是( )
A.等质量的Na2CO3和NaHCO3与足量的盐酸反应,在相同的条件下NaHCO3产生的CO2气体体积大
B.同一温度下,与等浓度的盐酸反应时,NaHCO3比Na2CO3剧烈
C.与同种酸反应生成等量的CO2时,所消耗的酸的量相等
D.将石灰水加入到NaHCO3溶液中将会产生沉淀
3.关于焰色反应的说法正确的是
A.焰色反应仅是单质的性质 B.焰色反应仅是化合物的性质
C.焰色反应是元素的性质 D.焰色反应是化学变化
三、你还有哪些不会的问题,请提出来让老师和同学帮你解决
探究思考:
1、 过氧化钠是碱性氧化物吗?怎样区分酸性氧化物和碱性氧化物?过氧化钠在生活中有哪些用途
5
独立思考合作探究
2、(1)如何鉴别Na2CO3、NaHCO3两种固体?如果是溶液,又如何鉴别?
(2)如何除去Na2CO3中混有的NaHCO3?在NaHCO3中混有Na2CO3又如何除去?
(3)把Na2CO3溶液和NaHCO3溶液分别滴入稀盐酸中,会有什么现象?为什么?
3、在进行焰色反应的实验操作时,应注意:将铂丝(或光洁无锈的 )放在酒
精灯(最好用煤气灯) 里灼烧,至与原来的火焰颜色 时为止。用铂
丝蘸取待测溶液,在外焰上灼烧,观察火焰颜色。然后将铂丝(或铁丝)用 洗
净,在外焰上灼烧至 时,再蘸取其它溶液作同样的实验,若要观察钾盐
溶液的焰色,要透过 观察火焰。原因是 。
巩固练习
1.对2Na2O2+2CO2==2Na2CO3+O2下列说法正确的是
A.是氧化还原反应,Na2O2是氧化剂,CO2是还原剂
B.是氧化还原反应,CO2是氧化剂,Na2O2是还原剂
C.不是氧化还原反应,是碱性氧化和酸性氧化物反应
D.是氧化还原反应,Na2O2既是氧化剂,又是还原剂
2.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A.分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B.分别在这两种物质的溶液中加入CaCl2溶液
C.分别在这两种固体中加入同浓度的稀盐酸
D.分别在这两种物质的溶液中加入少量澄清的石灰水
3.下列物质露置在空气中,质量会减轻的是
5
A.NaOH B.Na 2O2 C Na2O D.Na2CO3·10H2O
4.下列说法中不正确的是( )
A.Na2CO3比NaHCO3 易溶于水
B.Na2CO3比NaHCO3稳定
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,生成CO2的物质的
量之比为2︰1
5.把CO2通入NaOH溶液中,开始反应时的离子方程式为 ,若
继续通入CO2至过量,反应的离子方程式
学习体会
5
达标测试
1.要除去CO2中的HCl气体,最好的方法是将混合气体通过 ( )
A. 饱和NaHCO3 B.饱和Na2CO3溶液 C.饱和石灰水 D.氨水
2.Na2O2与足量NaHCO3混合物在密闭容器中充分加热,排除气体物质后冷却,残留的
是 ( )
A. Na2CO3和Na2O2 B.只有Na2CO3
C. Na2CO3和NaOH D. Na2O和NaHCO3
3.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到
原温,下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出 B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减少,有O2放出 D.OH-浓度增大,有O2放出
※4.NaHCO3和NaOH的混合物12.4g加热蒸干以后得到固体10g,则二者的物质
的量之比 ( )
A.大于1:1 B.等于1:1 C.小于1:1 D.等于1:2
5.A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,
A与水的反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应
生成D,D溶液与过量的CO2反应生成E,E加热能变成D。写出A~E的化学
式:A 、B 、C 、D 、E
6.13.7gNa2CO3和NaHCO3的混合物,加热一段时间后,质量变为10.6g,求原混合物中Na2CO3和NaHCO3的物质的量。
5
相关文档
- 2020高中化学 专题 氮气及其氧化物2021-08-063页
- 高中化学第1章化学反应与能量章末2021-08-065页
- 高中化学人教版选修二练习:1_2_1 合2021-08-063页
- 2019-2020学年高中化学课时作业242021-08-0611页
- 2020年高中化学 第03章 水溶液中的2021-08-063页
- 2020版高中化学课时作业9金属晶体2021-08-069页
- 高中化学选修4人教版同步练习及测2021-08-064页
- 2020高中化学 第三章 有机化合物 2021-08-063页
- 人教版高中化学选修三教案2_2 分子2021-08-069页
- 2020高中化学 研究有机化合物的一2021-08-065页