- 1.03 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二单元 化学反应中的热量
一、化学反应中的热量变化
1.化学反应过程中能量转化形式
化学反应中不仅是物质的转变,同时还伴随着能量变化。化学反应中比较常见的是化学能与热能、电能、光能等的互相转化。
2.放热反应和吸热反应
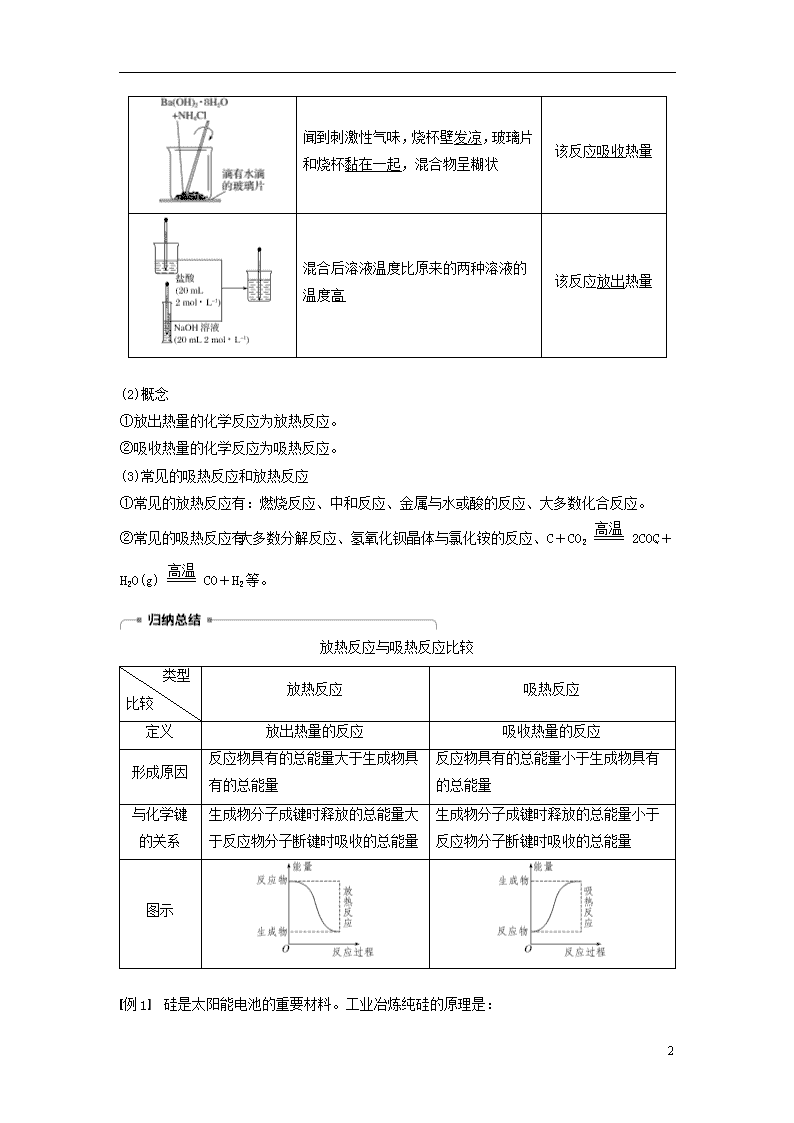
(1)实验探究
实验操作
实验现象
结论
①看到有气泡产生
②用手触摸反应后的试管,手感到热
③用温度计测得反应后溶液温度升高
该反应放出热量
18
闻到刺激性气味,烧杯壁发凉,玻璃片和烧杯黏在一起,混合物呈糊状
该反应吸收热量
混合后溶液温度比原来的两种溶液的温度高
该反应放出热量
(2)概念
①放出热量的化学反应为放热反应。
②吸收热量的化学反应为吸热反应。
(3)常见的吸热反应和放热反应
①常见的放热反应有:燃烧反应、中和反应、金属与水或酸的反应、大多数化合反应。
②常见的吸热反应有:大多数分解反应、氢氧化钡晶体与氯化铵的反应、C+CO22CO、C+H2O(g)CO+H2等。
放热反应与吸热反应比较
类型
比较
放热反应
吸热反应
定义
放出热量的反应
吸收热量的反应
形成原因
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
与化学键的关系
生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
图示
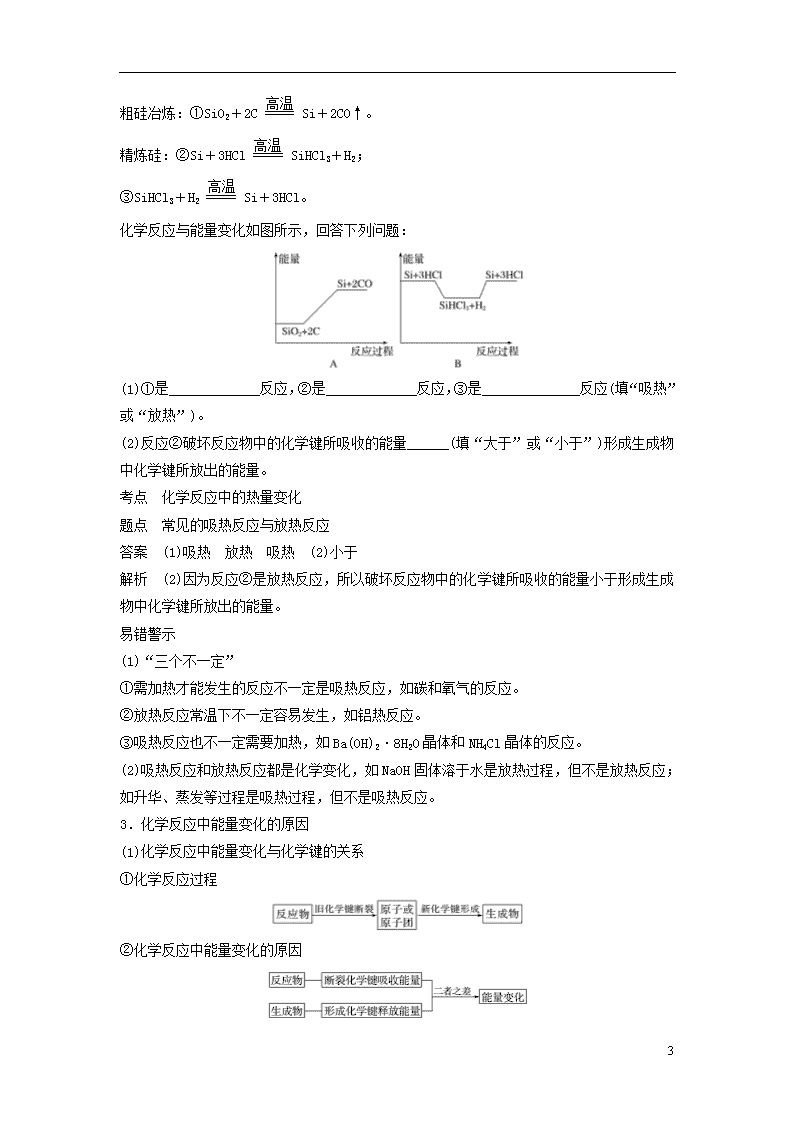
例1 硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
18
粗硅冶炼:①SiO2+2CSi+2CO↑。
精炼硅:②Si+3HClSiHCl3+H2;
③SiHCl3+H2Si+3HCl。
化学反应与能量变化如图所示,回答下列问题:
(1)①是_____________反应,②是_____________反应,③是______________反应(填“吸热”或“放热”)。
(2)反应②破坏反应物中的化学键所吸收的能量______(填“大于”或“小于”)形成生成物中化学键所放出的能量。
考点 化学反应中的热量变化
题点 常见的吸热反应与放热反应
答案 (1)吸热 放热 吸热 (2)小于
解析 (2)因为反应②是放热反应,所以破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量。
易错警示
(1)“三个不一定”
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应。
②放热反应常温下不一定容易发生,如铝热反应。
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化,如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
3.化学反应中能量变化的原因
(1)化学反应中能量变化与化学键的关系
①化学反应过程
②化学反应中能量变化的原因
18
(2)化学反应中能量变化与物质内部能量的关系
图示
能量相对大小
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
①化学反应的两大基本特征:物质种类发生变化和能量发生变化。
②化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因。
18
例2 H2+Cl2===2HCl的反应过程如下图所示:
(1)根据上图填写下表:
化学键
能量变化
断裂或形成1 mol化学键时
反应中能量变化
Cl—Cl
吸收243 kJ
共吸收______ kJ
H—H
吸收436 kJ
H—Cl
放出431 kJ
共放出______ kJ
(2)该反应______(填“放出”或“吸收”)______ kJ热量。
考点 化学反应中的能量变化
题点 由化学键的变化认识反应中的能量变化
答案 (1)679 862 (2)放出 183
例3 已知1 g氢气完全燃烧生成水蒸气时放出能量121 kJ,且氧气中1 mol O===O键完全断裂时需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收的能量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
考点 化学反应中的能量变化
题点 利用化学键求算化学反应中的能量变化
答案 C
解析 由1 g H2完全燃烧生成水蒸气时放出能量121 kJ可知:2 g H2(即含1 mol H—H键)完全燃烧生成水蒸气时放出的能量为121 kJ×2=242 kJ。由化学方程式H2(g)+O2(g)H2O(g)可设1 mol H—H键断裂吸收的能量为Q,则:Q+×496 kJ-2×463 kJ=-242 kJ,Q=436 kJ。
二、热化学方程式
1.概念:能表示化学反应中放出或吸收的热量的化学方程式。
18
2.书写——“三字诀”
—正确“写”出反应的化学方程式
—
—用ΔH“标”明反应放出或吸收的热量,负值表示反应放热,正值表示反应吸热。ΔH的单位为kJ·mol-1
例如,已知1 mol C与1 mol O2完全反应生成1 mol CO2放出393.6 kJ热量,则该反应的热化学方程式为C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·mol-1。
热化学方程式的书写方法
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)要注明反应物和生成物的状态。
(3)在右端注明ΔH的符号(正号常省略)、大小及单位。
(4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。化学计量数改变,ΔH的数值要相应改变。
例4 下列对热化学方程式H2(g)+I2(g)===HI(g)
ΔH=-9 kJ·mol-1的叙述中,正确的是( )
A.1 mol氢气和1 mol碘蒸气完全反应需要吸收9 kJ热量
B.1个氢分子和1个碘分子完全反应需要放出9 kJ的热量
C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体放出18 kJ的热量
D.1 mol H2(g)与1 mol I2(g)完全反应吸收18 kJ的热量
答案 C
解析 热化学方程式的具体形式是表示一定物质的量、一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热或吸热情况。只要依据书写热化学方程式的注意事项,对于本题就不难作出判断。
例5 已知:101 kPa时,1 mol辛烷完全燃烧生成CO2和液态水时放出的热量为5 518 kJ,强酸与强碱在稀溶液中发生反应生成1 mol H2O时放出的热量为57.3 kJ,则下列热化学方程式书写正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g) ΔH=5 518 kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
18
C.H++OH-===H2O ΔH=-57.3 kJ·mol-1
D.2NaOH(aq)+H2SO4(aq)===Na2SO4(l)+2H2O(l) ΔH=57.3 kJ·mol-1
答案 B
解析 A项,因该反应为放热反应,ΔH应取“-”,同时水应为液态,故A错;C项中应标明H+、OH-状态是稀溶液状态(aq);D项中Na2SO4应为稀溶液状态(aq),ΔH应取“-”且数值错误,故D错。
思维启迪——“四查”热化学方程式书写正误
一查“四态”。即(g、l、s、aq)是否正确;二查“正负莫反”。即“+”、“-”是否与吸热和放热一致;三查“单位书写”。即反应热的单位是否为kJ·mol-1;四查“数值对应”,即ΔH的数值与物质化学计量数是否对应。
三、燃料燃烧释放的热量
1.热值
已知下列几种燃料的热值:
物质
天然气
焦炭
氢气
乙醇
热值/kJ·g-1
56
33
143
30
其热化学方程式分别为:
①C(s)+O2(g)===CO2(g) ΔH=-396 kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896 kJ·mol-1
③H2(g)+O2(g)===H2O(l) ΔH=-286 kJ·mol-1
④C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1 380 kJ·mol-1
(1)完全燃烧相等物质的量的上述物质,放出热量的大小顺序是④>②>①>③。
(2)完全燃烧等质量的上述物质,放出热量的大小顺序是③>②>①>④。
(3)燃料燃烧放出热量的大小常用热值来衡量。燃料的热值是指在一定条件下单位质量的物质完全燃烧所放出的热量,单位是kJ·g-1。
(4)我国实施的“西气东输”工程中的“气”是指天然气,主要成分是甲烷,与煤等燃料相比较其优点是热值高,使用起来更经济,对环境污染小。
2.以煤为例,探究提高燃料燃烧效率问题
(1)煤燃烧时,将煤块粉碎成煤粉的依据是与空气中O2的接触面积增大,煤粉燃烧更充分,反应速率加快。
(2)通入适当过量空气的依据是空气充足,煤粉燃烧充分,生成CO2,放出热量多;若空气不足,煤燃烧不完全,生成CO,产生热量减少,且会造成污染。
18
(3)选择保温隔热且耐热的炉(灶)膛材料的主要目的是防止热量散失。
(4)充分利用煤燃烧后的废气中的热量可采取的措施是将燃烧后的废气通过交换装置,供其他方面使用。
提高燃料燃烧效率的措施及意义
(1)提高燃料的燃烧效率的措施
①尽可能使燃料充分燃烧,提高能量的转化率。关键是燃料与空气或氧气要尽可能充分接触,且空气要适当过量。
②尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。
(2)提高燃料的燃烧效率的意义在于节约能源、节约资源、减少污染。
例6 下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点
③将固体燃料粉碎 ④将液体燃料雾化处理
⑤将煤进行气化处理 ⑥通入适当过量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④
考点 燃料燃烧释放的热量
题点 提高燃烧效率的探究
答案 C
解析 理论上,提高燃料燃烧效率的常用方法是增大燃料与空气的接触面积,并通入适当过量的空气。对于①和②,由于燃料的着火点是其固有的性质,不可改变,故这两项措施不可行。③④⑤所采取的措施均是为了增大燃料与空气的接触面积。
1.下列说法正确的是( )
18
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③反应是放出能量还是吸收能量必须看反应物和生成物所具有的总能量的相对大小 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.③④ B.①②
C.①②③④ D.②③④
考点 化学反应中的能量变化
题点 多角度认识吸热反应与放热反应
答案 A
解析 加热才能发生的反应不一定是吸热反应,如铜在氯气中燃烧;放热反应在常温下不一定容易发生,如N2与H2合成NH3;反应是放热还是吸热取决于反应物、生成物所具有的总能量的相对大小;需要加热才能发生的放热反应,如果反应放出的热量达到反应所需要的热量,停止加热反应也能继续进行,如Fe+SFeS。
2.(2017·河北承德一中月考)关于下列图示说法正确的是( )
A.该图表明催化剂可以改变反应的热效应
B.该图表示某反应能量的变化与生成物状态无关
C.该图表示某吸热反应分别在有无催化剂的情况下反应过程中的能量变化
D.该图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒定律
考点 化学反应中的能量转化
题点 由图像分析化学反应中的能量转化
答案 D
解析 A项,起始能量与最终能量不变,因此催化剂不能改变反应的热效应,故错误;B项,图中并没有表现出物质的状态,因此不能得出该结论,且反应能量的变化与生成物状态有关,故错误;C项,生成物的总能量低于反应物的总能量,因此该反应为放热反应,故错误;D项,多余的能量以热量的形式释放,因此遵循能量守恒定律,故正确。
3.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
考点 化学能与热能的转化
18
题点 吸热或放热反应的实验或探究
答案 B
解析 反应发生后停止加热,反应仍可持续进行说明反应为放热反应,A错误,B正确;反应需要加热才能发生,常温下不能进行,C错误;反应是放热反应,所以反应物的总能量高于生成物的总能量,D错误。
4.(2018·温州十五校联合体期中)1 g H2完全燃烧生成液态水放出142.9 kJ的热量,下列表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)===2H2O(l) ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=571.6 kJ·mol-1
C.2H2+O2===2H2O ΔH=-571.6 kJ·mol-1
D.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
答案 D
解析 1 g氢气完全燃烧生成液态水,放出142.9 kJ热量,所以2 mol氢气完全燃烧生成液态水,放出的热量为142.9 kJ×4=571.6 kJ,所以ΔH=-571.6 kJ·mol-1,故A、B错误;物质的状态影响反应热,未注明物质的聚集状态,故C错误;2 g H2燃烧生成液态水时放出285.8 kJ的热量,ΔH<0,热化学方程式为H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1,故D正确。
5.将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是( )
①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
A.①②③ B.②③④
C.①③④ D.①②③④
考点 燃料燃烧释放的热量
题点 提高燃烧效率的探究
答案 A
解析 煤块粉碎是为了提高煤的利用率;脱硫是为了减少SO2的产生;过量空气是为了减少CO的产生。
6.下表中的数据是破坏1 mol物质中的化学键所消耗的能量:
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量/kJ
243
193
151
432
366
298
436
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是_________________________________(填字母)。
18
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是________(填字母)。
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是______(填“吸热”或“放热”)反应。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是______________。
考点 化学反应中的能量变化
题点 化学反应中能量变化与物质的稳定性
答案 (1)A (2)A (3)放热 (4)Cl2
解析 (1)、(2)破坏1 mol物质中的化学键所消耗的能量越高,则物质越稳定,所具有的能量越低。(3)、(4)以氯元素为例计算断开1 mol Cl—Cl键和1 mol H—H键需吸收能量:243 kJ+436 kJ=679 kJ,而形成2 mol H—Cl 键放出的能量为2×432 kJ=864 kJ,所以在Cl2+H2===2HCl反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2+H2===2HBr、I2+H2===2HI反应中分别放出103 kJ、9 kJ的热量。
[对点训练]
题组一 化学反应中的能量变化
1.已知化学反应2C(s)+O2(g)2CO(g)、2CO(g)+O2(g)2CO2(g)都是放热反应。据此判断,下列说法不正确的是(其他条件相同)( )
A.12 g C所具有的能量一定高于28 g CO所具有的能量
B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
考点 化学反应中的能量变化
题点 由物质的能量认识化学反应中的能量变化
答案 A
解析 放出热量的化学反应,反应物的总能量一定高于生成物的总能量。C和CO的燃烧反应都是放热反应,所以C+O2CO2必然是放热反应,因此,B、C两项的说法正确;12 g C并不代表反应物的全部,O2也是反应物,所以A项不正确;由于CCO放热、COCO2放热,所以CCO2比CCO放出的热量要多,即D项说法正确。
18
2.(2017·汕头高一检测)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和 O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
考点 化学变化中的能量变化
题点 多角度认识化学变化中的能量变化
答案 B
解析 反应热就是断裂旧化学键吸收的能量和形成新化学键所放出的能量的差值,所以该反应的反应热是946 kJ·mol-1+498 kJ·mol-1-2×632 kJ·mol-1=180 kJ·mol-1,所以该反应是吸热反应,所以选项A不正确,选项B正确;氮气和氧气反应需要在高温或放电条件下,选项C不正确;NO不是酸性氧化物,和氢氧化钠溶液不反应,选项D不正确。
3.(2017·石家庄高一检测)金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体。在100 kPa时,1 mol石墨转化为金刚石要吸收1.895 kJ的热能。据此判断在100 kPa压强下,下列说法正确的是( )
A.金刚石比石墨更稳定
B.石墨比金刚石更稳定
C.1 mol金刚石比1 mol石墨的总能量低
D.1 mol金刚石转变为石墨需要吸收1.895 kJ能量
考点 化学反应中的能量变化
题点 化学反应中能量变化与物质的稳定性
答案 B
解析 1 mol石墨转化为金刚石吸收1.895 kJ的热能,说明金刚石的能量高于石墨,石墨稳定,A项不正确,B项正确,C项不正确;1 mol金刚石转变为石墨时要放出1.895 kJ的能量,D项不正确。
题组二 化学能与热能的相互转化
4.下列反应一定属于放热反应的是( )
18
①H2SO4与Ba(OH)2溶液的反应 ②Mg与CH3COOH溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
A.①②③ B.①②④
C.①②③④ D.③④⑤
考点 化学能与热能的相互转化
题点 常见的放热反应和吸热反应
答案 C
解析 金属与酸反应、中和反应、所有燃烧反应都是放热反应,复分解反应则不一定是放热反应。
5.如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
A.500 mL 2.0 mol·L-1 HCl溶液和500 mL 2.0 mol·L-1 NaOH溶液的反应符合图(a),且放出热量为ΔE1
B.500 mL 2.0 mol·L-1 H2SO4溶液和500 mL 2.0 mol·L-1 Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C.发生图(a)能量变化的任何反应,一定不需要加热即可发生
D.CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
考点 化学能与热能的相互转化
题点 多角度认识吸热反应与放热反应
答案 A
解析 图(a)表示放热反应,选项A是放热反应,A项正确;图(b)表示吸热反应,选项B是放热反应,B项错误;一些放热反应需加热才能发生,C项错误;浓硫酸溶于水虽然会放出热量,但不属于化学反应,D项错误。
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
考点 化学能与热能的相互转化
18
题点 吸热或放热反应实验与探究
答案 B
解析 醋酸逐渐凝固,说明NH4HCO3与盐酸反应使醋酸的温度降低,因此该反应为吸热反应,A错误;吸热反应中反应物吸收能量,吸收的能量转化为生成物内部的能量储存在生成物中,B正确;由于NH4HCO3和盐酸的反应是吸热反应,故反应物的总能量低于生成物的总能量,C错误;NH4HCO3粉末与盐酸的反应是吸热反应,各反应物的总能量低于各生成物的总能量,而NH4HCO3仅是两种反应物之一、NH4Cl仅是三种生成物之一,故无法得出NH4HCO3的能量一定低于NH4Cl的能量的结论,D错误。
题组三 热化学方程式的意义与书写
7.(2018·余姚下学期期中)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量,下列表示该反应的热化学方程式正确的是( )
A.CH4O(l)+O2(g)===CO2(g)+2H2O(g) ΔH=-725.76 kJ·mol-1
B.2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 451.6 kJ·mol-1
C.2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
D.CH4O(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
考点 热化学方程式
题点 热化学方程式的正误判断
答案 D
解析 A项,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则32 g甲醇即1 mol甲醇燃烧放出的热量为725.76 kJ,热化学方程式为:CH4O(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1,故D正确。
8.(2018·保定4月月考)工业生产水煤气的反应为:C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.4 kJ·mol-1下列判断正确的是( )
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)===C(s)+H2O(g) ΔH=131.4 kJ·mol-1
C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
考点 热化学方程式
题点 热化学方程式的理解
答案 C
解析 A项,该反应是吸热反应,故反应物的总能量小于生成物的总能量,错误;B项,正反应吸热,逆反应放热,错误;C项,由题干反应可知生成1 mol氢气吸收的热量为131.4
18
kJ,正确;D项,由题干反应可知生成1 mol CO吸收的热量为131.4 kJ,而1 L CO物质的量不是1 mol,D错误。
9.(2018·绍兴期中)在催化剂、400 ℃时可实现氯的循环利用,下图是其能量关系图,下列分析正确的是( )
A.曲线a是使用了催化剂的能量变化曲线
B.反应物的总键能高于生成物的总键能
C.反应的热化学方程式为:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=-115.6 kJ
D.若反应生成2 mol液态水,放出的热量高于115.6 kJ
考点 热化学方程式
题点 化学反应与能量的相关综合
答案 D
解析 A项,曲线b的活化能比a的低,所以曲线b是使用了催化剂的能量变化曲线,错误;B项,由图像可知反应物能量高,所以键能低,错误;C项,反应的热化学方程式为:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,错误;D项,水由气态变成液态要放出能量,所以若反应生成2 mol液态水,放出的热量高于115.6 kJ,D项正确。
题组四 反应热的简单计算
10.已知断开1 mol H—H键吸收的能量为436 kJ,形成1 mol H—N键放出的能量为391 kJ,根据化学方程式N2+3H22NH3,反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能量是( )
A.431 kJ B.945.6 kJ C.649 kJ D.869 kJ
考点 反应热的简单计算
题点 由化学键的变化计算反应中的能量变化
答案 B
解析 设断开1 mol N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:92.4 kJ=6×391 kJ-3×436 kJ-x,x=945.6 kJ。
11.(2018·绍兴高一期中)25 ℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是( )
18
A.C(s)+O2(g)===CO(g) ΔH=-396 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-286 kJ·mol-1
D.CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=736 kJ·mol-1
考点 反应热的简单计算
题点 由热值计算反应热
答案 B
解析 A项,煤炭的热值是33 kJ·g-1,则12 g煤炭放出的热量为396 kJ,所以热化学方程式为:C(s)+O2(g)===CO2(g) ΔH=-396 kJ·mol-1,错误;B项,天然气的热值是56 kJ·g-1,则16 g CH4放出的热量为896 kJ,所以热化学方程式:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896 kJ·mol-1,正确;C项,氢气的热值是143 kJ·g-1,则4 g H2放出的热量为572 kJ,所以热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,错误;D项,甲醇(CH3OH)的热值是23 kJ·g-1,则32 g CH3OH放出的热量为736 kJ,所以热化学方程式:CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-736 kJ·mol-1,错误。
12.已知:2H2(g)+ O2(g)===2H2O(l) ΔH1=-572 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶2 B.1∶3 C.1∶4 D.2∶3
考点 反应热的简单计算
题点 利用热化学方程式计算反应热
答案 B
解析 由题意知,1 mol H2燃烧可以放出286 kJ的热量;1 mol CH4燃烧可以放出890 kJ的热量。现有H2与CH4的混合气体112 L(标准状况),则气体的总物质的量为5 mol,其完全燃烧后测得反应放热3 695 kJ,则n(H2)+n(CH4)=5 mol,286 kJ·mol-1×n(H2)+890 kJ·mol-1×n(CH4)=3 695 kJ,解之得n(H2)=1.25 mol、n(CH4)=3.75 mol,所以H2与CH4的物质的量之比是1∶3,B正确。
[综合强化]
13.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6分子结构如图所示,现提供以下化学键的键能:P—P:198 kJ·mol-1、P—O:360 kJ·mol-1、O===O:498 kJ·mol-1,则P4(白磷)+3O2===P4O6的反应是________(填“吸热”或“放热”)反应,生成1 mol P4O6________的热量为________________________________________________________________________。
18
考点 化学键与化学变化中能量变化的关系
题点 由化学键的变化计算能量变化
答案 放热 放出 1 638 kJ
解析 断开旧键吸收的能量为198×6 kJ+3×498 kJ=2 682 kJ,形成新键放出的能量为12×360 kJ=4 320 kJ,故该反应为放热反应,生成1 mol P4O6放出的热量为4 320 kJ-2 682 kJ=1 638 kJ。
14.下图是某同学设计的放热反应的观察装置,其实验操作如下:
①按图示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),打开T形管的全部弹簧夹,使U形管内两边的液面处于同一水平面,再关闭弹簧夹c;
③在盛有1 g氧化钙的小试管里滴入2 mL左右的水,观察现象。
试回答:
(1)实验前必须进行的一步实验操作是___________________________________________。
(2)实验中观察到的现象是______________________________________________________
________________________________________________________________________。
(3)该实验的原理是____________________________________________________________
________________________________________________________________________。
(4)写出实验中发生反应的化学方程式:_______________________________________
________________________________________________________________________。
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:__________________________
________________________________________________________________________。
(6)若实验中CaO换成NaCl,实验还能否观察到相同的现象?__________(填“能”或“否”)。
考点 化学键与热能的相互转化
题点 吸热或放热反应的实验与探究
18
答案 (1)检查装置气密性
(2)U形管内的液体左边下降,右边上升
(3)CaO和H2O反应放出热量,使大试管中的空气受热膨胀,引起红墨水(或品红溶液)在U形管中的位置左低右高
(4)CaO+H2O===Ca(OH)2
(5)1 mol CaO和1 mol H2O的能量和大于1 mol Ca(OH)2的能量
(6)否
15.化学在能源开发与利用中起着十分关键的作用。
(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________。
(2)家用液化气中主要成分之一是丁烷。当1 g丁烷完全燃烧并生成CO2和液态水时,放出热量50 kJ。试写出丁烷燃烧的热化学方程式:_______________________________________
________________________________________________________________________。
考点 热化学方程式
题点 热化学方程式的书写
答案 (1)B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)
ΔH=-2 900 kJ·mol-1
解析 (1)根据题意可知,1 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ×=2 165 kJ热量,其热化学方程式为B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1。
(2)根据题意可知,1 mol丁烷完全燃烧并生成CO2和液态水时,放出热量50× kJ=2 900 kJ,所以丁烷燃烧的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l) ΔH=-2 900 kJ·mol-1。
18
相关文档
- 2020高中化学 第20天 配制一定物2021-08-238页
- 高中化学 第二章 第一节 化学能与2021-08-235页
- 2020年高中化学 专题1课题一 海带2021-08-236页
- 高中化学必修2第3-4章综合测试题2021-08-236页
- 高中化学(人教版)必修1课件:第一章 从2021-08-2333页
- 2019高中化学 第二章 化学反应速率2021-08-236页
- 2020年高中化学 第4章 电化学基础2021-08-235页
- 2019高中化学 第二章 化学反应与能2021-08-233页
- 2020新教材高中化学第2章化学键化2021-08-235页
- 2019高中化学 第三章3物质的量在化2021-08-234页