- 2.29 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
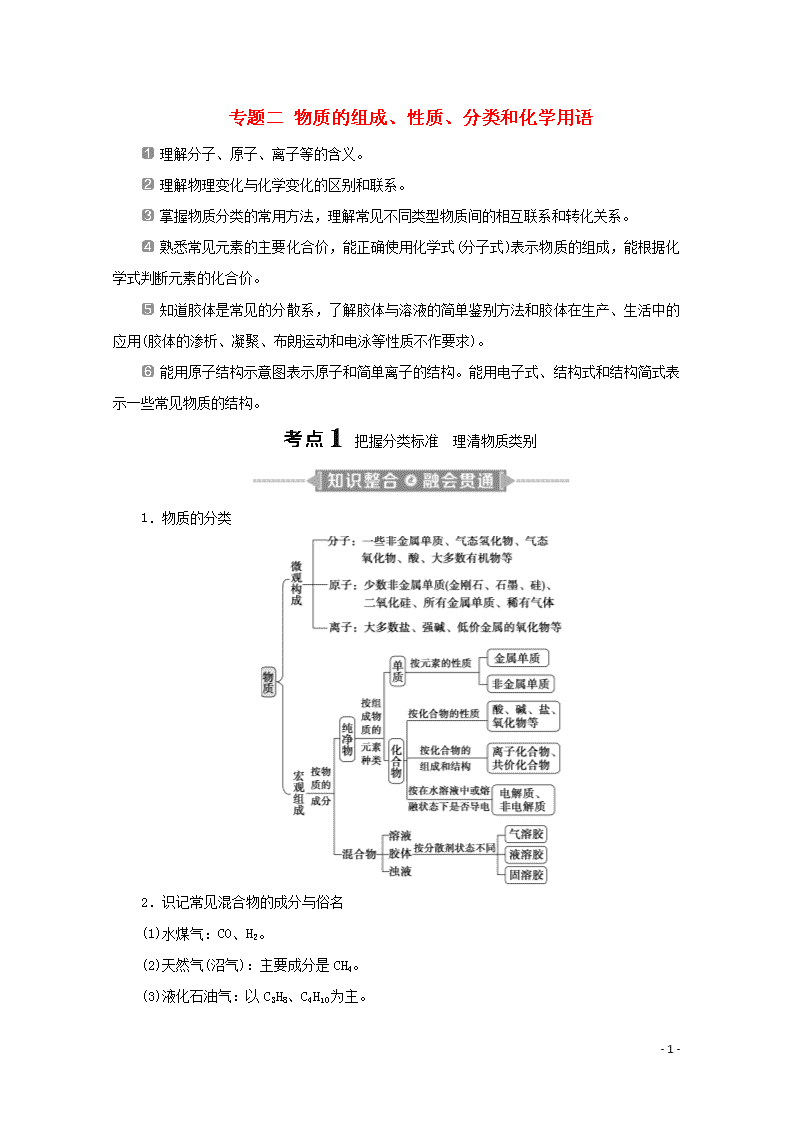
专题二 物质的组成、性质、分类和化学用语
理解分子、原子、离子等的含义。
理解物理变化与化学变化的区别和联系。
掌握物质分类的常用方法,理解常见不同类型物质间的相互联系和转化关系。
熟悉常见元素的主要化合价,能正确使用化学式(分子式)表示物质的组成,能根据化学式判断元素的化合价。
知道胶体是常见的分散系,了解胶体与溶液的简单鉴别方法和胶体在生产、生活中的应用(胶体的渗析、凝聚、布朗运动和电泳等性质不作要求)。
能用原子结构示意图表示原子和简单离子的结构。能用电子式、结构式和结构简式表示一些常见物质的结构。
把握分类标准 理清物质类别
1.物质的分类
2.识记常见混合物的成分与俗名
(1)水煤气:CO、H2。
(2)天然气(沼气):主要成分是CH4。
(3)液化石油气:以C3H8、C4H10为主。
- 20 -
(4)裂解气:以乙烯、丙烯、甲烷为主。
(5)焦炉气:主要成分是H2、CH4、C2H4、CO。
(6)水玻璃:Na2SiO3的水溶液。
(7)王水:浓盐酸与浓硝酸的混合物(体积比3∶1)。
(8)波尔多液:主要成分是CuSO4和Ca(OH)2。
(9)肥皂:主要成分是高级脂肪酸钠。
(10)碱石灰:NaOH和CaO的混合物。
(11)铝热剂:铝粉和高熔点的金属氧化物的混合物。
(12)漂白粉:Ca(ClO)2和CaCl2的混合物。
3.一种重要的混合物——胶体
(1)胶体区别其他分散系的本质特征是分散质粒子直径的大小(1~100 nm)。
(2)胶体的物理特性:①丁达尔效应;②电泳现象;③介稳性;④聚沉等。
(3)胶体微粒一般是离子、分子或难溶物的聚集体,但有些高分子化合物,如淀粉、蛋白质,因其分子非常大,其相对分子质量通常为几万、几十万甚至上百万、千万,因此一个分子就是一个胶体微粒,它们溶于水形成胶体。
(4)区分胶体和其他分散系的最简便的方法是丁达尔效应。
(5)胶体具有介稳性的主要原因是同种胶体粒子带有相同电荷。
(6)胶体的电泳现象反映了胶体粒子带有电荷,但不能说成胶体带有电荷。胶体与溶液一样是呈电中性的。
(7)在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目。
(8)在Fe(OH)3胶体中逐滴加入强酸(如盐酸、硫酸)时,出现的现象为先沉淀后溶解。开始时出现沉淀是由于胶体中加入了电解质发生了聚沉,后来沉淀消失是由于发生了中和反应。
(9)净水剂及其作用原理
胶体粒子的直径一般在1~100 nm之间,它决定了胶体粒子具有较大的比表面积,吸附力很强,能在水中吸附悬浮固体或色素形成沉淀,这就是胶体净水的原理。能在水中自然形成胶体,并且对水质无明显副作用的物质有KAl(SO4)2·12H2O、FeCl3·6H2O等,这样的物质被称为净水剂,其形成胶体的化学原理是Al3+、Fe3+发生水解反应生成Al(OH)3胶体、Fe(OH)3胶体。
- 20 -
1.正误判断,正确的打“√”,错误的打“×”
(1)(2018·高考江苏卷)KAl(SO4)2·12H2O溶于水可形成Al(OH)3胶体。( )
(2)(2018·高考全国卷Ⅱ)雾和霾的分散剂相同。( )
(3)(2016·高考全国卷Ⅱ)制备Fe(OH)3胶体,可以将NaOH浓溶液滴加到饱和FeCl3溶液中。( )
(4)(2016·高考浙江卷)纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附。( )
答案:(1)√ (2)√ (3)× (4)×
2.(2017·高考北京卷)古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )
A.瓷器
B.丝绸
C.茶叶
D.中草药
解析:选A。瓷器的主要成分为硅酸盐,属于无机物,A项正确;丝绸的主要成分为蛋白质,属于有机物,B项错误;茶叶的主要成分为茶多酚(属于酚类)、生物碱、氨基酸、有机酸等,属于有机物,C项错误;中草药成分复杂,通常含有糖类、氨基酸、蛋白质、油脂、维生素、有机酸、生物碱等,其主要成分属于有机物,D项错误。
物质分类认识中的“四个误区”
(1)“名不符实”的现象:纯碱(Na2CO3)是盐;干冰是固态CO2;冰水共存物是纯净物;纯净的盐酸是混合物等。
(2)由同种元素组成或组成元素质量比恒定的物质不一定是纯净物,如O2与O3组成的混合物中只有氧元素;分子式为C4H10的化合物有正丁烷和异丁烷两种物质,可能为混合物;由12C和13C组成的石墨则是纯净物。
(3)几元酸是根据一个酸分子最多能电离产生的H+数目决定的,电离产生几个H+,该酸就是几元酸,如次磷酸(H3PO2)、CH3COOH都是一元酸。
(4)酸式盐成分中一定含有氢,但盐中含有氢的不一定是酸式盐,如NaH2PO2、HCOOK是正盐
题组一 物质的组成与分类
- 20 -
1.正误判断,正确的打“√”,错误的打“×”
(1)由同种元素组成的物质一定是纯净物。( )
(2)强碱一定是离子化合物,盐也一定是离子化合物。( )
(3)碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物。( )
(4)酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物。( )
(5)含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键。( )
(6)能导电的物质一定是电解质,不能导电的物质一定是非电解质。( )
(7)强电解质的导电性一定强于弱电解质的导电性。( )
(8)盐中一定含金属元素。( )
(9)向浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体。( )
(10)明矾溶于水产生Al(OH)3 胶体:Al3++3H2O===Al(OH)3↓+3H+。( )
(11)向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解。( )
(12)将0.2 mol·L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体。( )
(13)处理废水时可加入明矾作为混凝剂,以吸附水中的杂质。( )
(14)PM2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶,能产生丁达尔效应。( )
答案:(1)× (2)× (3)√ (4)√ (5)√ (6)× (7)× (8)× (9)× (10)× (11)√ (12)× (13)√ (14)×
2.下列有关物质的分类中正确的是( )
选项
A
B
C
D
名称
碳纳米管
胆矾
84消毒液
聚乙烯塑料
分类
高分子化
合物
弱电解质
纯净物
混合物
解析:选D。碳纳米管为碳的单质,不是高分子化合物,A项错误;胆矾是CuSO4·5H2O,溶于水能完全电离,是强电解质,B项错误;84消毒液是NaClO的水溶液,为混合物,C
- 20 -
项错误;聚乙烯塑料为合成高分子化合物,是混合物,D项正确。
物质分类的“四注意”
(1)纯净物由一种物质(或一种分子)组成,但由一种元素组成的物质(或分子)不一定是纯净物(如O2和O3的混合物、金刚石和石墨的混合物)。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)胶体区别于其他分散系的本质特征是分散质粒子直径在1~100 nm之间,而不是丁达尔效应。
题组二 胶体的性质
3.国防科大航天科学与工程学院新型陶瓷纤维及其复合材料重点实验室成功研制出一种具有超强吸附能力的新型超轻纳米材料(基本微粒直径为1~100 nm)。这种材料结构上由一维氮化硼纳米管和二维氮化硼纳米晶片复合而成,整个材料内部充满气孔。这种材料耐高温,且用它吸附完有机物后,可以通过点燃的方式实现重复使用。下列关于该材料的说法错误的是( )
A.将该材料分散到液体分散剂中,所得混合物具有丁达尔效应
B.该材料的基本微粒既能透过滤纸,也能透过半透膜
C.该材料在2 000 ℃的高温下,还可以保持结构完整,可正常使用
D.该材料在航空航天高温热防护、有毒化学物质吸附和清除等领域有重要的应用前景
解析:选B。该新型超轻纳米材料的微粒直径为1~100 nm,不能透过半透膜,B错。
纳米材料本身不是胶体,当它分散到分散剂中时才能形成胶体。
4.下列叙述正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.根据分散质粒子直径的大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
D.“血液透析”原理与胶体的性质无关
- 20 -
解析:选B。HClO是弱酸,但NaClO是盐,NaClO属于强电解质,故A项错误;向沸水中逐滴加入少量饱和FeCl3溶液,加热至出现红褐色液体为止,即可得氢氧化铁胶体,故B项正确;分散质微粒直径小于1 nm的为溶液,1~100 nm之间的为胶体,大于100 nm的为浊液,故C项错误;血液属于胶体,“血液透析”利用了胶体不能透过半透膜的原理,和胶体的性质有关,故D项错误。
5.下列说法错误的是( )
A.大气中PM2.5比表面积大,吸附能力强,能吸附许多有毒有害物质
B.PM2.5的颗粒大小与分子大小差不多
C.雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理
D.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
解析:选B。PM2.5的颗粒大小与分子大小不同。
雾霾,顾名思义是雾和霾。但是雾和霾的区别很大。雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,是近地面层空气中水汽凝结(或凝华)的产物。空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。PM2.5(空气动力学当量直径小于或等于2.5微米的颗粒物)被认为是造成雾霾天气的“元凶”。
认识物质性质 理解物质变化
1.认识物质的性质
(1)物理性质:物质不需要发生化学变化就能表现出来的性质。通常表现为颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、导电性、导热性、挥发性、吸附性等。
(2)化学性质:物质在化学变化中才能表现出来的性质。通常表现为金属性、非金属性、可燃性、氧化性、还原性、毒性、溶液的酸碱性、热稳定性等。
2.理解物质变化的“四个方面”
(1)从宏观上看,有新物质生成的变化是化学变化,反之则为物理变化。这里的新物质生成所能实现的仅是原子与分子(或离子)的相互转化,在整个过程中原子核没有发生改变。一种原子变为另一种原子涉及原子核的变化,不属于化学变化。
(2)从微观上看,化学变化过程中有旧化学键的断裂,同时又有新化学键的形成,但有化学键断裂的变化未必就是化学变化,如NaCl晶体、SiO2晶体的熔化,
- 20 -
分别破坏了离子键、共价键,但属于物理变化。
(3)从能量上看,化学变化中一定伴随能量变化,而有能量变化的过程却不一定是化学变化;物理变化中有的有能量变化,有的无能量变化,如气体与气体之间的扩散等。
(4)化学变化过程中一定伴有物理变化,但物理变化过程中未必有化学变化,观察到一定的实验现象并不一定是发生化学变化造成的。
3.识记易混淆的物理变化、化学变化
物质变化过程中的“三馏”“四色”“五解”和“十四化”
变化
比较
物理变化
化学变化
三馏
①蒸馏
②分馏
干馏
四色
焰色反应
①显色反应 ②颜色反应
③指示剂变色反应
五解
潮解
①分解 ②电解
③水解 ④裂解
十四化
①熔化
②汽化
③液化
④升华
①氧化 ②风化 ③钝化
④催化 ⑤皂化 ⑥歧化
⑦硝化 ⑧酯化 ⑨裂化
⑩油脂的硬化
①化学变化:同素异形体之间的相互转化、CuSO4·5H2O的脱水、蛋白质变性、电解质溶液导电、浓硫酸脱水、煤的气化和液化。②物理变化:金属导电、盐析、活性炭吸附、渗析、胶体的聚沉。③爆炸有的是化学变化引起的,有的是物理变化引起的。
1.(2019·高考江苏卷)下列有关化学反应的叙述正确的是( )
A.Fe在稀硝酸中发生钝化
B.MnO2和稀盐酸反应制取Cl2
C.SO2与过量氨水反应生成(NH4)2SO3
D.室温下Na与空气中O2反应制取Na2O2
解析:选C。A项,常温下,Fe在浓硝酸中会发生钝化,错误;B项,MnO2
- 20 -
与浓盐酸在加热条件下发生反应生成Cl2,与稀盐酸不反应,错误;C项,氨水过量,SO2与NH3·H2O发生反应生成(NH4)2SO3,正确;D项,室温下,Na与空气中O2反应生成Na2O,错误。
2.(2019·高考天津卷)化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
解析:选D。利用废弃的秸秆生产乙醇的过程中,秸秆中的纤维素水解生成葡萄糖,葡萄糖再转化成乙醇,A项不符合题意;利用石油生产塑料、化纤等高分子材料的过程中,发生加聚反应或缩聚反应,B项不符合题意;利用基本的化学原料生产化学合成药物的过程中,发生了化学反应,C项不符合题意;利用反渗透膜从海水中分离出淡水,属于物理变化,D项符合题意。
3.(2018·高考北京卷)下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )
A.甲醇低温所制氢气用于新能源汽车
B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射“天宫二号”的火箭燃料
D.开采可燃冰,将其作为能源使用
解析:选B。化学变化中的最小微粒是原子,化学变化中不涉及原子种类的改变,故选B。
4.(2016·高考四川卷)化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A.氯气做水的杀菌消毒剂
B.硅胶做袋装食品的干燥剂
C.二氧化硫做纸浆的漂白剂
D.肥皂水做蚊虫叮咬处的清洗剂
解析:选B。氯气做水的杀菌消毒剂是利用氯气与水反应生成的次氯酸的强氧化性,发生了化学变化;硅胶做袋装食品的干燥剂,是因为硅胶疏松多孔,具有吸收水分的作用,
- 20 -
没有发生化学变化;二氧化硫做纸浆的漂白剂是因为二氧化硫可与某些有色物质发生化学反应生成不稳定的无色物质;肥皂的主要成分为高级脂肪酸钠,肥皂水做蚊虫叮咬处的清洗剂是利用高级脂肪酸钠在水中发生水解反应使溶液呈碱性的性质,发生了化学变化。
物质的性质与变化常结合物质的用途来考查,解答此类试题的方法是结合物质的应用目的或过程中所起的作用分析物质表现出的性质,如还原性(在食品保存过程中防氧化)、吸水性(用作干燥剂)、弱碱性(用于中和胃酸)等,并利用过程中是否有新物质生成判断是否发生化学变化。
1.化学与生产、生活密切相关,下列过程中没有发生化学变化的是( )
A.用活性炭去除冰箱里的异味
B.用明矾溶液清除铜镜表面的铜锈
C.用一定比例的生石灰、硫黄和水共煮制石硫合剂农药(棕红色)
D.古代用银针检验食品中是否含有剧毒粗砒霜(含硫化物杂质的As2O3)
解析:选A。利用活性炭的吸附性,可除去冰箱里的异味,此过程属于物理变化,故A项符合题意;明矾的化学式为KAl(SO4)2·12H2O,明矾溶于水发生水解Al3++3H2OAl(OH)3+3H+,溶液显酸性,铜锈与H+发生反应,可达到清除铜锈的目的,此过程发生化学反应,故B项不符合题意;用一定比例的生石灰、硫黄和水共煮得到石硫合剂,发生化学反应,故C项不符合题意;粗砒霜中含有硫化物杂质,硫化物与银反应生成黑色的Ag2S,属于化学变化,故D项不符合题意。
2.中华民族有着灿烂的文化积淀。在下列古代发明和工艺中不涉及化学变化的是( )
A.孔明灯 B.用树皮、棉、麻造纸
C.烧制彩陶 D.淘黄金
解析:选D。孔明灯是利用物质燃烧产生的热能将灯放入高空,发生了化学变化,A项不符合题意。造纸的过程中既有物理变化,又有化学变化,B项不符合题意。陶瓷烧制过程中有机物逐渐被除去,无机氧化物之间进行反应生成硅酸盐类物质,涉及化学变化,C项不符合题意。金的化学性质稳定,在自然界中以游离态形式存在,打捞起河里或湖里的淤泥后,用淘盘将淤泥洗去,可以得到金,没有发生化学变化,D项符合题意。
化学用语
- 20 -
1.明确常用的七种图式
结构示意图
S2-:
Al3+:
电子式
Na2O2:Na+[]2-Na+H2O: HH
球棍模型
甲烷: 乙烯:
比例模型
结构式
CO2:O==C==O HClO:H—O—Cl
结构简式
乙烯:CH2===CH2 乙酸:CH3COOH
分子式或化学式
臭氧:O3 明矾:KAl(SO4)2·12H2O
2.正确书写六种表示物质变化的方程式
(1)化学方程式,如2FeCl2+Cl2===2FeCl3。
(2)离子方程式,如2Fe2++Cl2===2Fe3++2Cl-。
(3)热化学方程式,如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1。
(4)电离方程式,如CH3COOHH++CH3COO-。
(5)电极反应式,如钢铁的吸氧腐蚀,负极:2Fe-4e-===2Fe2+;正极:O2+4e-+2H2O===4OH-。
(6)电解方程式,如2NaCl+2H2O2NaOH+Cl2↑+H2↑。
3.化学用语使用“四注意”
(1)书写电子式时要注意:①明确是离子化合物还是共价化合物;②切勿漏掉未成键电子对;③理清原子的排列顺序,如H;④离子(或根)带电荷,基团不显电性,如OH-为[H]-,—OH为· H。
(2)结构简式需保留官能团,如CH2===CH2,不能写成CH2CH2,还要注意有机物中原子的连接情况,如—NO2,不能写成—O2N。
(3)各“式”切
- 20 -
勿张冠李戴:是名称还是化学式,是分子式还是实验式,是结构式还是结构简式,是原子结构示意图还是离子结构示意图,是化学方程式还是离子方程式等。
(4)化学方程式或离子方程式要遵守质量守恒,化学计量数要最简,注明反应条件并注意“↑”“↓”“ ”“===”“―→”符号的使用。
1.(2019·高考江苏卷)反应NH4Cl+NaNO2===NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:Cl
B.N2的结构式:N==N
C.Na+的结构示意图:
D.H2O的电子式:HH
解析:选D。A项,中子数为18的氯原子应表示为Cl,错误;B项,N2分子中N与N之间形成叁键,结构式为N≡N,错误;C项,Na+的结构示意图为,错误;D项,H2O为共价化合物,每个H原子和O原子之间共用一对电子对,正确。
2.(2018·高考江苏卷)用化学用语表示NH3+HCl===NH4Cl中的相关微粒,其中正确的是( )
A.中子数为8的氮原子:N
B.HCl的电子式:H+[]-
C.NH3的结构式:
D.Cl-的结构示意图:
解析:选C。中子数为8的N原子,其质量数为15,故应写成N,A项错误;HCl为共价化合物,电子式应为H,B项错误;NH3的结构中一个N原子与三个H原子以共价键相连,C项正确;Cl-的最外层为8个e-,应写成,D项错误。
3.(2017·高考江苏卷)下列有关化学用语表示正确的是( )
A.质量数为31的磷原子:P
- 20 -
B.氟原子的结构示意图:
C.CaCl2的电子式:Ca2+[]
D.明矾的化学式:Al2(SO4)3
解析:选A。P的左上角标质量数,左下角标质子数,A项正确;F原子的最外层有7个电子,B项错误;两个Cl-应放在Ca2+的两侧,C项错误;明矾的化学式为KAl(SO4)2·12H2O,D项错误。
1.(2019·徐州高三考前模拟)下列有关化学用语表示正确的是( )
A.质量数为14的碳原子:C
B.次氯酸的电子式:HO
C.乙醇分子的比例模型:
D.绿矾的化学式:CuSO4·5H2O
解析:选C。A不正确,应该是C;B不正确,应该是HCl··,··;D不正确,应该是FeSO4·7H2O。
2.(2019·淮安、宿迁高三期中)下列有关化学用语表示正确的是( )
A.甲烷分子的球棍模型:
B.NH4Br的电子式:
C.34S2-的结构示意图:
D.邻羟基苯甲酸的结构简式:
解析:选C。A.碳原子半径大于氢原子,故A错误;B.Br-未用电子式表示,故B错误;C.34S2-的结构示意图为,故C正确;D.羧基应为—COOH,故D错误。
3.(2016·高考江苏卷)下列有关化学用语表示正确的是( )
- 20 -
A.中子数为10的氧原子:O
B.Mg2+的结构示意图:
C.硫化钠的电子式:Na∶∶Na
D.甲酸甲酯的结构简式:C2H4O2
解析:选B。A项,中子数为10的氧原子,质量数为18,应表示为O,错误;B项,Mg2+的核电荷数为12,最外层电子数为8,正确;C项,Na2S为离子化合物,电子式为Na+[∶∶]2-Na+,错误;D项,甲酸甲酯的结构简式为HCOOCH3,错误。
4.(1)32号元素Ge的原子结构示意图:________。
(2)质子数为92,中子数为143的铀(U)的核素符号:________。
(3)联氨(N2H4)分子的电子式:________;H2O2分子的电子式:________;离子化合物NH5的电子式:____________。
(4)甲醛的结构简式:________________________________________________;甲酸乙酯的实验式:________;1,3丁二烯的键线式:________。
(5)分子式为C5H12的有机物的结构简式:_____________________________________
________________________________________________________________________。
(6)Li2Ti5O15中Ti的化合价为+4,1 mol Li2Ti5O15中过氧键的数目为________。
答案:(1) (2)U
(3)
(4)HCHO C3H6O2
(5)CH3(CH2)3CH3、、C(CH3)4
(6)4NA
5.写出符合要求的方程式。
(1)NaHCO3在水中的电离方程式:_______________________________________。
- 20 -
(2)HS-的电离方程式:_________________________________________________。
(3)HS-的水解方程式:_________________________________________________。
(4)Cl2与NaOH溶液反应的离子方程式:________________________________。
(5)AgCl在溶液中达到溶解平衡的方程式:________________________________。
(6)甲烷的燃烧热为890.3 kJ·mol-1,则甲烷完全燃烧的热化学方程式:________。
答案:(1)NaHCO3===Na++HCO
(2)HS-H++S2-(或HS-+H2OH3O++S2-)
(3)HS-+H2OH2S+OH-
(4)Cl2+2OH-===Cl-+ClO-+H2O
(5)AgCl(s)Ag+(aq)+Cl-(aq)
(6)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
[专题强化训练]
一、单项选择题
1.化学已经渗透到人类生活的方方面面。下列说法正确的是( )
A.食盐既可做调味品,又可做防腐剂
B.去皮苹果在空气中久置变黄与纸张久置变黄原理相似
C.高纯硅广泛用作光导纤维,光导纤维遇强碱会“断路”
D.光化学烟雾的形成通常与硫的含氧化合物有关
解析:选A。纸张久置变黄是因为纸张纤维间的空隙中会渗入霉菌等或SO2的漂白失效,苹果久置变黄是因为所含酚类物质被氧化,二者原理不相同,故B错误;二氧化硅用于制作光导纤维,二氧化硅能与强碱反应,光导纤维遇强碱会“断路”,故C错误;氮氧化物是形成“光化学烟雾”的一个重要原因,故D错误。
2.我国科技创新成果斐然。下列成果中以制备非金属单质为主要目的的是( )
A
B
C
D
低温制备H2
成功开采可燃冰(CH4·nH2O)
研制出超
高强钢
合成五氮阴
离子盐
- 20 -
(N5)6(H3O)3(NH4)4Cl
解析:选A。氢气属于非金属单质;B项,可燃冰主要成分是CH4·nH2O,不属于非金属单质;C项,超高强钢属于合金,不是非金属单质;D项,五氮阴离子盐(N5)6(H3O)3(NH4)4Cl不是单质。
3.(2019·南京高三第三次模拟)下列有关化学用语表示正确是( )
A.原子核内有10个中子的氟原子:F
B.硫离子的结构示意图:
C.次氯酸钠的电子式:Na+[]-
D.葡萄糖分子的结构简式:C6H12O6
解析:选C。氟是第9号元素,所以氟原子的原子核内有9个质子,原子核内有10个中子的氟原子的质量数为19,所以该氟原子为F,选项A错误;硫离子的结构示意图应该为,选项B错误;次氯酸钠中存在Na+和ClO-,所以其电子式为Na+[]-,选项C正确;C6H12O6是葡萄糖的分子式,选项D错误。
4.共建“一带一路”符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易商品中,主要成分属于无机物的是( )
A.中国丝绸
B.捷克水晶
C.埃及长绒棉
D.乌克兰葵花籽油
解析:选B。水晶的主要成分为SiO2,属于无机物。其余选项涉及的物质主要成分均为有机物。
5.下列有关物质分类或归类正确的一组是( )
①酸性氧化物:SO2、NO、CO2、SiO2
②铝热剂、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、次氯酸均为电解质
④碘酒、牛奶、豆浆、漂白粉均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物
- 20 -
A.①③ B.②③
C.③④ D.②⑤
解析:选B。①NO不是酸性氧化物,错误;④碘酒、漂白粉不是胶体,错误;⑤液氯为单质,错误。
6.下列解释与胶体无关的是( )
A.向饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀
B.豆制品厂用石膏或盐卤点制豆腐
C.水泥厂用先进的电除尘技术除去空气中的粉尘
D.洪灾发生地的农民用明矾净化河水作为生活用水
解析:选A。A项,向饱和氯化铁溶液中逐滴加入烧碱溶液,会发生复分解反应产生氢氧化铁红褐色沉淀,不涉及胶体性质,正确;B项,用石膏或盐卤点制豆腐,利用的是胶体聚沉形成凝胶,涉及胶体性质,错误;C项,水泥厂用先进的电除尘技术除去空气中的粉尘,利用的是电泳现象,涉及胶体性质,错误;D项,用明矾净化河水,是利用铝离子水解生成的氢氧化铝胶体具有吸附作用,与胶体性质有关,错误。
7.下列诗句中的内容基本不涉及化学变化的是( )
A.王安石的《元日》:“爆竹声中一岁除,春风送暖入屠苏”
B.刘禹锡的《浪淘沙》:“美人首饰侯王印,尽是江中浪底来”
C.刘琨的《重赠卢谌》:“何意百炼钢,化为绕指柔”
D.李商隐的《无题》:“春蚕到死丝方尽,蜡炬成灰泪始干”
解析:选B。A项,爆竹的爆炸属于化学变化,错误;B项,黄金在自然界中存在游离态的单质,黄金通过浪沙淘尽获得,属于物理变化,正确;C项,铁在自然界中以化合态的形式存在,炼铁是把化合态的铁转变成游离态,涉及化学变化,错误;D项,蜡烛燃烧属于化学变化,错误。
8.央视栏目《国家宝藏》不仅彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法不正确的是( )
A.战国·“曾侯乙编钟”属于青铜制品,青铜是一种铜锡合金
B.宋·《莲塘乳鸭图》缂丝中使用的丝,主要成分是蛋白质
C.宋·王希孟《千里江山图》中的绿色颜料铜绿,主要成分是碱式碳酸铜
D.清·乾隆“瓷母”指各种釉彩大瓶,其主要成分是二氧化硅
解析:选D。青铜是铜锡合金,故A正确;丝的主要成分是蛋白质,
- 20 -
故B正确;铜绿的主要成分是碱式碳酸铜,故C正确;陶瓷是传统的硅酸盐产品,其主要成分是硅酸盐,而不是二氧化硅,故D错误。
9.(2019·泰州中考高三第四次模拟)下列有关化学用语表示正确的是( )
A.质子数为117、中子数为176的Ts原子:Ts
B.Al3+的结构示意图:
C.Na2O的电子式:Na+[]2-Na+
D.磁性氧化铁的化学式:Fe2O3
解析:选C。A.质量数=质子数+中子数,因此质子数为117、中子数为176的Ts原子表示为Ts,A错误;B.Al3+的最外层有8个电子,其正确的离子结构示意图为,B错误;C.Na2O为离子化合物,电子式为Na+[]2-Na+,C正确;D.磁性氧化铁的化学式为Fe3O4,D错误。
10.下列说法中正确的是( )
A.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
B.SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水
C.FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应
D.将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙
解析:选B。A.能与酸反应生成盐和水的氧化物是碱性氧化物,Na2O、Na2O2为相同元素组成的金属氧化物,前者属于碱性氧化物,后者不属于,A错误;B.能与碱反应生成盐和水的氧化物是酸性氧化物,SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水,B正确;C.FeO、Fe2O3均为碱性氧化物,铁离子具有氧化性,碘离子具有还原性,与氢碘酸反应时前者只发生复分解反应,后者发生氧化还原反应,C错误;D.将Fe(OH)3胶体和泥水分别进行过滤,胶体分散质能通过滤纸孔隙,浊液中分散质不能,D错误。
11.分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列(2)中的物质不能按照对应的分类标准与(1)中的物质归为一类的是( )
选项
(1)
(2)
分类标准
A
盐酸、漂白粉、水玻璃、双氧水
氯水
混合物
B
CH3COOH、H2CO3、HClO、NH3·H2O
HF
弱电解质
C
原电池反应、盐的水解、煤的干馏、石油裂解
钢铁生锈
化学变化
- 20 -
D
CO2、SO3、P2O5、SiO2
Al2O3
酸性
氧化物
解析:选D。A.氯水是混合物,(1)中物质都属于混合物,能把氯水划分到(1)中,故说法正确;B.HF是弱酸,(1)中物质都是弱电解质,能把HF划分到(1)中,故说法正确;C.钢铁生锈属于化学变化,(1)中变化都是化学变化,能把钢铁生锈划分到(1)中,故说法正确;D.Al2O3属于两性氧化物,(1)中物质都属于酸性氧化物,不能把Al2O3划分到(1)中,故说法错误。
12.(2015·高考江苏卷)下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:Cl
B.氯离子(Cl-)的结构示意图:
C.氯分子的电子式:
D.氯乙烯分子的结构简式:H3C—CH2Cl
解析:选C。A选项,氯原子符号左上角的数据应是质量数,其质量数为37,所以错误;B选项,氯离子的最外层电子数应为8,所以错误;C选项,电子式表示符合要求,所以正确;D选项,结构简式表示的是氯乙烷而不是氯乙烯,所以错误。
二、不定项选择题
13.一种高品质的磷矿石——鸟粪石的化学式为NH4MgPO4,下列关于该物质的结构和性质的推测中不合理的是( )
A.鸟粪石既属于镁盐又属于磷酸盐
B.鸟粪石既能和强酸反应又能和强碱反应
C.鸟粪石中既含有离子键又含有共价键
D.鸟粪石中两种阳离子的电子式分别为[]2+、
解析:选D。Mg2+是镁原子失去最外层电子后形成的,其电子式为Mg2+,D错误。
14.(2019·苏锡常镇四市高三调研)下列有关化学用语的表示,正确的是( )
A.氨基(—NH2)的电子式:HH
B.钾离子的结构示意图:
C.二氧化碳分子的比例模型:
- 20 -
D.碳酸的电离方程式:H2CO3CO+2H+
解析:选A。A.氨基(—NH2)的电子式为HH,A正确;B.钾离子的结构示意图为,B错误;C.碳原子半径大于氧原子半径,该模型不能表示二氧化碳分子,C错误;D.碳酸是二元弱酸,分步电离,以第一步电离为主:H2CO3HCO+H+,D错误。
15.中国炼丹家约在唐代或五代时期掌握了以炉甘石点化鍮石(即鍮石金)的技艺:将炉甘石(ZnCO3)、赤铜矿(主要成分Cu2O)和木炭粉混合加热至800 ℃左右可制得与黄金相似的鍮石金。则下列说法错误的是( )
A.鍮石金是铜锌合金
B.炉甘石点化鍮石过程包含分解反应、置换反应
C.可用稀盐酸鉴别鍮石金和黄金
D.炉甘石点化鍮石过程不涉及氧化还原反应
解析:选D。
16.《证类本草》中记载:“鸡屎矾(碱式碳酸铜)不入药用,惟堪镀作,以合熟铜;投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变。”下列关于该描述的说法正确的是( )
A.“不入药用”的主要原因是鸡屎矾难溶于酸
B.“惟堪镀作,以合熟铜”指的是电镀铜技术
C.“投苦酒(醋)中,涂铁皆作铜色”涉及两个化学反应
D.“外虽铜色,内质不变”描述的是铁钝化的过程
解析:选C。A项是由于碱式碳酸铜溶于胃酸,产生重金属离子Cu2+,故“不入药用”;B项应是湿法炼铜,与电镀无关;C项涉及的两个反应分别是碱式碳酸铜溶于醋酸和Fe与Cu2+的置换反应;D项是铜保护了铁,不是铁的钝化。
17.(2019·连云港高三检测)下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:NaNa
B.质子数为35、中子数为45的溴原子:Br
- 20 -
C.氯离子的结构示意图:
D.对二甲苯的结构简式:
解析:选BD。A.Na2O2是离子化合物,其电子式为
Na+[]2-Na+。C.氯原子核外有17个电子,其结构示意图为 ,在反应中易得到1个电子形成Cl-,故Cl-的结构示意图为。
18.下列有关叙述正确的是( )
A.“一代材料,一代飞机”,国产大飞机C919中使用了素有“现代工业骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料
B.离子交换膜在工业上应用广泛,如氯碱工业中使用阳离子交换膜
C.获得2015年诺贝尔生理学或医学奖的屠呦呦女士用乙醚提取出了青蒿素,该技术应用了萃取原理
D.酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化
解析:选BC。碳纤维不属于有机高分子材料,A不正确;焰色反应属于物理变化,D不正确。
- 20 -
相关文档
- 2018届一轮复习人教版物质的组成、2021-08-2321页
- 2019届二轮复习专题一物质的组成、2021-08-2359页
- 课标版2021高考化学一轮复习专题一2021-08-0614页
- 2021高三化学人教版一轮学案:第二章2021-08-0632页
- 2020届二轮复习物质的组成和类别、2021-08-0617页
- 重庆市2021高考化学一轮复习专题二2021-08-0626页
- 2020届二轮复习物质的组成、分类及2021-08-0612页
- 山东版2021高考化学一轮复习专题一2021-08-068页
- 2021高考化学一轮复习专题一物质的2021-08-0610页
- 2018届二轮复习物质的组成、性质、2021-08-06105页