- 623.33 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专项突破
1
与量相关的离子
方程式书写
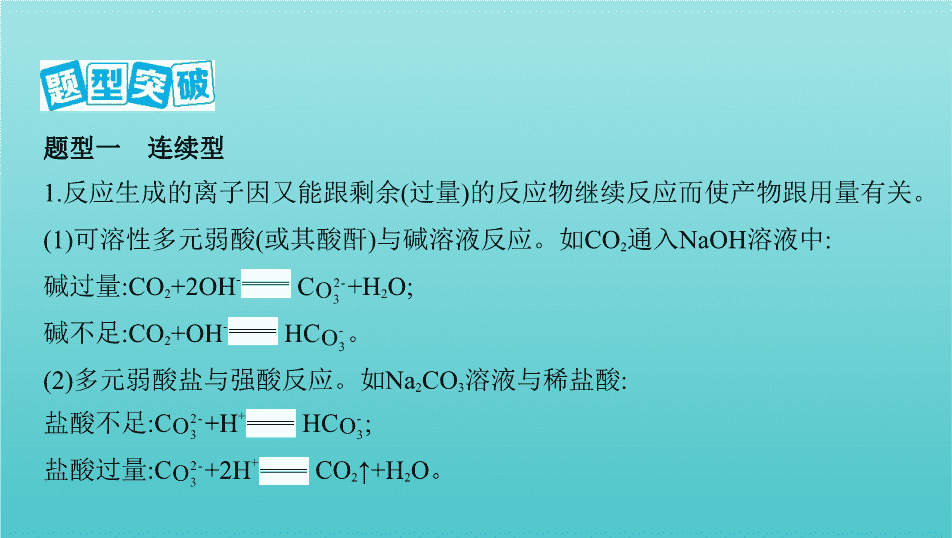
题型一 连续型
1.反应生成的离子因又能跟剩余(过量)的反应物继续反应而使产物跟用量有关。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如CO
2
通入NaOH溶液中:
碱过量:CO
2
+2OH
-
C
+H
2
O;
碱不足:CO
2
+OH
-
HC
。
(2)多元弱酸盐与强酸反应。如Na
2
CO
3
溶液与稀盐酸:
盐酸不足:C
+H
+
HC
;
盐酸过量:C
+2H
+
CO
2
↑+H
2
O。
题型二 先后型
2.一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离
子反应,但因反应次序不同而使产物跟用量有关,又可称为竞争型。
(1)NH
4
HSO
4
溶液与NaOH溶液的反应:
NaOH不足:H
+
+OH
-
H
2
O;
NaOH过量:N
+H
+
+2OH
-
NH
3
·H
2
O+H
2
O。
(2)向含有OH
-
、C
的溶液中,逐滴加入稀盐酸至过量,反应的离子方程式依
次为:
OH
-
+H
+
H
2
O;
C
+H
+
HC
,HC
+H
+
CO
2
↑+H
2
O。
3.当一种反应物中有两种或两种以上的组成离子参与反应时,因其组成比例
不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成
离子不能恰好完全反应(有剩余或不足),因而使产物与用量有关。
(1)Ca(HCO
3
)
2
溶液与NaOH溶液反应:
NaOH不足:Ca
2+
+HC
+OH
-
CaCO
3
↓+H
2
O;
NaOH过量:Ca
2+
+2HC
+2OH
-
CaCO
3
↓+2H
2
O+C
。
(2)NaHCO
3
溶液与Ca(OH)
2
溶液反应:
NaHCO
3
不足:HC
+OH
-
+Ca
2+
CaCO
3
↓+H
2
O;
NaHCO
3
过量:Ca
2+
+2OH
-
+2HC
CaCO
3
↓+C
+2H
2
O。
题型三 配比型
(3)Ba(OH)
2
溶液与NaHSO
4
溶液的反应:
n
[Ba(OH)
2
]∶
n
(NaHSO
4
)=1∶1
Ba
2+
+OH
-
+H
+
+S
BaSO
4
↓+H
2
O,此时溶液呈碱性;
n
[Ba(OH)
2
]∶
n
(NaHSO
4
)=1∶2
Ba
2+
+2OH
-
+2H
+
+S
BaSO
4
↓+2H
2
O,此时溶液呈中性,若向该溶液中再
加Ba(OH)
2
溶液,发生反应的离子方程式为S
+Ba
2+
BaSO
4
↓。
名师点拨
“定一法”书写酸式盐与碱反应的离子方程式
(1)根据相对量将少量物质定为“1 mol”,若少量物质有两种或两种以上的
离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。
(2)依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的
物质的量。
(3)依据“先中和后沉淀”的思路正确书写离子方程式。
题型四 范围型
4.向含
a
mol NaOH的溶液中通入
b
mol CO
2
,按要求书写离子方程式:
(1)
≥
2时,2OH
-
+CO
2
C
+H
2
O;
(2)
=
时,3OH
-
+2CO
2
C
+HC
+H
2
O;
(3)
a
≤
b
时,CO
2
+OH
-
HC
。
5.向含物质的量均为
a
mol的NaOH、Ba(OH)
2
混合溶液中通入
b
mol CO
2
气体,
按要求书写离子方程式:
(1)
<1时,CO
2
+Ba
2+
+2OH
-
BaCO
3
↓+H
2
O;
(2)
=
时,3CO
2
+6OH
-
+2Ba
2+
2BaCO
3
↓+C
+3H
2
O;
(3)
=2时,2CO
2
+3OH
-
+Ba
2+
BaCO
3
↓+HC
+H
2
O;
(4)
>3时,CO
2
+OH
-
HC
。
6.向含有
a
mol NH
4
HSO
4
的溶液中加入
b
mol NaOH,按要求书写离子方程式:
(1)
≥
1时,H
+
+OH
-
H
2
O;
(2)
=
时,4H
+
+N
+5OH
-
4H
2
O+NH
3
·H
2
O;
(3)1
≤
≤
时,(
b
-
a
)N
+
a
H
+
+
b
OH
-
(
b
-
a
)NH
3
·H
2
O+
a
H
2
O;
(4)
<
<1时,OH
-
+H
+
H
2
O。
1.(2019重庆西南大学附中月考)下列离子方程式的书写及评价均合理的是
(
D
)
选项
离子方程式
评价
A
将2 mol Cl
2
通入含1 mol FeI
2
的溶液中:2Fe
2+
+2I
-
+2Cl
2
2Fe
3+
+4Cl
-
+I
2
正确,Cl
2
过量,可将Fe
2+
、I
-
均氧化
B
Ba(HCO
3
)
2
溶液与足量的NaOH溶液反应:Ba
2+
+
HC
+OH
-
BaCO
3
↓+H
2
O
正确,酸式盐与碱反应生成正盐和水
C
将过量SO
2
通入NaClO溶液中:SO
2
+H
2
O+ClO
-
HClO+HS
正确,说明酸性:H
2
SO
3
强于HClO
D
1 mol/L 的NaAlO
2
溶液和2.5 mol/L 的HCl溶液
等体积混合:2Al
+5H
+
Al
3+
+Al(OH)
3
↓+
H
2
O
正确,第一步反应和第二步反应消耗H
+
的物质
的量之比为2∶3
解析
将2 mol Cl
2
通入含1 mol FeI
2
的溶液中,氯气过量,亚铁离子和碘离
子都被氧化,离子方程式为2Fe
2+
+4I
-
+3Cl
2
2Fe
3+
+6Cl
-
+2I
2
,A错误;Ba(HCO
3
)
2
溶液与足量的NaOH溶液反应生成碳酸钡、碳酸钠和水,离子方程式为Ba
2+
+2
HC
+2OH
-
BaCO
3
↓+C
+2H
2
O,B错误;SO
2
有还原性,ClO
-
有强氧化性,
过量SO
2
通入NaClO溶液中,发生氧化还原反应,离子方程式为SO
2
+H
2
O+ClO
-
2H
+
+S
+Cl
-
,C错误;1 mol/L 的NaAlO
2
溶液和2.5 mol/L 的HCl溶液等体
积混合,离子方程式为2Al
+5H
+
Al
3+
+Al(OH)
3
↓+H
2
O,D正确。
2.向含1 mol NaHCO
3
的溶液中逐滴加入含
b
mol Ca(OH)
2
的溶液,充分反应。
下列说法不正确的是
(
B
)
A.滴加Ca(OH)
2
溶液立即有沉淀生成
B.当
b
=0.5时,发生反应:HC
+OH
-
+Ca
2+
CaCO
3
↓+H
2
O
C.当
b
=1时,反应后的溶液中几乎不存在Ca
2+
D.当
b
=1.5时,向溶液中再通入少量CO
2
,还会有沉淀生成
解析
向含1 mol NaHCO
3
的溶液中滴加Ca(OH)
2
溶液,随Ca(OH)
2
物质的
量的增多,反应的化学方程式依次为①2NaHCO
3
+Ca(OH)
2
CaCO
3
↓+
2H
2
O+Na
2
CO
3
和②NaHCO
3
+Ca(OH)
2
CaCO
3
↓+H
2
O+NaOH。滴加Ca(OH)
2
溶液立即有白色沉淀生成,故A正确;当
n
(NaHCO
3
)∶
n
[Ca(OH)
2
]=2∶1时,发生
反应①,故B不正确;当
b
=1时,发生反应②,所以溶液中几乎没有Ca
2+
,故C正确;
当
b
=1.5时,Ca(OH)
2
过量,则通入少量CO
2
会生成CaCO
3
沉淀,故D正确。
3.向含
a
mol Ba(OH)
2
的溶液中逐滴加入含
b
mol NaHCO
3
的溶液,充分反应(不
考虑盐类的水解及沉淀溶解)。下列说法不正确的是
(
C
)
A.
a
=2
b
时,生成沉淀98.5
a
g
B.
a
≤
b
≤
2
a
时,溶液中含
n
(NaOH)∶
n
(Na
2
CO
3
)=(2
a
-
b
)∶(
b
-
a
)
C.0<
b
<2
a
时,沉淀质量随着NaHCO
3
的加入而不断增加
D.
b
=
a
时,总反应的离子方程式:3HC
+2Ba
2+
+3OH
-
2BaCO
3
↓+C
+3
H
2
O
解析
A项,发生反应:Ba
2+
+OH
-
+HC
BaCO
3
↓+H
2
O,生成沉淀197
b
g,即98.5
a
g;B项,发生反应:
Ba(OH)
2
+NaHCO
3
BaCO
3
↓+NaOH+H
2
O
a
mol
a
mol
a
mol
NaHCO
3
+ NaOH
Na
2
CO
3
+H
2
O
(
b
-
a
) mol (
b
-
a
) mol (
b
-
a
) mol
所以
n
(NaOH)∶
n
(Na
2
CO
3
)=(2
a
-
b
)∶(
b
-
a
);C项,当
b
=
a
时,沉淀质量即达到最大
值;D项,由
=
,可得总反应的离子方程式为3HC
+2Ba
2+
+3OH
-
2BaCO
3
↓+C
+3H
2
O。
4.已知还原性I
-
>Fe
2+
>I
2
,在水溶液中I
2
可被Cl
2
氧化为I
。向含
a
mol FeI
2
的溶
液中通入
b
mol Cl
2
,充分反应(不考虑单质与水的反应)。下列说法不正确的
是
(
D
)
A.当
a
=2
b
时,反应后的离子浓度之比:
c
(Fe
2+
)∶
c
(I
-
) ∶
c
(Cl
-
)=1∶1∶1
B.当3
a
=2
b
时,发生的离子反应:2Fe
2+
+4I
-
+3Cl
2
2Fe
3+
+2I
2
+6Cl
-
C.当13
a
=2
b
时,发生的离子反应:2Fe
2+
+4I
-
+13Cl
2
+12H
2
O
4I
+26Cl
-
+2Fe
3+
+24H
+
D.若反应后溶液中I
2
与I
的物质的量之比为1∶1,则反应中转移电子3.5
b
mol
解析
A项,当
a
=2
b
时,有
的I
-
被氧化,而Fe
2+
还未被氧化,
c
(Fe
2+
)∶
c
(I
-
)∶
c
(Cl
-
)=
1∶1∶1;B项,当3
a
=2
b
时,FeI
2
恰好被氧化为Fe
3+
、I
2
;C项,当13
a
=2
b
时,生
成的I
2
恰好全部被氧化成I
;D项,转移电子数目可由Cl
2
计算得到,即2
b
mol。
5.已知氧化性:Br
2
>Fe
3+
>I
2
,向含有
a
mol FeI
2
的溶液中加入含
b
mol Br
2
的溴水,
下列判断或相应的离子方程式正确的是
(
C
)
A.当
a
=2,
b
=1时,反应的离子方程式为2Fe
2+
+Br
2
2Fe
3+
+2Br
-
B.如果反应后的溶液中存在
c
(Fe
2+
)=
c
(Fe
3+
),则
<
<1
C.当
a
=1,
b
=2时,反应的离子方程式为2Fe
2+
+4I
-
+3Br
2
2Fe
3+
+2I
2
+6Br
-
D.当
a
=2,2<
b
<3时,溶液中铁元素以两种离子形式存在,且一定存在
c
(Fe
3+
)>
c
(Fe
2+
)
解析
根据三种物质的氧化性可知,若
a
=2,
b
=1,此时Br
2
相对于FeI
2
不足,
Br
2
仅能氧化I
-
,不能氧化Fe
2+
,发生反应:2I
-
+Br
2
I
2
+2Br
-
,A错误;若存在
c
(Fe
2
+
)
=
c
(Fe
3+
),设生成Fe
3+
x
mol,根据反应物的关系则有:
a
-
x
=
x
,
b
=
a
+
,计算得出:
b
=
,B错误;
a
=1,
b
=2时,发生反应:2Fe
2+
+4I
-
+3Br
2
2Fe
3+
+2I
2
+6Br
-
,C正确;D项
中可能存在
c
(Fe
2+
)>
c
(Fe
3+
),D错误。
相关文档
- 广东省2021高考化学一轮复习专题六2021-08-2335页
- 2021版高考化学一轮复习专题3金属2021-08-2386页
- 湖南版2021高考化学一轮复习专题12021-08-2326页
- 2021版高考化学一轮复习专题4非金2021-08-23153页
- 2021版高考化学一轮复习专题质量评2021-08-2325页
- 2021版高考化学一轮复习专题10化学2021-08-2339页
- 2021版高考化学一轮复习专题3金属2021-08-23110页
- 2021高考化学一轮复习专题9第3讲物2021-08-23105页
- 2021高考化学一轮复习专题质检卷102021-08-238页
- 北京版2021高考化学一轮复习专题五2021-08-2318页