- 1.14 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 原子结构和核外电子排布
考点基础
一、原子结构
1.原子结构模型的演变
对原子结构模型的猜想经历了下列演变:
道尔顿
“实心球式”模型→
汤姆
生
“葡萄干面包式”模型→
卢瑟福
“行星绕太阳核式”模型→
玻尔
“电
子分层运动式” 模型→原子的“电子云”模型。人类认识原子的过程是
漫长的,也是无止境的。
考点清单
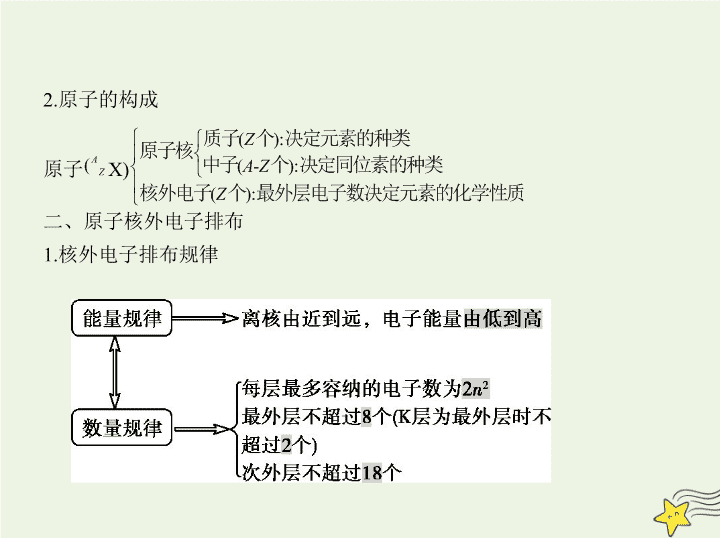
2.原子的构成
原子
X)
二、原子核外电子排布
1.核外电子排布规律
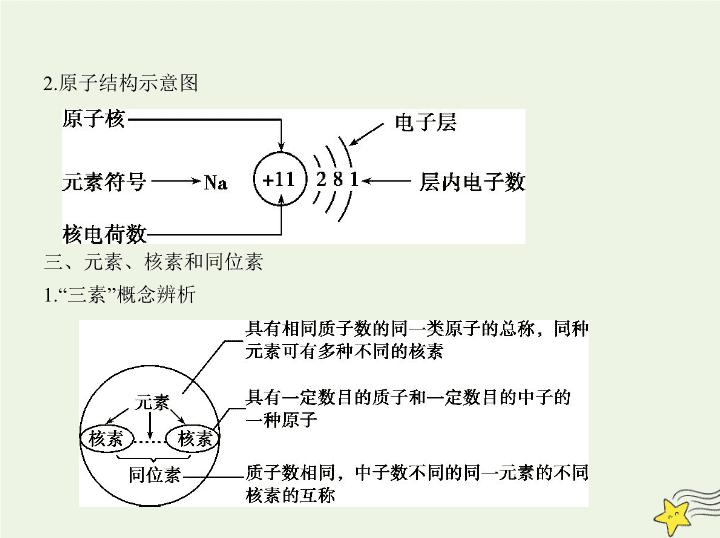
2.原子结构示意图
三、元素、核素和同位素
1.“三素”概念辨析
2.同位素的特征与应用
(1)同位素的特征
a.化学性质几乎完全相同,物理性质不同。
b.天然存在的同一元素各核素所占的原子百分数一般不变。
(2)常见的重要核素及其应用
核素
U
C
H
H
O
用途
核燃料
用于考古断代
制氢弹
示踪原子
考点二 元素周期律与元素周期表
考点基础
一、元素周期律
1.原子序数:按核电荷数由小到大的顺序给元素编号,这种编号叫作原子序
数。在原子中,原子序数=①
核电荷
数=②
质子
数=③
核外电子
数。
2.元素周期律
(1)内容:元素的性质随着元素④
核电荷数
的递增而呈⑤
周期性
变
化的规律。
(2)具体表现
a.随着核电荷数的递增,元素的原子最外层电子排布呈现⑥
由1→8
的
周期性变化(第一周期除外)。
b.随着核电荷数的递增,元素的原子半径呈现⑦
由大→小
的周期性变
化(稀有气体元素除外)。
c.随着核电荷数的递增,主族元素的主要化合价呈现最高正价⑧
由+1→
+7
(O、F除外)、最低负价⑨
由-4→-1
的周期性变化,且同一非金属
元素化合价有如下关系:最高正价+最低负价的绝对值=⑩
8
(H、O、F
除外)。
3.实质:原子
核外电子排布
呈现周期性变化决定了元素性质的周期
性变化。
4.主族元素性质的递变规律
内容
同周期元素
(左→右)
同主族元素
(上→下)
电子层数
相同
增多
最外层
电子数
由1个→8个(第一周期除外)
相同
原子半径
逐渐减小(0族除外)
逐渐增大
元素的主
要化合价
最高正价由+1→+7(ⅠA族→Ⅶ
A族)(氧、氟除外)
同一元素的|最低负价|+最高正
价=8(氢、氧、氟除外)
最高正价=
族序数
(氧、氟除外)
金属性与
非金属性
金属性减弱
非金属性
增强
金属性
增强
非金属性减弱
单质还原性
与氧化性
还原性减弱
氧化性增强
还原性增强
氧化性减弱
非金属元素
气态氢化物的
生成及稳定性
生成由难到易
稳定性由
弱
到
强
生成由易到难
稳定性由强到弱
原子得、失
电子能力
失:强→弱;得:弱→强
得:强→弱;
失:弱→强
内容
同周期元素
(左→右)
同主族元素
(上→下)
续表
二、元素周期表及其应用
1.元素周期表的结构(7个周期,16个族)
2.元素周期表的应用
(1)预测元素的性质
常见题目是给出一种不常见的主族元素,推测该元素及其单质或化合物所
具有的性质,如下图所示:
(2)启发人们在周期表一定区域内寻找某些特殊材料
重点突破
1.元素在周期表中的位置与原子结构、元素性质的关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在
周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可
相互推断。
2.比较元素金属性强弱的方法
(1)金属与水(或非氧化性酸)的反应越容易,其对应元素的金属性越强。
(2)最高价氧化物对应水化物的碱性越强,则对应金属元素的金属性越强。
(3)在金属活动性顺序中,金属的位置越靠前,其金属性越强。
(4)同一周期,金属元素越靠前,其金属性越强;同一主族,金属元素越靠下,其
金属性越强。
(5)金属与盐溶液的置换反应,若A元素的单质能置换出B元素的单质,则A
元素的金属性强于B元素。
(6)一般金属阳离子的氧化性越强,则对应金属元素的金属性越弱。(注:氧
化性Fe
3+
>Cu
2+
>Fe
2+
,金属性Fe>Cu)
(7)电化学原理:不同金属形成原电池时,通常负极金属的金属性强;通常在
电解池的阴极上,先析出的金属的金属性弱。
3.比较元素非金属性强弱的方法
(1)非金属单质与H
2
越易化合,则其对应元素的非金属性越强。
(2)形成的氢化物越稳定,则其对应元素的非金属性越强。
(3)最高价氧化物对应水化物的酸性越强,其对应元素的非金属性越强。
(4)同一周期(稀有气体元素除外),非金属元素越靠右,其非金属性越强;同
一主族,非金属元素越靠上,其非金属性越强。
(5)非金属之间的置换反应,若A元素的单质能置换出B元素的单质,则A元
素的非金属性强于B元素。
考点三 微粒之间的相互作用和物质的多样性
考点基础
一、化学键
1.化学键
(1)概念:物质中①
直接相邻
的原子或离子之间存在的强烈的相互作
用。
(2)分类
化学键
2.离子键和共价键
键型
共价键
离子键
概念
原子间通过⑥
共用电子对
所形成的强烈的相互作用
使带相反电荷的阴、阳离子结
合的相互作用
成键微粒
⑦
原子
⑧
阴、阳离子
成键原因
原子有形成稳定结构的趋势
成键方式
共用电子对
阴、阳离子间的⑨
静电
作
用
成键元素
一般为⑩
非金属
元素
一般为
活泼金属元素
(通
常指ⅠA族、ⅡA族元素)与活
泼
非金属元素
(通常指Ⅵ
A族、ⅦA族元素)
存在实例
部分单质中:Cl
2
、金刚石等;共
价化合物中:HCl、CO
2
、H
2
SO
4
等;部分离子化合物中:NH
4
Cl、
NaOH、Na
2
O
2
等
离子化合物中:NaOH、KOH、
NaCl、CaCl
2
、Na
2
SO
4
、Na
2
O、
CaO等
续表
键型
共价键
离子键
3.电子式
(1)电子式概念
在元素符号周围用“·”或“
×
”来表示原子的最外层电子(价电子)的式
子。
(2)电子式书写方法
(3)用电子式表示化合物的形成过程
1)离子化合物:左边是原子的电子式,右边是离子化合物的电子式,中间用
“
”连接,相同的原子或离子不合并。
如NaCl:
。
2)共价化合物:左边是原子的电子式,右边是共价化合物的电子式,中间用
“
”连接。
如HCl:
。
CO
2
H
2
O
NH
3
CH
4
球棍模型
比例模型
空间构型
直线形
V形
三角锥形
正四面体形
4.常见共价分子的结构模型和空间构型
二、分子间作用力和氢键
1.分子间作用力
(1)概念:
分子
间存在着将分子聚集在一起的作用力,这种作用力称
为分子间作用力,分子间作用力包括
范德华力
和
氢键
。
(2)特征
①分子间作用力比化学键
弱得多
,比化学键小1~2个数量级。
②分子间作用力主要影响物质的
熔、沸点
和
溶解性
等物理
性质,而
化学键主要影响物质的化学性质
。如水从液态转化为气态只需要
克服分子间作用力,不需要破坏化学键。一般地,
组成和结构相似的由分子
构成的物质,相对分子质量越大,分子间作用力越强,熔、沸点越高。
(3)存在
一般存在于大多数共价化合物和非金属单质的分子之间,如H
2
O、P
4
等;也
可以存在于混合物的不同分子间,如液态空气中N
2
和O
2
分子之间。
2.氢键
(1)概念:分子间存在着一种比范德华力
稍强
的相互作用即氢键。
(2)形成条件:除H原子外,形成氢键的原子通常是
N、O、F
。
(3)存在作用:分子间氢键会使物质的熔点和沸点
升高
。
(4)实例:水分子间的氢键,是一个水分子中的氢原子与另一个水分子中的
氧原子之间所形成的分子间作用力。水分子间的氢键使水分子间作用力
增强,因此水有较高的沸点。
三、常见晶体的类型及性质
1.离子晶体
(1)构成离子晶体的基本微粒是
阴、阳离子
,不存在单个的
分
子
,因此离子晶体只能以化学式表示,而无分子式,在化学式中也只能表
示阴、阳离子的个数比。
(2)离子晶体是通过较强的
离子键
形成的,破坏它需
较高
的
能量,因此离子晶体的熔、沸点
较高
。
2.原子晶体和分子晶体
(1)构成原子晶体的微粒是
原子
,其化学式也只能表示各
原子
的个数比
。
(2)分子晶体中有真正的
分子
存在。分子与分子之间依靠
分子
间作用力
结合在一起,在分子内部则是原子之间通过
共价键
结合
在一起,稀有气体分子除外。
3.几种重要的晶体结构
晶体
微粒的空间排列
晶体
类型
构成晶体
的微粒
微粒间的
相互作用力
NaCl
离子
晶体
Na
+
、Cl
-
(离子)
离子键
金刚石
原子
晶体
碳原子
共价键
足球烯
分子
晶体
C
60
分子
分子间
作用力
干冰
分子
晶体
CO
2
分子
分子间
作用力
石英
原子
晶体
Si、O原子
共价键
续表
晶体
微粒的空间排列
晶体
类型
构成晶体
的微粒
微粒间的
相互作用力
重点突破
1.化学键的存在形式
要分清离子键和共价键的本质、含义及表示方法,明确化学键的意义,要弄
清以下五个问题:
(1)由金属元素原子与非金属元素原子形成的化学键不一定是离子键。如
BeCl
2
、AlCl
3
等都只含有共价键,它们是共价化合物。
(2)由阳离子和阴离子结合生成的化合物不一定是离子化合物。如H
+
+OH
-
H
2
O中H
2
O不是离子化合物。
(3)由两种共价化合物结合生成的化合物不一定是共价化合物。如NH
3
+
HCl
NH
4
Cl中NH
4
Cl为离子化合物。
(4)有化学键被破坏的变化不一定是化学变化。如HCl溶于水,NaCl熔化等
都有化学键被破坏,但都属于物理变化。
(5)用化学键强弱可解释物质的化学性质,也可解释部分物质的物理性质。
如比较金刚石、晶体硅的熔点高低要用化学键强弱来解释。而HF、
HCl、HBr、HI中的化学键强弱只能解释其化学性质,它们的物理性质与H
—X(X表示卤素原子)键的强弱无关。
2.离子化合物、共价化合物的判断方法
[注意] ①存在离子键的化合物一定是离子化合物。
②离子化合物中一定存在离子键,可能存在共价键,如NaOH、Na
2
O
2
、
(NH
4
)
2
SO
4
等。
③共价化合物中只有共价键,一定没有离子键。
④熔化时导电的化合物一定是离子化合物。
⑤全部由非金属元素组成的化合物可能是离子化合物,如NH
4
Cl、NH
4
NO
3
等铵盐;也可能是共价化合物,如HCl、H
2
S等。由金属元素和非金属元素
形成的化合物也可能是共价化合物,如AlCl
3
。
方法
推断元素的思路和方法
1.根据原子结构、元素周期表的知识及相关已知条件,可推算原子序数,判
断元素在元素周期表中的位置等,基本思路如下:
方法技巧
2.推断元素的常见“题眼”(突破口)
(1)微粒的电子层结构特征
一般地,稀有气体原子的电子层结构与同周期的非金属元素形成的阴离子
的电子层结构相同,与下一周期的主族金属元素形成的阳离子的电子层结
构相同:①与He原子电子层结构相同的离子有H
-
、Li
+
、Be
2+
;②与Ne原子
电子层结构相同的离子有F
-
、O
2-
、Na
+
、Mg
2+
、Al
3+
等;③与Ar原子电子层
结构相同的离子有Cl
-
、S
2-
、K
+
、Ca
2+
等。
(2)周期表中特殊位置的常见元素
a.族序数等于周期数的元素:H、Be、Al、Ge等。
b.族序数等于周期数2倍的元素:C、S。
c.族序数等于周期数3倍的元素:O。
d.周期数是族序数2倍的元素:Li、Ca等。
e.周期数是族序数3倍的元素:Na、Ba。
f.最高正价与最低负价代数和为零的短周期元素:C、Si。
g.最高正价是最低负价绝对值3倍的短周期元素:S。
h.除H外,原子半径最小的元素:F。
i.短周期中离子半径最大的元素:P。
(3)常见元素及其化合物的特性
a.形成化合物种类最多的元素:C;自然界中硬度最大的物质:金刚石;C的气
态氢化物中H的质量分数最高的物质:CH
4
。
b.空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
c.地壳中含量最多的元素:O。
d.单质最轻的元素:H;单质最轻的金属元素:Li。
e.单质在常温下呈液态的非金属元素:Br;金属元素:Hg。
f.最高价氧化物及最高价氧化物对应水化物既能与强酸反应,又能与强碱
反应的元素:Al。
g.元素的气态氢化物和它的最高价氧化物的水化物能起化合反应的元素:
N;能起氧化还原反应的元素:S。
h.元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
相关文档
- 2021版高考化学一轮复习专题5微观2021-08-0668页
- 2021高考化学一轮复习专题质检卷62021-08-0610页
- 2020版高中化学 专题1 微观结构与2021-08-0616页
- 2021届一轮复习人教版专题5 微观2021-07-0914页
- 2018届一轮复习苏教版专题五微观结2021-07-0839页
- 高考化学总复习教师用书配套专题整2021-07-0828页
- 2021版新高考化学一轮复习专题5微2021-07-0839页
- 2021版新高考化学一轮复习专题5微2021-07-0843页
- 江苏版2021高考化学一轮复习专题52021-07-0814页
- 2021版新高考化学一轮复习专题5微2021-07-0865页