- 331.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
- 1 -
化学反应为人类提供能量
1.下列有关说法中正确的是( )
A.能量的转化是相互的
B.物质在氧气中燃烧时,化学能只转化为光能
C.植物的光合作用是将化学能转化为生物能
D.旧化学键断裂所放出的能量大于形成新化学键吸收的能量时,反应放热
答案 A
解析 物质燃烧时,化学能不仅转化为光能,也转化为热能,故 B 项错误;光合作用是
将光能转化为化学能,故 C 项错误;旧化学键断裂需要吸收能量,形成新化学键释放能量,
故 D 项错误;能量的转化是相互的,如电能可转化为化学能,化学能也可转化为电能,热能
可转化为化学能,化学能也可转化为热能等,故 A 项正确。
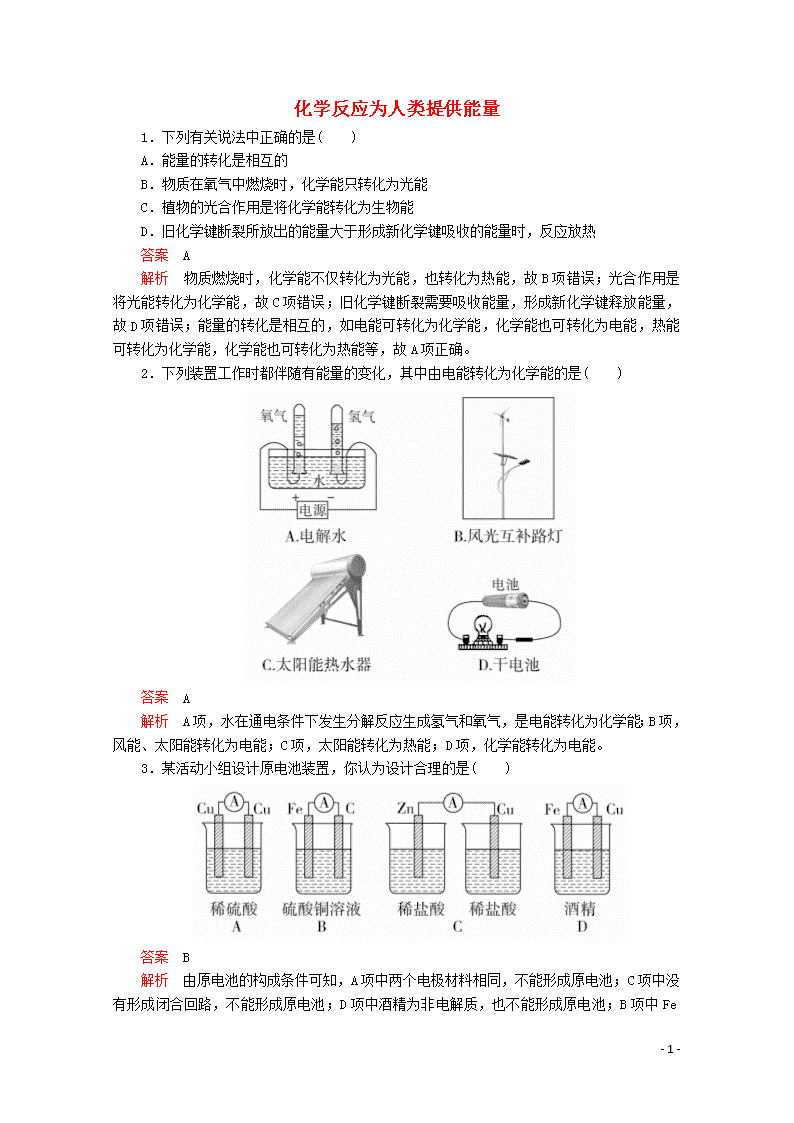
2.下列装置工作时都伴随有能量的变化,其中由电能转化为化学能的是( )
答案 A
解析 A 项,水在通电条件下发生分解反应生成氢气和氧气,是电能转化为化学能;B 项,
风能、太阳能转化为电能;C 项,太阳能转化为热能;D 项,化学能转化为电能。
3.某活动小组设计原电池装置,你认为设计合理的是( )
答案 B
解析 由原电池的构成条件可知,A 项中两个电极材料相同,不能形成原电池;C 项中没
有形成闭合回路,不能形成原电池;D 项中酒精为非电解质,也不能形成原电池;B 项中 Fe
- 2 -
与 CuSO4 溶液能发生氧化还原反应,且形成闭合回路,符合原电池的构成条件,故选 B。
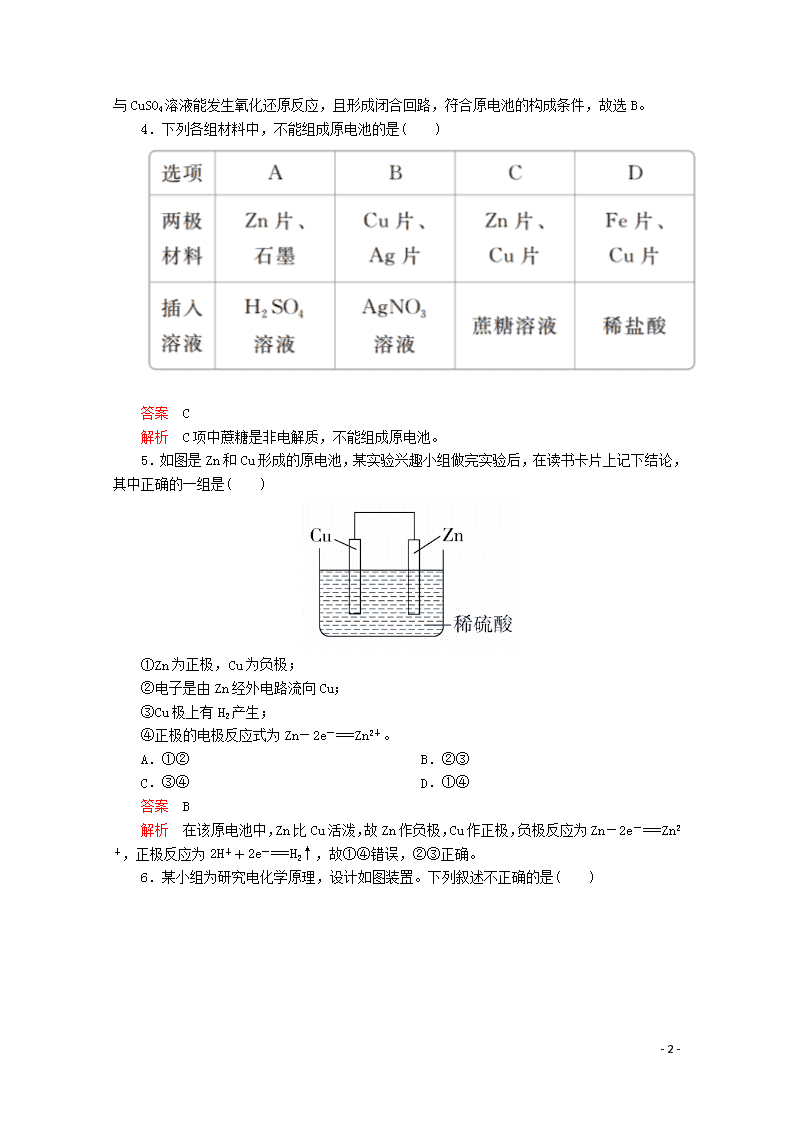
4.下列各组材料中,不能组成原电池的是( )
答案 C
解析 C 项中蔗糖是非电解质,不能组成原电池。
5.如图是 Zn 和 Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记下结论,
其中正确的一组是( )
①Zn 为正极,Cu 为负极;
②电子是由 Zn 经外电路流向 Cu;
③Cu 极上有 H2 产生;
④正极的电极反应式为 Zn-2e-===Zn2+。
A.①② B.②③
C.③④ D.①④
答案 B
解析 在该原电池中,Zn 比 Cu 活泼,故 Zn 作负极,Cu 作正极,负极反应为 Zn-2e-===Zn2
+,正极反应为 2H++2e-===H2↑,故①④错误,②③正确。
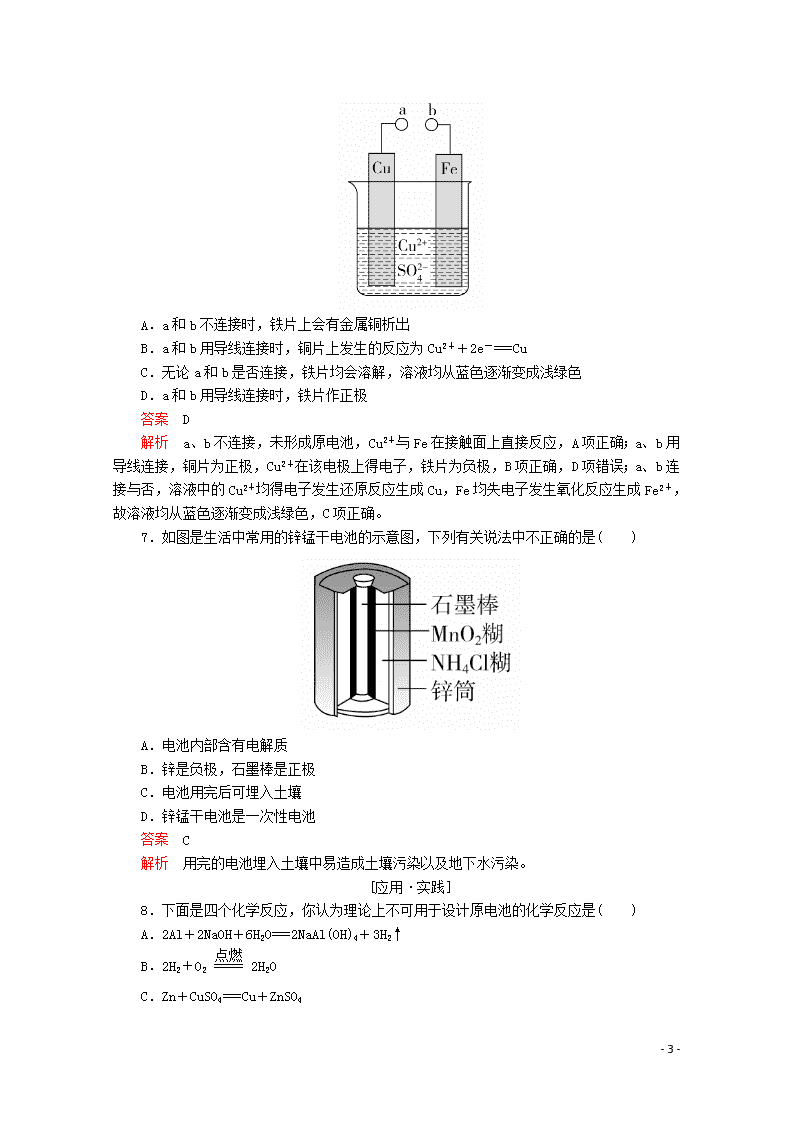
6.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
- 3 -
A.a 和 b 不连接时,铁片上会有金属铜析出
B.a 和 b 用导线连接时,铜片上发生的反应为 Cu2++2e-===Cu
C.无论 a 和 b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a 和 b 用导线连接时,铁片作正极
答案 D
解析 a、b 不连接,未形成原电池,Cu2+与 Fe 在接触面上直接反应,A 项正确;a、b 用
导线连接,铜片为正极,Cu2+在该电极上得电子,铁片为负极,B 项正确,D 项错误;a、b 连
接与否,溶液中的 Cu2+均得电子发生还原反应生成 Cu,Fe 均失电子发生氧化反应生成 Fe2+,
故溶液均从蓝色逐渐变成浅绿色,C 项正确。
7.如图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
A.电池内部含有电解质
B.锌是负极,石墨棒是正极
C.电池用完后可埋入土壤
D.锌锰干电池是一次性电池
答案 C
解析 用完的电池埋入土壤中易造成土壤污染以及地下水污染。
[应用·实践]
8.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.2Al+2NaOH+6H2O===2NaAl(OH)4+3H2↑
B.2H2+O2 =====点燃
2H2O
C.Zn+CuSO4===Cu+ZnSO4
- 4 -
D.Na2CO3+2HCl===2NaCl+H2O+CO2↑
答案 D
解析 D 项中的化学反应不属于氧化还原反应,不能设计成原电池。
9.在盛装稀硫酸的烧杯中放入用导线连接的锌片和铜片。下列叙述不正确的是( )
A.负极附近 SO 2-4 的浓度逐渐增大
B.电子由铜片通过导线流向锌片
C.反应一段时间后,溶液中 c(H+)减小
D.铜片上有 H2 逸出
答案 B
解析 该原电池中锌片为负极,铜片为正极,锌片失电子被氧化为 Zn2+进入溶液,电子
沿导线流向铜片,溶液中的 H+从铜片上得电子被还原成氢原子,氢原子结合成氢分子从铜片
上逸出。溶液中的 SO 2-4 向负极 Zn 片方向移动。故 A、C、D 正确。
10.有 a、b、c、d 四种金属电极,有关实验装置及部分实验现象如下:
由此可判断这四种金属的活动性由大到小的顺序为( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
答案 C
解析 根据原电池原理可知,负极金属的活动性大于正极金属的活动性,故只要判断出
原电池的正负极就可以比较两种金属的活动性。装置一是原电池,a 极质量减小,说明 a 极金
属失电子形成阳离子,发生氧化反应作负极,故 a 极金属比 b 极金属活泼;装置二没有形成
原电池,由 b 极有气泡产生,c 极无变化可知,b 比 c 活泼,且 c 位于金属活动性顺序表中氢
的后面;装置三和四均形成原电池,易知 d 比 c 活泼,d 比 a 活泼。因此这四种金属的活动性
由大到小的顺序为 d>a>b>c。
11.在如图所示装置中,观察到电流计指针偏转,M 棒变粗,N 棒变细,其中 P 为电解质
- 5 -
溶液。由此判断 M、N、P 所代表的物质可能是( )
选项 M N P
A 锌 碳 稀硫酸
B 碳 锌 稀盐酸
C 银 锌 AgNO3 溶液
D 铜 铁 Fe(NO3)3 溶液
答案 C
解析 经分析可知该装置是原电池,其中 M 棒作正极,有金属单质析出,N 棒作负极,失
电子溶解。A、B 两项,电解质溶液分别为稀硫酸和稀盐酸,原电池工作时,不会有金属析出,
A、B 两项错误;C 项,正极反应为 Ag++e-===Ag,负极反应为 Zn-2e-===Zn2+,符合题意,
C 项正确;D 项,正极反应为 Fe3++e-===Fe2+,不会有金属析出,D 项错误。
12.某原电池的电池反应为 Fe+2Fe3+===3Fe2+,与此电池反应不符合的原电池是( )
A.铜片、铁片、FeCl3 溶液组成的原电池
B.石墨、铁片、Fe(NO3)3 溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3 溶液组成的原电池
D.银片、铁片、Fe(NO3)3 溶液组成的原电池
答案 C
解析 由原电池的电池反应可知,该原电池中,Fe 为负极,比 Fe 不活泼的金属或非金属
作正极,含 Fe3+的溶液为电解质溶液。
13.Mg 条、Al 条平行插入一定浓度的 NaOH 溶液中,用导线连接成原电池,如图所示。
此电池工作时,下列叙述中正确的是( )
- 6 -
A.Mg 比 Al 活泼,Mg 失去电子被氧化成 Mg2+
B.负极反应式为 Al-3e-+4OH-===[Al(OH)4]-
C.原电池工作过程中溶液 pH 不变
D.Al 是电池正极,开始工作时溶液中会立即有白色沉淀析出
答案 B
解析 虽然镁比铝活泼,但镁不与 NaOH 溶液反应,铝能与 NaOH 溶液发生反应:2Al+
2NaOH+6H2O===2NaAl(OH)4+3H2↑,故在碱性溶液中铝作负极:Al-3e-===Al3+,Al3+继续和
OH-反应生成[Al(OH)4]-,即 Al-3e-+4OH-===[Al(OH)4]-;镁作正极,发生还原反应:2H2O
+2e-===2OH-+H2↑。由于反应消耗 OH-,所以原电池工作过程中溶液碱性减弱,pH 降低。
14.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路
电流从②流向①;①③相连时,③为正极;②④相连时,②有气泡逸出;③④相连时,③的
质量减少。据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
答案 B
解析 外电路中,电流从正极流向负极,则①为原电池的负极,②作正极,故活泼性①>
②;活泼性较差的金属作原电池的正极,①③相连时,③为正极,故金属活动
性①>③;有气泡产生的电极发生反应 2H++2e-===H2↑,为原电池的正极,故活动性④>
②;质量减少的电极发生氧化反应生成金属阳离子进入溶液而溶解,为负极,故活动性③>
④;由此可得活动性①>③>④>②。
[迁移·创新]
15.回答下列问题:
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应式为__________________________,
银片上发生的电极反应式为__________________________。
(2)若将反应 2FeCl3+Cu===2FeCl2+CuCl2 设计成原电池,负极电极材料为________,电
解质溶液选用________________,负极电极反应式为____________________。
(3)若将反应 Fe+H2SO4===FeSO4+H2↑设计成原电池,用稀 H2SO4 作电解质溶液,铜为原
电池的某一电极材料,则铜为原电池的________(填“正”或“负”)极。铜片的现象为
________________________,另一电极材料为________,外电路中电子由______(填“正”或
- 7 -
“负”,下同)极向________极移动,电解质溶液中 H+向______极移动。
(4)将铁棒和锌片连接后浸入 CuCl2 溶液里,当电池中有 0.2 mol 电子通过时,负极质量
的变化是________(填“增加”或“减少”)________g。
答案 (1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)铜 FeCl3 溶液 Cu-2e-===Cu2+
(3)正 有气泡放出 铁 负 正 正
(4)减少 6.5
解析 (1)在锌片、银片、稀硫酸组成的原电池中,锌片作负极,电极反应式为 Zn-2e-
===Zn2+;银片作正极,电极反应式为 2H++2e-===H2↑。
(2)Cu 是还原剂,作原电池的负极;FeCl3 是氧化剂,在正极上反应,电解质溶液是 FeCl3
溶液,可选石墨或比铜不活泼的金属作正极。
(3)该原电池中,铁作负极,铜作正极,外电路中电子由负极流向正极,电解质溶液中 H+
向正极移动,在铜片上得电子生成 H2,所以铜片上有气泡放出。
(4)将铁棒和锌片连接后浸入 CuCl2 溶液里,锌片作负极,Zn-2e-===Zn2+,当电池中有
0.2 mol 电子通过时,负极质量减少为 65 g·mol-1×
0.2 mol
2 =6.5 g。
相关文档
- 2020高中化学第二章化学键化学反应2021-08-236页
- 化学键化学反应与能量第一节化学键2021-08-237页
- 2020高中化学第二章化学键化学反应2021-08-076页
- 2020高中化学第二章化学键化学反应2021-08-068页
- 2020高中化学第二章化学键化学反应2021-07-088页
- 化学键化学反应与能量第一节化学键2021-07-087页
- 2020高中化学第二章化学键化学反应2021-07-086页
- 2020高中化学第二章化学键化学反应2021-07-085页
- 2020高中化学第二章化学键化学反应2021-07-028页
- 2020高中化学第二章化学键化学反应2021-07-026页