- 294.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.1 化学实验基本方法①
课型设置:新授课;
一、学习目标:能识别化学品安全使用标志。通过粗盐的提纯实验,进一步掌握溶解、过滤、蒸发等基本操作。通过实验中杂质离子的检验与除杂方法的讨论,加深对提纯操作原理和方法的理解。
学习重点:化学实验安全和过滤蒸发
学习难点:过滤和蒸发、除杂
二、导·学·展·评·馈
学习内容(包括学法指导)
一、化学实验安全
1、安全守则——
在制备或使用有毒气体时应该在 ____ 中进行,尾气应进行处理(通常进行 ____ 、
或用气囊收集)。
固体加热时药品应平铺在试管底,管口略 ,防止___________。
若浓硫酸滴在皮肤上,立即用大量水冲洗,再涂上3% ~ 5%_____ 溶液。若烧碱溶液滴在皮肤上,迅速用大量水冲洗,再涂上____ _ 。
可燃性气体点燃前需要 _ (可燃气体通常都存在___ ___ )。
用H2 或CO 还原CuO 时先 ,再 ,以避免发生危险。
2、危险化学品的标识
属于________。
(填字母)浓硫酸对应____;酒精对应____;白磷对应______;硝酸铵固体对应______。
二、混合物的分离和提纯
原则:【分离】操作前后,各组分的化学成分保持______________。【除杂】操作前后,只需___________的化学成分保持不变,量无明显减少(而不在乎其它成分的化学成分是否改变)。
1、过滤和蒸发
粗盐的提纯
粗盐中含有较多的杂质,如不溶性的泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等。
(1)除去粗食盐中不溶性杂质
实验步骤
①溶解:粗盐加入水中,用玻璃棒搅拌,直至________________为止
②过滤:将烧杯中的液体沿____________倒入________中
③蒸发:将滤液倒入__________中,加热同时用__________,待出现较多________时停止加热
通过溶解、过滤和蒸发操作得到的食盐中含有少量的可溶性杂质CaCl2、MgCl2及一些硫酸盐等。
(2)除去粗食盐中少量可溶性杂质
要将NaCl 溶液中Ca2+、Mg2+、SO42-等杂质离子除去,最好选用能形成难溶物的试剂(每种除杂试剂通常加过量)。Ca2+对应选择(a)过量____________溶液除去,Mg2+对应选择(b)过量____________溶液除去,SO42-对应选择(c)过量____________溶液除去。最终选定试剂的顺序是________________。
*上述顺序是否可以调换?上述选定的试剂是否可以更改?
经(2)步骤后,再经__________________________________等步骤即可得到精制的食盐固体。
离子的检验
精制的食盐固体中,是否还含有硫酸盐杂质,如何检验?
SO42-的检验——原理:SO42-与_______能生成难溶于水的白色沉淀______________。可能产生干扰的其它酸根离子是__________。故,检验精制的食盐固体中是否还含有(可溶性)硫酸盐杂质的一般方法是________________________________________________________________________________。
课堂反馈
1、下列有关化学实验安全问题的叙述中不正确的是( )
A.水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B.用试管夹从试管底部由下往上夹住距试管口约1/3处,手持试管夹长柄末端,进行加热
C.点燃酒精灯前一定要将酒精添满
D.把玻璃管插入橡皮塞口时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进孔中
2、为确定某溶液的离子组成,进行如下实验:
①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀 ②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的无色气体;白色沉淀部分溶解 ③取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验,以下推测不正确的是( )
A.一定有SO42- B.一定有CO32-
C.不能确定Cl-是否存在 D.不能确定SO42-是否存在
3、若食盐固体中混有Ba(OH)2,简述如何得到纯净的食盐固体。
__________________________________________________________________________________。
2
1.1 化学实验基本方法②
课型设置:新授课;
一、学习目标:通过制取蒸馏水,学习蒸馏的原理和基本操作。通过从碘水中提取碘的实验,学习萃取和分液的原理和基本操作;了解Cl-的检验方法。
学习重点:蒸馏、萃取
学习难点:蒸馏、萃取
二、导·学·展·评·馈
学习内容(包括学法指导)
二、混合物的分离和提纯
2、蒸馏和萃取
(1)蒸馏适合于分离_________混合物,是利于不同组分的________不同进行物质分离。蒸馏属于 变化。
制取蒸馏水(除去自来水中含有的Cl-)
填写仪器用品名称
添加的物品P,作用是_______________________________________________
锥形瓶中最初产生的液体为何要弃去? ________________________________________________
如何检验收集到的液体中是否含有Cl-? 取少量液体,_________________________________
蒸馏除可用于海水的淡化外,还可用于无水乙醇的制备。由95%的工业酒精制取>99%的无水乙醇时,通常向95%的工业酒精中加入___________固体,再进行蒸馏。
(2)萃取是利用某种溶质(X)在不同溶剂(A)、(B)中__________的大小差异,用溶剂B将X从溶剂A中提取出来的方法。X在溶剂B中的溶解度明显____于X在溶剂A中的溶解度,且溶剂A、B之间_______。
用CCl4萃取饱和碘水中的I2
萃取分液操作最重要的仪器是_____________,使用前需先____________________。
向其中倒入饱和碘水,在加入少量CCl4。
(I2微溶于水,而在CCl4中溶解度很____________;CCl4是一种无色透明的油状液体,__________溶于水,密度_______于水)
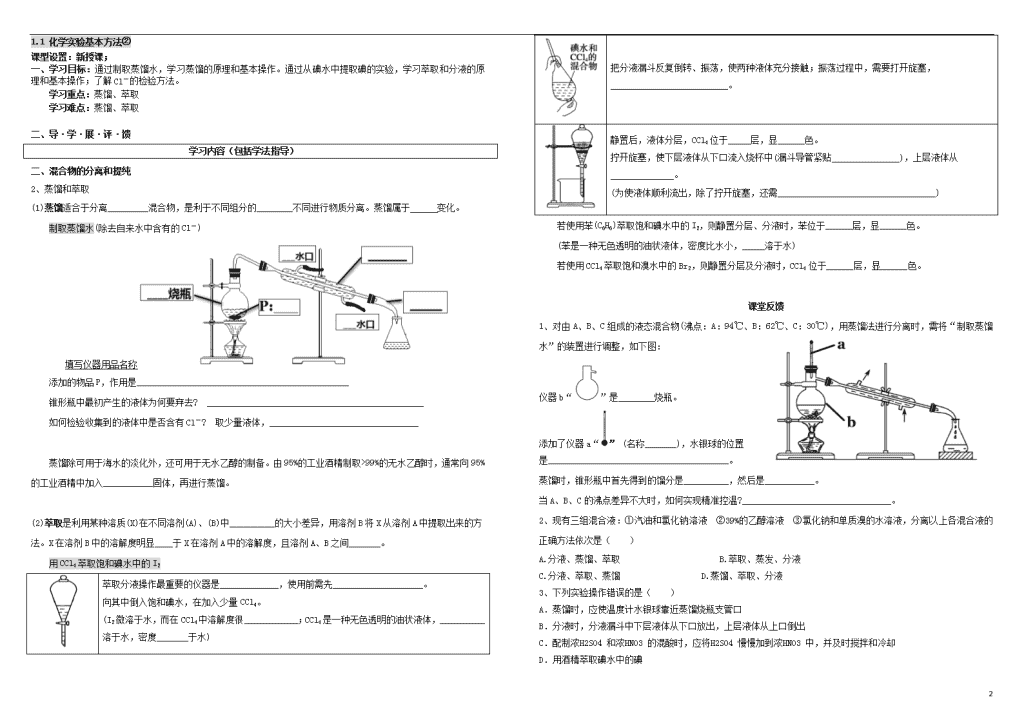
把分液漏斗反复倒转、振荡,使两种液体充分接触;振荡过程中,需要打开旋塞,__________________________。
静置后,液体分层,CCl4位于_____层,显______色。
拧开旋塞,使下层液体从下口流入烧杯中(漏斗导管紧贴_______________),上层液体从______________。
(为使液体顺利流出,除了拧开旋塞,还需___________________________________)
若使用苯(C6H6)萃取饱和碘水中的I2,则静置分层、分液时,苯位于______层,显______色。
(苯是一种无色透明的油状液体,密度比水小,_____溶于水)
若使用CCl4萃取饱和溴水中的Br2,则静置分层及分液时,CCl4位于______层,显______色。
课堂反馈
1、对由A、B、C组成的液态混合物(沸点:A:94℃、B:62℃、C:30℃),用蒸馏法进行分离时,需将“制取蒸馏水”的装置进行调整,如下图:
仪器b“”是________烧瓶。
添加了仪器a“” (名称_______),水银球的位置
是________________________________________。
蒸馏时,锥形瓶中首先得到的馏分是__________,然后是___________。
当A、B、C的沸点差异不大时,如何实现精准控温?_________________________________。
2、现有三组混合液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、蒸馏、萃取 B.萃取、蒸发、分液
C.分液、萃取、蒸馏 D.蒸馏、萃取、分液
3、下列实验操作错误的是( )
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制浓H2SO4 和浓HNO3 的混酸时,应将H2SO4 慢慢加到浓HNO3 中,并及时搅拌和冷却
D.用酒精萃取碘水中的碘
2
相关文档
- 2020高考化学二轮复习选择题标准练2021-08-245页
- 高中化学选修3-1高考必考知识点,精2021-08-2462页
- 2020高考化学刷题冲刺(含最新模拟题2021-08-2411页
- 北京版2021高考化学一轮复习专题二2021-08-2411页
- 2021版高考化学一轮复习热点突破微2021-08-242页
- 2021版浙江高考选考化学一轮复习教2021-08-2416页
- 重庆市2021高考化学一轮复习专题三2021-08-2421页
- 2018届高考一轮复习鲁科版第12章物2021-08-2418页
- 新课标2020高考物理二轮复习专题一2021-08-248页
- 2019届高考化学二轮复习微专题2微2021-08-2458页