- 277.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
湖南师大附中2019-2020学年度高一第一学期期中考试
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16个小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.《周礼)记载“煤饼烧砺(贝壳)成灰”,并把这种灰称为“蜃”,古人蔡伦以“蜃”改进了造纸术。下列说法错误的是
A. 贝壳的主要成分CaCO3 B. “砺成灰”是氧化还原反应
C. “蜃”与水混合,溶液呈碱性 D. 纸张主要成分是纤维素
【答案】B
【解析】
【详解】A、“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”,牡蛎壳为贝壳,贝壳主要成分为碳酸钙,选项A正确;
B、“砺成灰”是碳酸钙灼烧生成氧化钙和二氧化碳,反应中各元素化合价不变,不属于氧化还原反应,选项B错误;
C、“蜃”主要成分是氧化钙,氧化钙溶于水即可得到氢氧化钙,氢氧化钙溶液呈碱性,选项C正确;
D、纸张主要成分是纤维素,选项D正确。
答案选B。
2.对下列化学物质进行分类,正确的是
A. 海水、冰水混合物、氨水均为混合物
B. SO3、CO2、CaO均为酸性氧化物
C. 烧碱、纯碱、硫酸钡均为电解质
D. 氢硫酸、盐酸、硝酸均为强酸
【答案】C
【解析】
【详解】A. 冰水混合物是由水一种物质组成,属于纯净物,故A错误;
B. CaO与水反应生成碱,属于碱性氧化物,故B错误;
C. 烧碱是氢氧化钠属于碱,纯碱、硫酸钡都是盐,三者都是电解质,故C正确;
D. 氢硫酸是弱酸,故D错误;
正确答案是C。
3.下列有关实验操作的叙述合理的是
- 18 -
A. 蒸馏自来水实验中发现忘加沸石,冷却后再加入沸石
B. 用pH试纸测定溶液的pH,需要预先润湿试纸
C. 用酒精灯加热烧瓶、蒸发皿时,都需要垫上石棉网
D 蒸发操作时,将溶液放入坩埚中加热到出现大量晶体后停止加热
【答案】A
【解析】
【详解】A. 蒸馏过程中发现忘记加沸石,应冷却后再加入沸石,重新加热蒸馏,故A正确;
B. 用pH试纸测酸溶液的pH值之前若把试纸润湿,会导致酸被稀释,测得的pH值会变高,故B错误;
C. 试管、燃烧匙、蒸发皿、坩埚等仪器都能直接在酒精灯上加热;烧杯、烧瓶、锥形瓶等仪器必须垫石棉网才能加热,否则由于受热不均匀,而破裂,故C错误;
D. 蒸发时利用余热加热,即加热到出现大量晶体,还余有少量溶液时再停止加热,故D错误;
正确答案是A。
【点睛】本题考查可用于加热的仪器,是基础知识,解题的关键要掌握常见仪器的性质和用途,只要同学们留心就可做好。
4.“物质的量”是联系宏观世界和微观世界的桥梁。下列说法正确的是 ( )
A. “摩尔”是“物质的量”的单位
B. 1 mol O2的质量是32 g/mol
C. 任何气体的“气体摩尔体积”均为22.4 L/mol
D. 10 mL 2 mol/L H2SO4溶液中取出的5 mL溶液,其浓度为1 mol/L
【答案】A
【解析】
【详解】A、物质的量的单位是摩尔,故正确;
B、质量的单位是g,故错误;
C、必须是标准状况下,故错误;
D、溶液是均一透明、稳定的体系,取出5mL溶液,浓度仍为2mol·L-1,故错误。
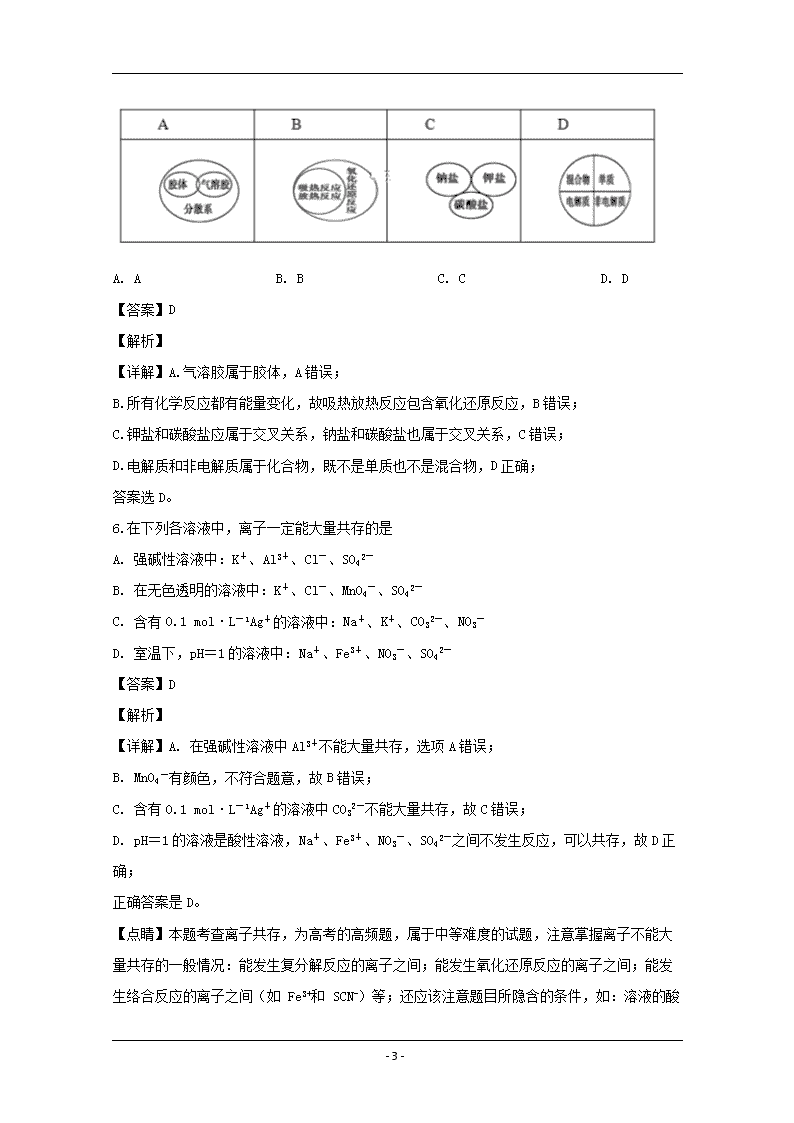
5.下列逻辑关系图中正确的是( )
- 18 -
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.气溶胶属于胶体,A错误;
B.所有化学反应都有能量变化,故吸热放热反应包含氧化还原反应,B错误;
C.钾盐和碳酸盐应属于交叉关系,钠盐和碳酸盐也属于交叉关系,C错误;
D.电解质和非电解质属于化合物,既不是单质也不是混合物,D正确;
答案选D。
6.在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、Al3+、Cl-、SO42-
B. 在无色透明的溶液中:K+、Cl-、MnO4-、SO42-
C. 含有0.1 mol·L-1Ag+的溶液中:Na+、K+、CO32-、NO3-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
【答案】D
【解析】
【详解】A. 在强碱性溶液中Al3+不能大量共存,选项A错误;
B. MnO4-有颜色,不符合题意,故B错误;
C. 含有0.1 mol·L-1Ag+的溶液中CO32-不能大量共存,故C错误;
D. pH=1的溶液是酸性溶液,Na+、Fe3+、NO3-、SO42-之间不发生反应,可以共存,故D正确;
正确答案是D。
【点睛】本题考查离子共存,为高考的高频题,属于中等难度的试题,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-
- 18 -
)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力。
7.表示下列过程的离子方程式正确的是
A. AgNO3溶液中加入铜片:Cu+2Ag+===Cu2++Ag
B. 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向氯化钙溶液中通入CO2气体:Ca2++H2O+CO2===CaCO3↓+2H+
D. Mg(OH)2与稀HNO3反应:OH-+H+===H2O
【答案】B
【解析】
【详解】A. 离子方程式两边电荷不守恒,正确的离子方程式为:Cu+2Ag + =Cu 2+ +2Ag,故A错误;
B. 等体积等物质的量浓度的NaHCO 3 和Ba(OH) 2 溶液混合,OH - 过量,NaHCO 3 +Ba(OH) 2 =BaCO 3↓+H 2O+NaOH,离子方程式为:HCO3- +Ba2++OH- =BaCO 3↓+H2O,故B正确;
C. 向氯化钙溶液中通入CO2,二者不发生反应,无法书写离子方程式,故C错误;
D. Mg(OH)2是难溶性弱电解质,在离子方程式中不能拆,故D错误;
正确答案是B。
【点睛】本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)。
8.用NA表示阿伏加德罗常数值,下列叙述正确的是
A. 常温常压下,3.4 g NH3中含有的电子数为0.2NA
B. 1 mol·L-1的Fe2(SO4)3溶液中,含有的SO42-数目为3NA
C. 标准状况下,22.4 L CO2和O2的混合气体中含氧原子数为2NA
D. 1 mol Fe在纯氧中完全燃烧,生成Fe3O4,Fe失去8NA个电子
【答案】C
【解析】
【详解】A. 3.4 g NH3的物质的量=0.2mol,1个NH3中含有10个电子,则0.2molNH3
- 18 -
中含有2mol电子,个数为2NA,故A错误;
B. 没有告知体积无法求SO42-的数目,故B错误;
C. 由题可知,混合气体的总物质的量为1mol,设其中O2的物质的量为x,SO2的物质的量为y,则有以下方程组总物质的量:x+y=1mol,O原子的物质的量为2x+2y=2(x+y)=2mol,个数为2NA,故C正确;
D. 铁变为Fe3O4时变为+价,则3mol铁失去8NA个电子,1mol铁失去NA个电子,故D错误;
正确答案是C。
【点睛】本题考查阿伏伽德罗常数,注意题中干扰条件的处理,本题难度不大。
9.某溶液中含有K+、Mg2+、SO42-、NO3-四种离子,已知其中Mg2+、K+、NO3-三种离子的个数比为4:5:3,则SO42-与NO3-离子的个数之比为
A. 2:1 B. 1:1 C. 5:3 D. 10:3
【答案】C
【解析】
【详解】Mg2+、K+、NO3-三种离子的个数比为4:5:3,设Mg2+、K+、NO3-三种离子的物质的量分别是4mol、5mol、3mol,SO42-的物质的量为xmol;根据电荷守恒4mol×2+5mol×1=3mol×1+2xmol,x=5;所以SO42-与NO3-离子的个数之比为5:3,故选C。
【点睛】掌握溶液不显电性,溶液中既有阳离子又有阴离子,根据阳离子所带正电荷总数与阴离子所带负电荷总数相等解答此类题。
10.将下列溶液分别稀释到100 mL,稀释后的溶液中氯离子浓度最大的是
A. 15 mL 1 mol•L﹣1的AlCl3 B. 50 mL 1 mol•L﹣1的KCl
C. 20 mL 2 mol•L﹣1的NH4Cl D. 10 mL 2 mol•L﹣1的CaCl2
【答案】B
【解析】
【详解】A.15 mL 1 mol•L﹣1的AlCl3溶液中氯离子的物质的量为:1mol/L×3×0.015L=0.045mol;
B.50 mL 1 mol•L﹣1的KCl溶液中氯离子的物质的量为:1mol/L×1×0.05L=0.05mol;
C.20 mL 2 mol•L﹣1的NH4Cl溶液中氯离子的物质的量为:2mol/L×1×0.02L=0.04mol;
D.10 mL 2 mol•L﹣1的CaCl2溶液中氯离子的物质的量为:2mol/L×1×0.01L=0.02mol;
根据分析可知,溶液中Cl-
- 18 -
的物质的量最大的是B:0.05mol,稀释过程中氯离子的物质的量不变,则稀释后氯离子浓度最大的是B,
答案选B。
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。
①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
②下列有关胶体的说法不正确的是________(填字母代号)。
a.光束通过Fe(OH)3胶体时形成光亮的“通路”
b.往Fe(OH)3胶体中加入稀硫酸,先出现红褐色沉淀,后沉淀溶解消失
c.Fe(OH)3胶体粒子不能透过滤纸,能透过半透膜
d.Fe(OH)3胶体发生电泳时,其胶体粒子向阴极移动
【答案】 (1). Na2O2 (2). Na2FeO4和O2 (3). 5 (4). 2 (5). 3 (6). 4 (7). 2 (8). 3 (9). 5 (10). > (11). FeCl3+3H2OFe(OH)3(胶体)+3HCl (12). c
【解析】
【分析】
(1)①分析反应2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中元素化合价变化可以解答;
②反应2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中元素化合价变化较多,由降低O元素计算方便;
(2)湿法制备高铁酸钾(K2FeO4),结合物质的性质可知,氢氧化铁被氧化;
(3)由氧化剂的氧化性大于氧化产物的氧化性可得答案;
(4)①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是:FeCl3+3H2O Fe(OH)3(胶体)+3HCl;
②根据胶体的性质解答。
【详解】(1)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,O元素的化合价既升高又降低,则氧化剂为Na2O2,还原剂为FeSO4和Na2O2;
②2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑中Fe元素的化合价升高,O元素的化合价既升高又降低,由降低O元素可知每生成1molNa2FeO4转移的电子数为1mol×5×(2-1)=5mol;
(2)湿法制备高铁酸钾(K2FeO4
- 18 -
),结合物质的性质可知,氢氧化铁被氧化,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,方程式为:2K2FeO4+16HCl=4KCl+2FeCl3+8H2O+3Cl2↑,该反应中K2FeO4中Fe元素化合价降低是氧化剂,HCl中Cl元素化合价升高是还原剂生成氧化产物Cl2,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性:K2FeO4>Cl2;
(4)①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是:FeCl3+3H2O Fe(OH)3(胶体)+3HCl;
②a. 胶体能发生丁达尔效应,故a正确;
b. 向胶体中加入电解质溶液发生聚沉,氢氧化铁与过量的稀硫酸发生化学反应而溶解,故b正确;
c. 胶体粒子的大小在1-100nm之间,可以透过滤纸但不能透过半透膜,故c错误;
d. 氢氧化铁胶体具有吸附性,吸附阳离子,则胶体粒子带电,在电场作用下氢氧化铁胶粒会移向阴极,阴极附近颜色变深,会产生电泳现象,故d正确;说法不正确的是c。
21.向一定体积CaCl2和HCl的混合溶液中逐滴加入浓度为1 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
已知图中V1∶V2=1∶2;当加入V2 mL Na2CO3溶液时,所得溶液的浓度为1 mol·L-1,体积为200 mL。求:
(1)加入V2 mL Na2CO3溶液时,所得溶液的溶质是________。
(2)原混合溶液中CaCl2和HCl的物质的量之比n(CaCl2)∶n(HCl)=________。
(3)m1=________g,m2=________g。
【答案】 (1). NaCl (2). 1∶2 (3). 2.2 (4). 5
【解析】
【分析】
分析反应的过程可知:加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了,据此分析解答。
- 18 -
【详解】(1)加入V2 mL Na2CO3溶液时,沉淀或气体的质量不再增大,说明碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故所得溶液的溶质是NaCl;
(2) 由图像可知,向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1mol·L-1 的 Na2CO3溶液,0~V1发生的是碳酸钠与盐酸反应,生成二氧化碳的质量为m1,V1~V2发生的是碳酸钠与氯化钙的反应,生成碳酸钙的质量为m2。又知V1:V2=1:2,说明盐酸和氯化钙消耗的Na2CO3 溶液体积相等,由两个反应的化学方程式可知,n(CaCl2)∶n(HCl)= 1:2;当加入 V2mLNa2CO3 溶液时,所得溶液为氯化钠溶液,其浓度为 1 mol·L-1,体积为 200mL,所以n(NaCl)=0.2mol,由氯离子守恒可以求出n(CaCl2)=0.0500mol、n(HCl)=0.100mol,n(CaCl2)∶n(HCl)=1:2;
(3) 0~V1发生的是碳酸钠与盐酸反应,生成二氧化碳的质量为m1,则n(CO2)= n (HCl)= ×0.1mol=0.05mol,m1= n(CO2) ×M(CO2)=0.05mol×44g/mol=2.2g,由钙离子守恒可知,n(CaCO3)=n(CaCl2)=0.05mol,所以m2=0.0500mol5 g。
【点睛】本题考查的是有关混合物的组成的计算,难度较大。弄清反应原理和反应的先后顺序是解题的关键,从图像中及题中找出关键数据是解题的保证,巧妙运用守恒法是解题的捷径。
- 18 -
- 18 -
相关文档
- 湖南省湖南师范大学附属中学2018-22021-08-247页
- 云南省红河县一中2019-2020学年高2021-08-249页
- 2018-2019学年湖南师范大学附属中2021-08-2431页
- 【化学】浙江省磐安县第二中学20192021-08-2415页
- 【化学】湖北省随州一中2019-20202021-08-2417页
- 2018-2019学年江西省上饶中学高一2021-08-248页
- 2019-2020学年山东省平度市第九中2021-08-248页
- 2018-2019学年四川省成都外国语学2021-08-249页
- 河北省唐山市第一中学2019-2020学2021-08-2420页
- 2018-2019学年辽宁省沈阳市东北育2021-08-249页