- 140.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题强化训练(四)
能力练(20分钟)
一、选择题
1.(2019·重庆七校联考)W、X、Y、Z是原子序数依次增大的短周期主族元素,Y(XW)Z2是一种新型净水剂,XW-是一种10电子微粒,且对水的电离有抑制作用,X和Y能形成二元化合物R,工业上电解熔融的R可制取Y的单质。下列说法正确的是( )
A.含有Y元素的离子水解一定显酸性
B.电解熔融R时,X的离子向阳极移动
C.简单离子半径:Z>Y>X
D.可用pH试纸测定Z单质水溶液的pH
[解析] 短周期主族元素W、X、Y和Z的原子序数依次增大,由“XW-是一种10电子微粒,且对水的电离有抑制作用”,推出X为O,W为H;由“X和Y能形成二元化合物R,工业上电解熔融的R可制取Y的单质”及“Y(XW)Z2是一种新型净水剂”,可推出Y为Al,R为Al2O3;由Y(XW)Z2中各元素化合价代数和为0,推出Z为-1价,从而推出Z为Cl。KAlO2溶液因AlO水解而显碱性,A项错误;电解熔融R(Al2O3)时,X的离子(O2-)向阳极移动,B项正确;电子层数多的离子半径大,具有相同核外电子排布的离子,原子序数小的离子半径大,则简单离子半径:Z(Cl-)>X(O2-)>Y(Al3+),C项错误;因氯水中含具有漂白作用的HClO,故不能用pH试纸测定氯水的pH,D项错误。
[答案] B
2.(2019·河北名校第二次联考)A、B、C、D、E是原子序数依次增大的短周期主族元素,其中A、C同主族且能形成离子化合物。B、D同主族,A、D两元素组成的一种化合物与B、D两元素组成的一种化合物反应,生成浅黄色固体。下列有关推断合理的是( )
A.简单离子半径:E>C>D>B
B.A、B、C、D四种元素能组成阴、阳离子数之比为1∶1的离子化合物
C.简单氢化物沸点:E>D>B
D.C、D、E的最高价氧化物对应水化物相互之间一定能发生反应
[解析] A、B、C、D、E是原子序数依次增大的短周期主族元素,其中A、C同主族且能形成离子化合物,则A为H,C为Na;B、D同主族,A、D两元素组成的一种化合物与B、D两元素组成的一种化合物反应,生成浅黄色固体,故B为O,D为S,E为Cl,生成的浅黄色固体为单质S。
S2-、Cl-电子层结构相同,r(S2-)>r(Cl-),O2-、Na+电子层结构相同,r(O2-)>r(Na+),简单离子半径:r(S2-)>r(Cl-)>r(O2-)>r(Na+),A项错误;A、B、C、D四种元素组成的阴、阳离子数之比为1∶1的离子化合物为NaHSO4、NaHSO3,B项正确;Cl、S、O三种元素的简单氢化物分别为HCl、H2S、H2O,因为H2O分子间存在氢键,所以三者中H2O的沸点最高,C项错误;C、D、E的最高价氧化物对应水化物分别为NaOH、H2SO4、HClO4,H2SO4和HClO4不能发生反应,D项错误。
[答案] B
3.(2019·广东省六校第二次联考)下列事实不能用元素周期律解释的是( )
A.相同条件下,HNO3酸性比H3PO4强
9
B.F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应
C.NaOH固体溶于水放热,NH4NO3固体溶于水吸热
D.氯与钠形成离子键,氯与硅形成共价键
[解析] N和P均为第ⅤA族元素,且非金属性:N>P,故最高价氧化物对应水化物的酸性:HNO3>H3PO4,A项能用元素周期律解释;F和I均为第ⅦA族元素,且非金属性:F>I,故F2与H2在暗处反应要比I2与H2在暗处反应剧烈,B项能用元素周期律解释;NaOH、NH4NO3固体溶于水分别为放热和吸热过程,这与其物理性质有关,而与元素周期律无关,C项不能用元素周期律解释;Na最外层只有1个电子,易失电子,Si最外层有4个电子,既不易得电子也不易失电子,Cl最外层有7个电子,易得电子(同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强),故钠、硅与氯分别形成离子键和共价键,D项能用元素周期律解释。
[答案] C
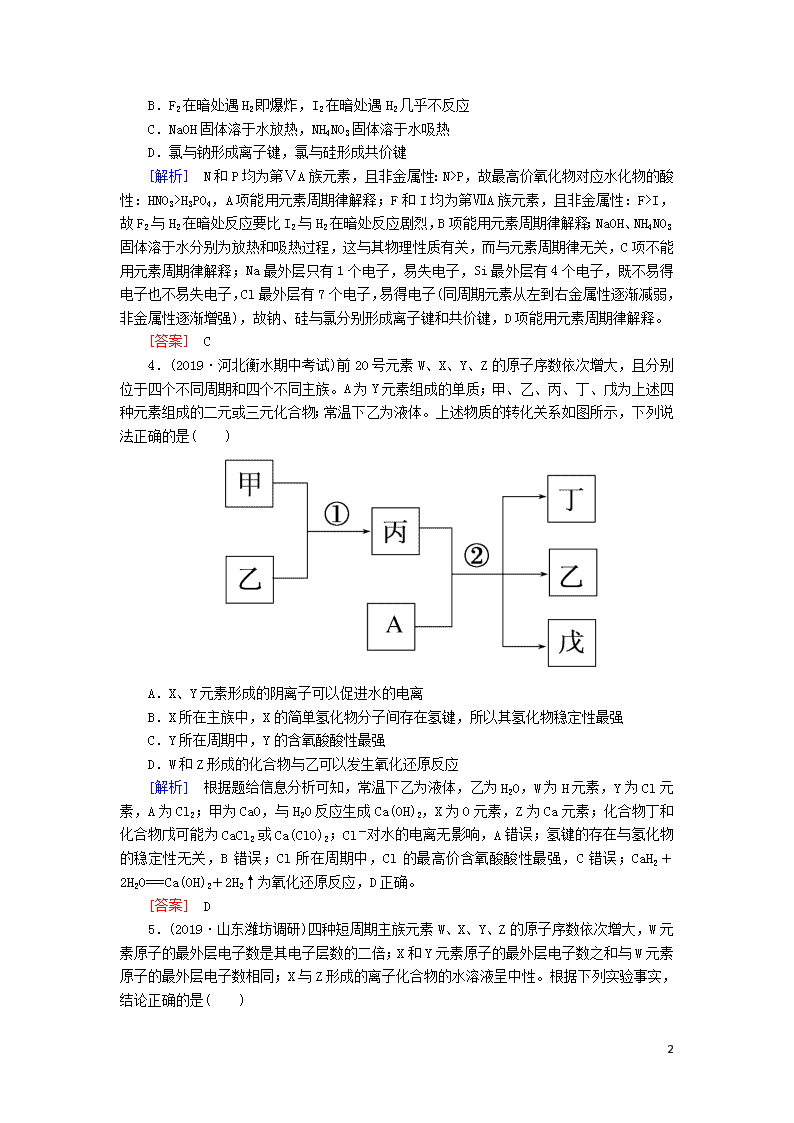
4.(2019·河北衡水期中考试)前20号元素W、X、Y、Z的原子序数依次增大,且分别位于四个不同周期和四个不同主族。A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。上述物质的转化关系如图所示,下列说法正确的是( )
A.X、Y元素形成的阴离子可以促进水的电离
B.X所在主族中,X的简单氢化物分子间存在氢键,所以其氢化物稳定性最强
C.Y所在周期中,Y的含氧酸酸性最强
D.W和Z形成的化合物与乙可以发生氧化还原反应
[解析] 根据题给信息分析可知,常温下乙为液体,乙为H2O,W为H元素,Y为Cl元素,A为Cl2;甲为CaO,与H2O反应生成Ca(OH)2,X为O元素,Z为Ca元素;化合物丁和化合物戊可能为CaCl2或Ca(ClO)2;Cl-对水的电离无影响,A错误;氢键的存在与氢化物的稳定性无关,B错误;Cl所在周期中,Cl的最高价含氧酸酸性最强,C错误;CaH2+2H2O===Ca(OH)2+2H2↑为氧化还原反应,D正确。
[答案] D
5.(2019·山东潍坊调研)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素原子的最外层电子数是其电子层数的二倍;X和Y元素原子的最外层电子数之和与W元素原子的最外层电子数相同;X与Z形成的离子化合物的水溶液呈中性。根据下列实验事实,结论正确的是( )
9
选项
实验事实
结论
A
将X的单质投入CuSO4溶液中,产生蓝色沉淀
X的金属性比Cu强
B
向Y的氯化物溶液中滴加氨水,生成白色沉淀
Y的金属性比N强
C
HZ溶液的酸性比HBr溶液的酸性强
Z的非金属性比Br强
D
将W的含氧钠盐与SiO2在高温下反应得到Na2SiO3和W的气态氧化物
W的非金属性比Si强
[解析] 四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素原子的最外层电子数是其电子层数的二倍,W是碳元素;X和Y元素原子的最外层电子数之和与W元素原子的最外层电子数相同,即X和Y元素原子的最外层电子数之和为4,故X是钠元素,Y是铝元素;X与Z形成的离子化合物的水溶液呈中性,则Z为氯元素。A项,因钠与硫酸铜没有发生置换反应,不能比较两者的金属性。但是将单质钠投入CuSO4溶液中,Na先和水反应生成NaOH和H2,NaOH和CuSO4反应生成Na2SO4和Cu(OH)2蓝色沉淀,可以根据NaOH→Cu(OH)2,判断Na的金属性比Cu强,正确。B项,认为Al是金属元素、N是非金属元素,直接判断结论正确,忽略了实验事实与结论的对应关系。根据实验事实只能判断出NH3·H2O的碱性比Al(OH)3强,但NH3·H2O不是最高价氧化物对应的水化物,不能比较元素的金属性强弱,错误。C项,HZ和HBr不是最高价氧化物对应的水化物,不能按酸性强弱判断元素的非金属性强弱,错误。D项,根据反应Na2CO3+SiO2CO2↑+Na2SiO3不在溶液内无法判断元素的非金属性强弱,错误。
[答案] A
6.(2019·湖北调研)已知主族元素A、B、C、D、E、F在周期表中的相对位置如图所示,A和C原子的最外层电子数之差等于4,C和F原子的核外电子总数相差8,X、Y、Z分别为D、E、F的最高价氧化物对应的水化物。下列说法不正确的是( )
A.简单离子半径:A>B>C
B.简单氢化物的沸点:B>A>D
C.相同温度下,等浓度的X、Y、Z的水溶液,pH由大到小的顺序为Z、X、Y
D.B、C、D三种元素形成的某种化合物可能与E的简单氢化物反应产生黄色沉淀
[解析] A和C原子的最外层电子数之差等于4,主族元素最外层电子数与主族序数相同,若C位于ⅠA族,则A、B、E分别位于ⅤA、ⅥA、ⅦA族,符合题意,若C位于ⅡA族,则A、B、E分别位于ⅥA、ⅦA、0族,不符合题意。结合C和F原子的核外电子总数相差8,则A、B、C、D、E、F分别为氮元素、氧元素、钠元素、硫元素、氯元素、钾元素。根据电子层结构相同时,离子半径随原子序数的增大而减小,则离子半径:Na+NH3>H2
9
S,B正确;由于硫酸为二元强酸,所以相同温度下等浓度三种溶液的pH:NaOH>HClO4>H2SO4,C错误;Na2S2O3与HCl反应有黄色沉淀S产生:Na2S2O3+2HCl===S↓+SO2↑+H2O+2NaCl,D正确。
[答案] C
7.(2019·江西重点中学联考)短周期主族元素X、Y、Z、W原子序数和族序数均依次增大,其中只有Y、Z处于同一周期,Z是地壳中含量最多的元素。下列说法正确的是( )
A.Y一定是非金属元素
B.原子半径:r(X)Y>X>Z
B.简单气态氢化物的沸点:X>W
C.Y与X、Z、Q均可形成至少两种二元化合物
D.Y、Z、Q组成的化合物的水溶液均呈碱性
[解析] 由短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素,可知X为C;由W与X同主族,可知W为Si;由Y的原子最外层电子数是其电子层数的3倍,可知Y为O;Z与Q的最外层电子数相差6,则Z为Na,Q为Cl。非金属性强弱顺序为O>Cl>C>Na,即Y>Q>X>Z,A项错误;对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,故沸点:CH4Z>Y
C.X与Y形成晶体的基本结构单元为四面体
D.原子半径:Y>Z>X>W
[解析] 根据“短周期主族元素W、X、Y、Z的原子序数依次增大”“W的某种核素不含中子”,推出W为H,再由“X、Y原子核外L层的电子数之比为3∶4”
9
“X与Z同主族,且X、Y、Z原子的最外层电子数之和为16”,推出X、Y、Z分别为O、Si、S。W(H)、X(O)、Z(S)三种元素形成的化合物中H2SO4为强电解质,H2SO3为弱电解质,A项错误;X(O)、Y(Si)、Z(S)的简单氢化物分别为H2O、SiH4、H2S,根据非金属性越强形成的气态氢化物越稳定,可知稳定性:H2O>H2S>SiH4,B项正确;X(O)与Y(Si)形成的SiO2为原子晶体,基本结构单元为四面体,C项正确;根据同一周期主族元素从左到右原子半径依次减小,同一主族元素从上到下原子半径依次增大,可知原子半径:Y(Si)>Z(S)>X(O)>W(H),D项正确。
[答案] A
3.(2019·河南调研)短周期主族元素W、X、Y、Z的原子序数依次增大,由这些元素组成的单质及化合物的转化关系如图所示,其中甲和丁分别为10电子、18电子结构的气态氢化物,乙为气态单质,戊、己的焰色反应为黄色,丙为含有多种成分的混合物,下列说法中正确的是( )
A.丙中所有物质均为不溶于水的液体
B.己转化为丁的反应中,只利用了浓硫酸的强酸性
C.Y与其他三种元素均能形成阴、阳离子个数之比为1∶1的化合物
D.四种元素均能形成多种氧化物
[解析] 根据“甲和丁分别为10电子、18电子结构的气态氢化物”以及甲与乙的反应条件可知:甲为CH4,乙为Cl2,丁为HCl,丙为一氯甲烷、二氯甲烷、三氯甲烷以及四氯化碳的混合物;结合“戊、己的焰色反应为黄色”及乙和戊在点燃条件下反应得到己,可知戊为Na,己为NaCl。W、X、Y、Z依次为H、C、Na、Cl。一氯甲烷为气体,二氯甲烷、三氯甲烷、四氯化碳为液体,A错误;NaCl与浓硫酸反应生成HCl的反应原理为“高沸点酸制低沸点酸”,主要利用浓硫酸的高沸点性,B错误;NaH和NaCl的阴、阳离子个数之比为1∶1,类比CaC2,可知Na2C2的阴、阳离子个数之比为1∶2,C错误;H、C、Na、Cl均能形成多种氧化物,D正确。
[答案] D
4.(2019·山东临沂二模)短周期主族元素W、X、Y、Z、R的原子序数依次增大。其中X、Z位于同一主族;W的气态氢化物常用作制冷剂;Y是同周期主族元素中离子半径最小的;ZXR2与水剧烈反应,液面上有白雾生成,并有无色刺激性气味的气体逸出,且该气体能使品红溶液褪色。下列说法正确的是( )
A.简单气态氢化物的热稳定性:W>X
9
B.含氧酸的酸性:ZM
D.单质沸点:M>Z
[解析] 根据元素周期表的结构可知,M、X、Y、Z分别为Al、Si、C、N或Si、P、N、O或P、S、O、F或S、Cl、F、Ne。A项,只有M可能为金属元素,正确。B项,忽略Z可能为Ne而错判,Ne是稀有气体元素,不是最活泼的非金属元素, 错误。C项,元素周期表中,同一周期主族元素从左向右元素非金属性逐渐增强,其最高价氧化物对应水化物的酸性逐渐增强,正确。D项,四种情况下,M的单质为铝、硅、白磷(或红磷等)、硫,常温下均为固体;Z的单质为N2、O2(O3)、F2、Ne,常温下均为气体。则M形成单质的沸点大于Z形成单质的沸点,正确。
[答案] B
6. (2019·唐山二模)短周期元素X、Y、Z、W的原子序数依次增大,X和W为同主族元素,Z的简单离子半径在第三周期元素中最小,由这四种元素中的一种或几种元素组成的物质存在如图转化关系。其中P是元素X的氢化物,其稀溶液可用于伤口消毒,Q为一种二元化合物,常温下0.01 mol·L-1 M(化合物)溶液pH=12。下列说法错误的是( )
9
A.X和Y、W均至少能形成两种化合物
B.离子半径:W>Y>Z>X
C.Q和M中都存在离子键
D.气态氢化物的稳定性:X>W
[解析] Z的简单离子半径在第三周期元素中最小,Z为Al元素;X的氢化物的稀溶液用于伤口消毒,X为O元素;常温下0.01 mol·L-1 M溶液的pH=12,M为一元强碱,M的组成元素为短周期元素,M为NaOH,结合框图中的转化关系,推出W为S元素,所以X、Y、Z、W分别为元素O、Na、Al、S。O和Na、O和S能形成化合物Na2O与Na2O2、SO2与SO3,A正确;离子半径:S2->O2->Na+>Al3+,B错误;Q为Na2S,M为NaOH,都存在离子键,C正确;稳定性:H2O>H2S,D正确。
[答案] B
7.(2019·河南开封模拟)X、Y、Z、W是四种原子序数依次增大的前20号主族元素;X的单质是手机电池中重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W原子的最外层电子数之和与Z的相等,Z能形成多种氧化物。下列叙述正确的是( )
A.X与W均为活泼金属,其单质通常保存在煤油中
B.Z的非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y,简单离子半径:ZN,电子层结构相同的离子,核电荷数越大,离子半径越小,离子半径:K+
相关文档
- 2021届高考化学一轮复习第5章物质2021-08-2414页
- 人教版化学必修二第一章 物质结构 2021-08-2469页
- 2019届二轮复习物质结构元素周期律2021-08-2412页
- 2019届二轮复习物质结构元素周期律2021-08-2447页
- 2020届二轮复习物质结构与性质作业2021-08-2412页
- 2018届二轮复习物质结构元素周期律2021-08-24119页
- 2018届高考一轮复习鲁科版第12章物2021-08-2418页
- 广西专用2020版高考化学二轮复习专2021-08-2448页
- 2018届二轮复习物质结构与性质课件2021-08-2478页
- 高三化学一轮单元卷:第八单元 物质2021-08-2416页