- 115.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
训练2 化学电源
[基础过关]
一、常见的化学电池
1. 下列说法正确的是 ( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质大量储存在电池内部
2. 下列有关电池的说法不正确的是 ( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
3. 生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是 2PbSO4+2H2OPbO2+Pb+2H2SO4
下列对铅蓄电池的说法错误的是 ( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO===PbSO4
D.工作时电解质的密度减小
4. 氢氧燃料电池已用于航天飞机,它是以铂作电极,KOH溶液作电解质,正极反应为O2+2H2O+4e-===4OH-,负极反应为2H2+4OH--4e-===4H2O,下列叙述不正确的是
( )
A.H2在负极发生氧化反应
B.燃料电池的能量转化率可达100%
C.是一种高效、环保的发电装置
D.供电时的总反应为2H2+O2===2H2O
二、根据电极反应式或总反应式分析电池的有关变化
5. 市场上经常见到的标记为Liion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的总反应式为Li+2Li0.35NiO22Li0.85NiO2,下列说法不正确的是
( )
A.放电时,负极的电极反应式:Li-e-===Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质溶液
5
D.放电过程中Li+向负极移动
6. 甲醇燃料电池(DMFC)可用于笔记本电脑、汽车、遥感通讯设备等,它的一极通入甲醇,一极通入氧气;电解质是质子交换膜,它能传导氢离子(H+)。电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是O2+4H++4e-===2H2O。下列叙述中不正确的是 ( )
A.负极的反应式为CH3OH+H2O-6e-===CO2↑+6H+
B.电池的总反应式是2CH3OH+3O2===2CO2+4H2O
C.电池工作时,H+由正极移向负极
D.电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入
7. LiAl/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-===Li2S+Fe
有关该电池的下列说法中,正确的是 ( )
A.LiAl在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的总反应式为2Li+FeS===Li2S+Fe
C.负极的电极反应式为Al-3e-===Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS
三、新型电池的开发利用
8. 科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料。电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-。下列对该燃料电池的说法不正确的是 ( )
A.在熔融电解质中,O2-由负极移向正极
B.该电池的总反应是C3H8+5O2===3CO2+4H2O
C.电路中每通过5 mol电子,约有5.6 L标准状况下的丙烷被完全氧化
D.通入丙烷的电极为电池负极,发生的电极反应为
C3H8-20e-+10O2-===3CO2+4H2O
9. 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是 ( )
A.电池的负极反应为Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O
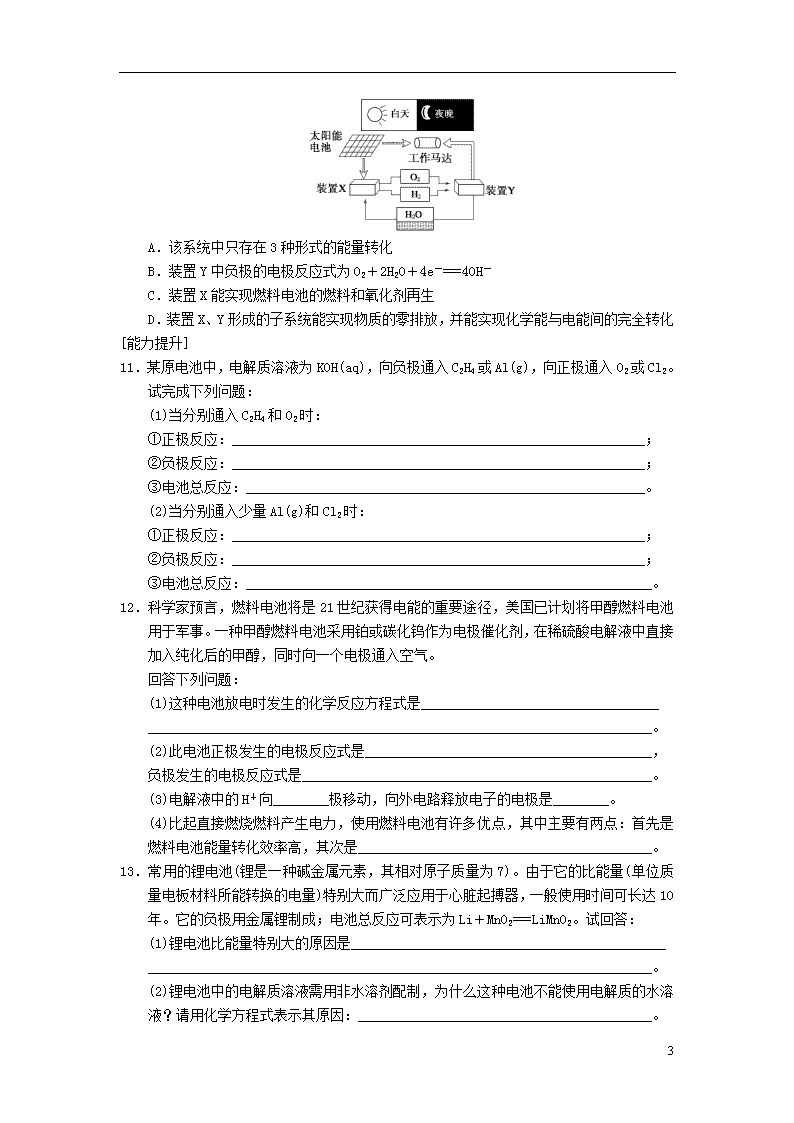
10.如图是一种航天器能量储存系统原理示意图。下列说法正确的是 ( )
5
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为O2+2H2O+4e-===4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
[能力提升]
11.某原电池中,电解质溶液为KOH(aq),向负极通入C2H4或Al(g),向正极通入O2或Cl2。试完成下列问题:
(1)当分别通入C2H4和O2时:
①正极反应:___________________________________________________________;
②负极反应:___________________________________________________________;
③电池总反应:_________________________________________________________。
(2)当分别通入少量Al(g)和Cl2时:
①正极反应:___________________________________________________________;
②负极反应:___________________________________________________________;
③电池总反应:__________________________________________________________。
12.科学家预言,燃料电池将是21世纪获得电能的重要途径,美国已计划将甲醇燃料电池用于军事。一种甲醇燃料电池采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。
回答下列问题:
(1)这种电池放电时发生的化学反应方程式是__________________________________
________________________________________________________________________。
(2)此电池正极发生的电极反应式是_________________________________________,
负极发生的电极反应式是__________________________________________________。
(3)电解液中的H+向________极移动,向外电路释放电子的电极是________。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池能量转化效率高,其次是__________________________________________。
13.常用的锂电池(锂是一种碱金属元素,其相对原子质量为7)。由于它的比能量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达10年。它的负极用金属锂制成;电池总反应可表示为Li+MnO2===LiMnO2。试回答:
(1)锂电池比能量特别大的原因是_____________________________________________
________________________________________________________________________。
(2)锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:__________________________________________。
5
14.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是 ( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
________________________________________________________________________。
[拓展探究]
15.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意
图,该电池电极表面镀一层细小的铂粉。铂吸附气体的能力强,性质
稳定。请回答:
(1)氢氧燃料电池能量转化的主要形式是________________,在导线中
电子流动方向为________(用a、b表示)。
(2)负极反应式为___________________________________________。
(3)电极表面镀铂粉的原因是__________________________________
________________________________________________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H22LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是________。
②已知LiH固体密度为0.82 g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比值为____________。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
5
答案
1.C 2.B 3.A 4.B 5.D 6.C 7.B 8.A 9.B 10.C
11.(1)①3O2+6H2O+12e-===12OH-
②C2H4+16OH--12e-===2CO+10H2O
③C2H4+3O2+4OH-===2CO+4H2O
(2)①3Cl2+6e-===6Cl-
②2Al(g)-6e-+8OH-===2AlO+4H2O
③2Al(g)+3Cl2+8OH-===2AlO+6Cl-+4H2O
12.(1)2CH3OH+3O2===2CO2+4H2O
(2)3O2+12H++12e-===6H2O
2CH3OH+2H2O-12e-===2CO2+12H+
(3)正 负极 (4)对环境无污染
13.(1)锂的摩尔质量小
(2)2Li+2H2O===2LiOH+H2↑
14.(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液
15.(1)化学能转变为电能 a流向b
(2)H2-2e-+2OH-===2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快反应速率
(4)①Li H2O ②8.71×10-4(或) ③32
5
相关文档
- 高中化学 4_2《化学电源》课件1 新2021-08-2427页
- 高中化学第1章化学反应与能量转化2021-08-247页
- 高中化学《化学反应原理》4_2化学2021-08-245页
- 2020届高考化学二轮复习电化学原理2021-08-249页
- 广东省2021版高考化学一轮复习第六2021-08-2454页
- 化学第四章电化学基础第2节化学电2021-08-246页
- 2021届新高考选考化学一轮复习人教2021-08-247页
- 2020届一轮复习人教全国版第21讲原2021-08-2424页
- 化学第四章电化学基础第2节化学电2021-08-246页
- 高中化学 4_2《化学电源》课件2 新2021-08-2420页