- 425.04 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业22 金属的电化学腐蚀与防护
时间:45分钟 满分:100分
一、选择题(每小题5分,共55分)
1.有关金属腐蚀的论述,正确的是( D )
A.金属的腐蚀一定伴有电流的产生
B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀
C.发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D.发生电化学腐蚀时都有能量的转变,且被腐蚀的金属总是失电子
解析:金属的腐蚀可分为化学腐蚀和电化学腐蚀,化学腐蚀是金属直接与氧化剂反应,电子直接转移给氧化剂,无电流产生;而电化学腐蚀是最普通的一种金属腐蚀,其原理与原电池原理一致。
2.下列叙述不正确的是( B )
A.锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率
B.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀
C.钢铁表面常易被锈蚀生成Fe2O3·nH2O
D.钢铁在发生析氢腐蚀和吸氧腐蚀时,电极反应相同的是负极反应
解析:A中锌与CuSO4发生置换反应后,铜附着在锌的表面上,浸泡在稀硫酸中形成铜锌原电池,负极锌被氧化而加速反应,故A正确;B中镀锌铁构成原电池时锌为负极,铁为正极,铁被保护;镀锡铁构成原电池时铁作负极,锡作正极,铁失电子加速了铁的腐蚀,故B不正确;C中钢铁的锈蚀主要是吸氧腐蚀,其电极反应式为负极(Fe):2Fe-4e-===2Fe2+;正极(C):2H2O+O2+4e-===4OH-,形成Fe(OH)2。在空气中4Fe(OH)2+O2+2H2O===4Fe(OH)3,久置后2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O,所以铁锈的成分是Fe2O3·nH2O,故C也正确;D中钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应相同,都是Fe-2e-===Fe2+,但正极反应不同,分别析出氢气和吸收氧气,D也正确。
3.镀锌铁在发生析氢腐蚀时,若有0.2 mol电子发生转移,下列说法正确的是( B )
①有5.6 g金属被腐蚀
②有6.5 g金属被腐蚀
③在标准状况下有2.24 L气体放出
④在标准状况下有1.12 L气体放出
A.①② B.②③ C.①④ D.③④
解析:镀锌铁发生电化学腐蚀,锌作负极:Zn-2e-===Zn2+,有0.2 mol电子转移,就有0.1 mol Zn溶解,在正极上:2H++2e-===H2↑,生成0.1 mol H2。
7
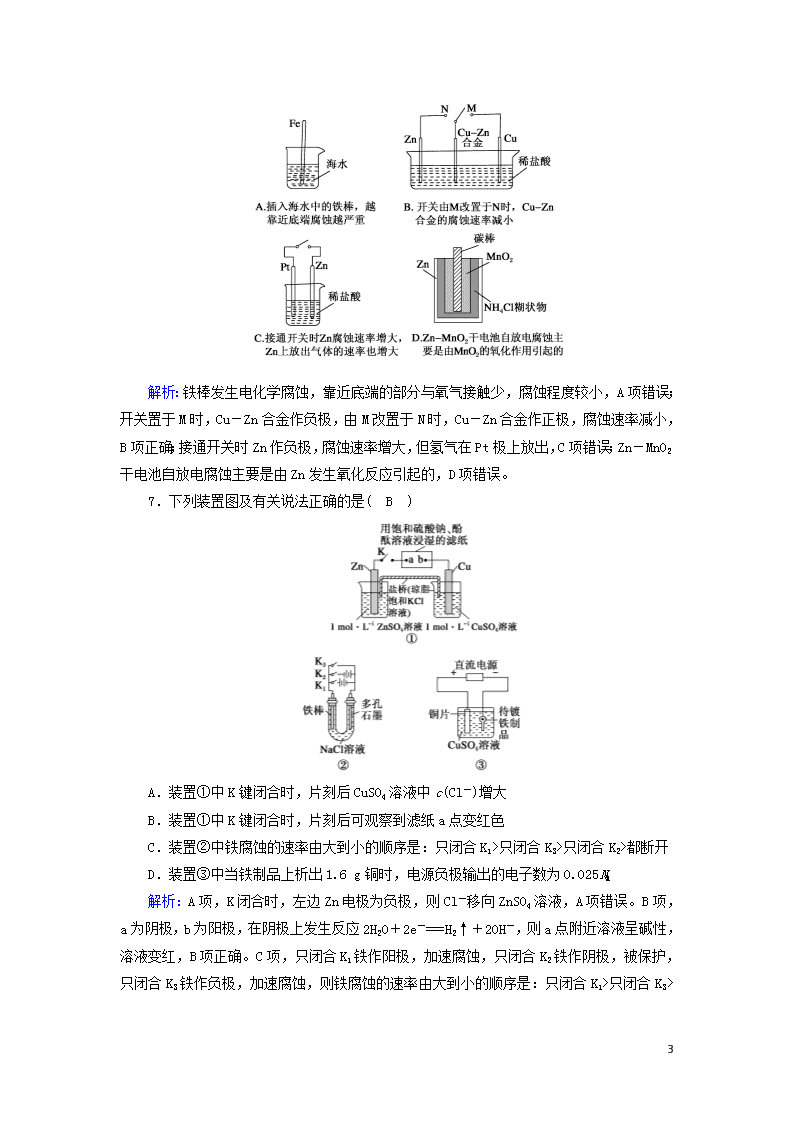
4.如图所示装置中,U形管底部盛有CCl4,分别在U形管a、b两侧慢慢加入饱和食盐水和稀硫酸,并使两端液面相平,然后分别塞上插有生铁丝的塞子,放置一段时间。下列有关叙述错误的是( D )
A.两端铁丝的腐蚀速率:a只闭合K3>只闭合K2>都断开
D.装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025NA
解析:A项,K闭合时,左边Zn电极为负极,则Cl-移向ZnSO4溶液,A项错误。B项,a为阴极,b为阳极,在阴极上发生反应2H2O+2e-===H2↑+2OH-,则a点附近溶液呈碱性,溶液变红,B项正确。C项,只闭合K1铁作阳极,加速腐蚀,只闭合K2铁作阴极,被保护,只闭合K3铁作负极,加速腐蚀,则铁腐蚀的速率由大到小的顺序是:只闭合K1>只闭合K3
7
>都断开>只闭合K2,C项错误。D项,根据电子守恒可知,负极输出的电子数为×2NA=0.05NA,D项错误。
8.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( B )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-===4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-===Cu2+
解析:本题考查原电池、钢铁的吸氧腐蚀等知识。依题意,可判断中心区a为原电池的负极,液滴边缘处O2含量较多,是原电池的正极,A中Cl-在电池工作时向负极(a)移动,A项错误;B项显然正确;C中Fe失电子被氧化而被腐蚀,故C项错误;D中因Fe比Cu活泼,充当负极的是Fe,负极反应为Fe-2e-===Fe2+,故D项错误。
9.我国某大城市某年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均值为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( B )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+
解析:酸性环境发生的腐蚀为析氢腐蚀,其正极反应为2H++2e-===H2↑。
10.下列有关电化学装置完全正确的是( B )
A
B
C
D
构成铜锌原电池
防止Fe被腐蚀
铁上镀银
铜的精炼
7
解析:在有盐桥的铜锌原电池中,电解质溶液的阳离子要与电极材料形成的阳离子相同,故A错误;铁连接电源的负极,可防止铁被腐蚀,故B正确;铁上镀银,铁应作阴极,故C错误;电解精炼铜,应让粗铜作阳极,纯铜作阴极,故D错误。
11.模拟铁的电化学防护的实验装置如图所示,下列说法不正确的是( C )
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,铁电极上发生的反应为2H++2e-===H2↑
D.若X为碳棒,开关K置于A处时,铁电极上发生的反应为2H++2e-===H2↑
解析:若X为碳棒,开关K置于A处时,铁为阴极受到保护,可减缓铁的腐蚀,故A正确;若X为锌棒,开关K置于A处时,铁作阴极受到保护,开关K置于B处时,铁作正极受到保护,因此开关K无论置于A还是B,均可减缓铁的腐蚀,故B正确;若X为锌棒,开关K置于B处时,铁为正极,电极反应为:O2+4e-+2H2O===4OH-,故C错误;若X为碳棒,开关K置于A处时,铁为电解池的阴极,电极反应为:2H++2e-===H2↑,故D正确。
二、非选择题(45分)
12.(15分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:
(1)A中反应的离子方程式是Fe+2H+===Fe2++H2↑。
(2)B中Sn极的电极反应式为2H++2e-===H2↑,Sn极附近溶液的pH增大(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是Zn,总反应的离子方程式是Zn+2H+===Zn2++H2↑,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C。
解析:铁在不同的情况下腐蚀的速率不同。作原电池的负极时易被腐蚀,作原电池的正极时受到保护不被腐蚀。
7
13.(15分)(1)对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是2Al+2OH-+2H2O===2AlO+3H2↑(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b(填字母编号)。
a.NH3 b.CO2
c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为2Al+3H2O-6e-===Al2O3+6H+。电解后的铝材需氨洗的目的是中和表面的酸溶液。阳极氧化膜中有微孔,需进行封孔,封孔的操作方法是将铝材放在沸水中浸煮5分钟。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定。
(3)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
答案:
解析:(1)①铝能和氢氧化钠溶液反应生成氢气,当其表面的氧化膜洗去后,铝就和氢氧化钠溶液反应生成氢气,离子方程式是2Al+2OH-+2H2O===2AlO+3H2↑;碱洗的溶液中铝以AlO的形成存在,由于氢氧化铝是两性氢氧化物,所以应该通入CO2,而不能加入硝酸,答案选b。
②电解池中阳极失去电子,因此阳极是铝失去电子,生成氧化铝,电极反应式是2Al+3H2O-6e-===Al2O3+6H+。由于反应中生成氢离子,所以氨洗的目的是中和表面的酸溶液。微孔存在说明含有气体,因此封孔的方法是将铝材放在沸水中浸煮5分钟。
7
(2)镀铜时溶液中镀铜离子在阴极得到电子而析出,所以铜做阳极的目的是补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定,所以不能用石墨做阳极。
(3)用石墨通过电化学腐蚀保护铜,只能用电解池原理,所以装置图如答案图所示。
14.(15分)铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:
首先检查制氧装置的气密性,然后按下图连接好装置,点燃酒精灯给药品加热,持续3 min左右,观察到的实验现象为:
①直试管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀
②直试管中干燥的铁丝表面依然光亮,没有发生锈蚀
③烧杯中潮湿的铁丝表面依然光亮。
试完成下列问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于电化学腐蚀,能表示其原理的反应方程式为负极:2Fe-4e-===2Fe2+;正极:2H2O+O2+4e-===4OH-[也可写总化学方程式:多写Fe(OH)2―→Fe(OH)3的化学方程式也不算错]。
(2)仪器A的名称为球形干燥管,其中装的药品可以是碱石灰(或无水CaCl2),其作用是干燥O2。
(3)由此实验可知,该类铁生锈的条件为与O2、H2O接触。决定铁生锈快慢的一个重要因素是氧气浓度。
解析:钢铁在潮湿环境下形成原电池,发生电化学腐蚀。此实验在直试管中的现象说明,潮湿是铁生锈的必需前提,直试管实验与烧杯实验的对比,则说明O2浓度是影响铁生锈快慢的一个重要因素。
7
相关文档
- 化学人教版选修3课件:2-3-2 范德华2021-08-2467页
- 2019届一轮复习人教版高中化学教材2021-08-247页
- 河北省石家庄市普通高中2019-20202021-08-2410页
- 2021版江苏新高考选考化学(苏教版)一2021-08-2417页
- 高中化学必修一的每章知识点总结(22021-08-2411页
- 江西省抚州市金溪一中2020届高三上2021-08-2421页
- 【化学】河北省沧州市第一中学20192021-08-2420页
- 【化学】福建省永安市第三中学20192021-08-2416页
- 2020_2021学年新教材高中化学微专2021-08-245页
- 山东专用2020届高考化学二轮复习题2021-08-244页