- 962.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业7 炔烃
基础矾固
10
10
10
能力提升
8.欧洲航天局的惠更斯号探测器成功登陆土星的最大卫星——土卫六。科学家对探测器发回的数据进行分析,发现大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氢化合物的说法正确的是( )
A.碳氢化合物的通式为CnH2n-2
B.石油的主要成分为碳氢化合物
C.乙炔是含碳量最高的碳氢化合物
D.碳氢化合物的化学键都是极性键
解析:碳氢化合物包括所有烃类,如烷烃、烯烃、焕烃、芳香烃等,它们的通式各不相同,A错;乙炔是含碳量最高的炔烃,但比C10H8等芳香烃的含碳量低,C错;碳氢化合物中碳氢键是极性键,但碳碳键是非极性键,D错。
答案:B
9.加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构简式为HC≡C—C≡C—C≡C—C≡C—C≡N,这是人类迄今发现的最重的星际有机物分子,有关该分子的说法不正确的是( )
A.该物质属于不饱和烃
B.该分子中所有原子都在一条直线上
C.该分子在一定条件下可发生加成反应
D.该分子碳、氮原子均满足8电子结构
10
解析:A项,关键词为不饱和烃,此处不饱和是指分子内含有或—C≡C—,烃是指分子内仅含有碳、氢两种元素,而该物质分子内含有C、H、N三种元素,所以不属于烃;B项,我们以乙炔的结构作为母体,从而可得出所有原子都在同一条直线上;C项,由于分子内含有不饱和的碳碳三键,所以能发生加成反应;D项,分子内除H原子外各原子的最外层电子与共用电子对的数目之和都为8,所以该分子中碳、氮原子均满足8电子结构。
答案:A
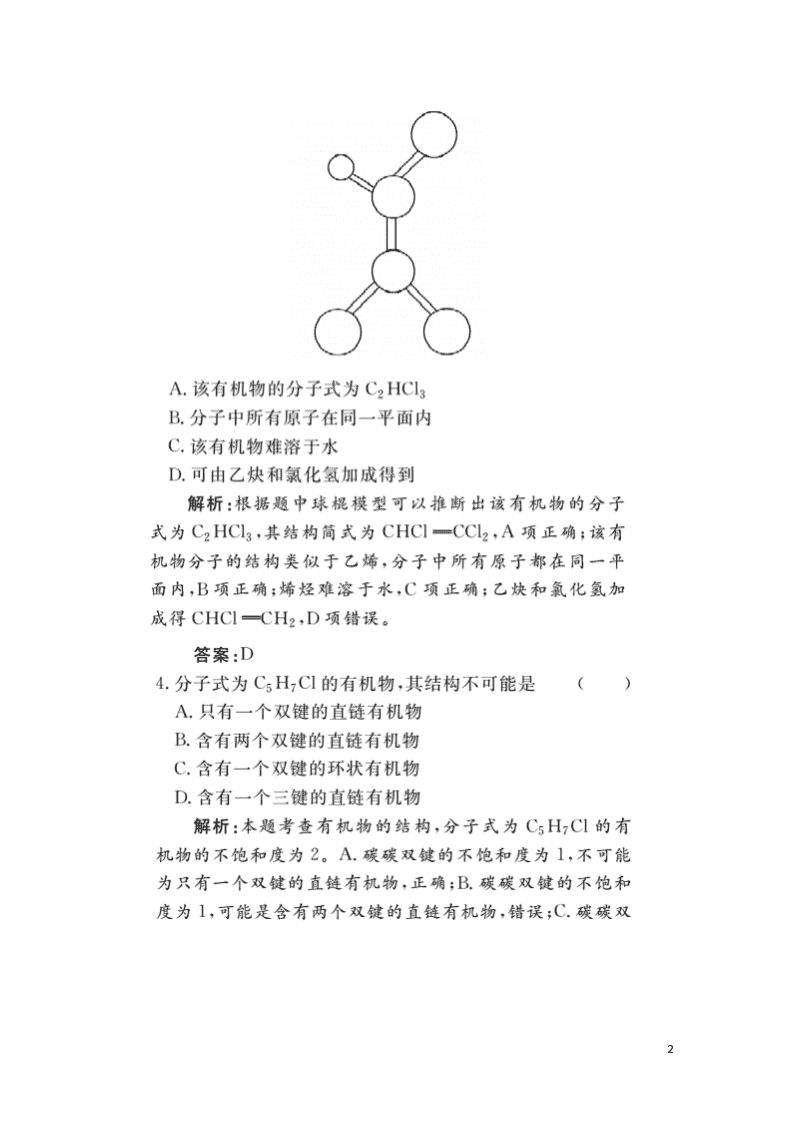
10.下图是实验室用电石和水反应制取乙炔的装置,其中正确的是( ),
解析:实验室制乙炔时,属于固体与液体反应不需要加热制气体的装置,由于反应过程释放大量热,故不宜选A;由于CaC2遇水反应剧烈,不易控制反应速率,不宜选B;D中导管伸入液体中,气体无法导出。
答案:C
11.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等同属离子型化合物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A.ZnC2水解生成乙烷(C2H6)
B.Al4C3水解生成丙炔(C3H4)
C.Mg2C3水解生成丙炔(C3H4)
D.Li2C2水解生成乙烯(C2H4)
解析:反应CaC2+2H2O―→Ca(OH)2+C2H2↑中无化合价变化。ZnC2中C显-1价,对应C2H2;Al4C3中C显-4价,对应CH4;Mg2C3中C显-f(4,3)价,对应C3H4;Li2C2中C显-1价,对应C2H2。
答案:C
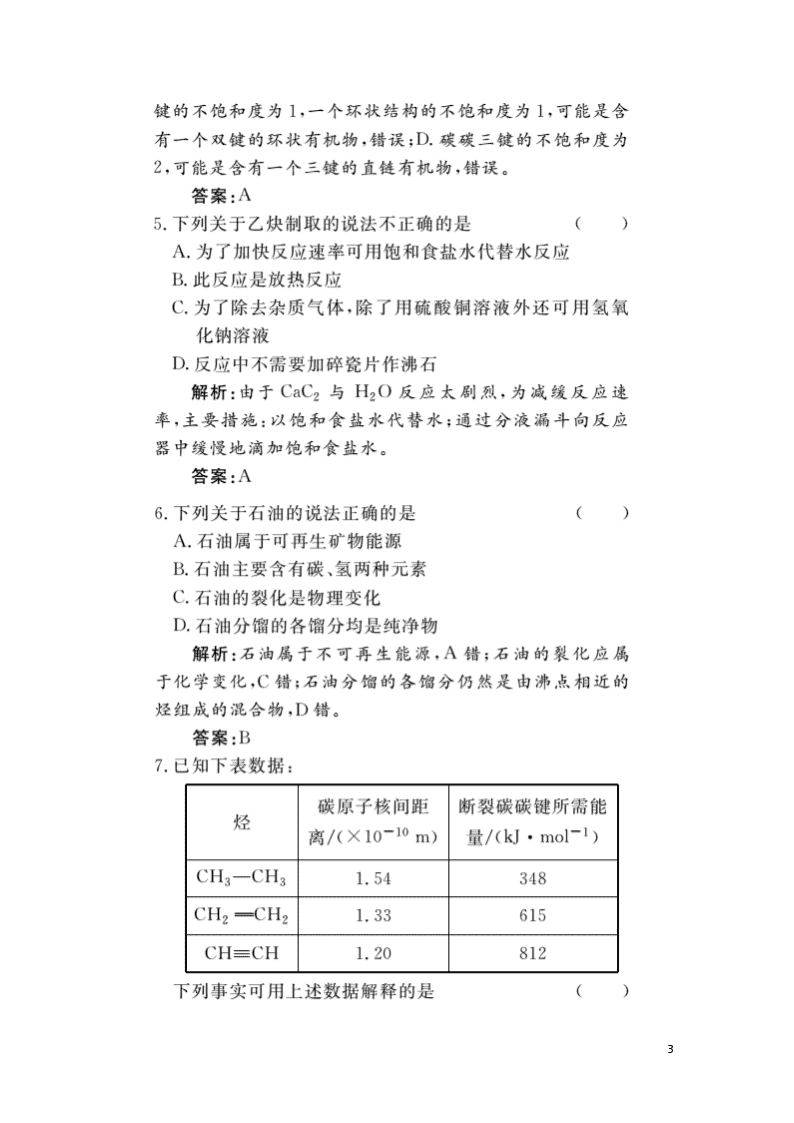
12.某烯烃和炔烃的混合气体,其密度是相同条件下氢气密度的13.4倍,将1 L混合气体燃烧,在同温同压下得到2.5 L CO2气体。则该混合烃可能是( )
10
A.C2H4和C2H2
B.C2H4和C3H4
C.C3H6和C2H2
D.C3H6和C3H4
解析:混合气体的平均相对分子质量为26.8,则混合气体中一定含有C2H2;而混合气体的平均分子式为C2.5Hx,可见混合气体中所含烯烃的碳原子数应大于2,结合各选项,只能是C项。
答案:C
13.在A.C2H4、C2H6;B.C2H4、C3H6;C.C2H2、C3H6;,D.C2H4、C3H4;E.C2H4、C2H6O五组化合物中:
(1)不论二者以何种比例混合,只要总质量一定,完全燃烧时消耗的氧气的质量和生成水的质量不变的是________。
(2)不论二者以何种比例混合,只要总物质的量一定,完全燃烧时消耗的氧气的质量不变的是________。
(3)不论二者以何种比例混合,只要总物质的量一定,完全燃烧时生成CO2的质量不变的是________。
(4)120 ℃时,不论二者以何种比例混合,完全燃烧后气体体积不变的是________。
解析:(1)当混合物总质量一定时,要使不论二者以何种比例混合,完全燃烧时耗氧量和生成水的质量不变,只要二者具有相同的最简式即可,故选B。
(2)当总物质的量一定时,要使不论二者以何种比例混合,完全燃烧时耗氧量不变,只要二者耗氧量相同即可,故选E。
(3)当总物质的量一定时,要使不论二者以何种比例混合,完全燃烧时生成CO2的质量不变,只要二者分子中含有相同的碳原子即可,故选A和E。
(4)120 ℃时,要使不论二者以何种比例混合,完全燃烧后气体体积不变,只要二者的分子中含有的氢原子个数均为4即可,故选D。
答案:(1)B (2)E (3)A、E (4)D
14.煤和石油等化石燃料对促进社会经济发展起到了重要的作用,这些燃料合理的综合利用是当前节能减排的要求。请回答下列问题:
(1)石油分馏是石油炼制的重要环节,这种操作是在________(填设备名称)内完成的。工业上通常使用的分馏石油的方法有常压分馏和______________,
10
分馏的目的是____________________。
(2)石油不仅是重要的燃料,还是重要的化工原料的来源,如利用石油生产乙烯。为了使石油分馏产物进一步生成更多的乙烯、丙烯等短链烃而采取________措施。
(3)目前石油资源逐渐匮乏,人们把目光聚集到储量相对丰富的煤上。目前煤综合利用的主要方法是____________、________和煤的气化,煤气化涉及的化学方程式:
______________________(写出第三个化学方程式)。
解析:(1)石油分馏是在分馏塔中完成的,分馏的种类有常压分馏和减压分馏(注意:不是加压分馏!),这种分馏是物理变化。
(2)为了获得化工原料乙烯,往往对石油进行裂解,需要较高的温度(700~1 000 ℃),这种反应属于化学反应。
(3)煤的干馏是化学变化,这是煤的综合利用;而煤的气化、液化也是近年来煤综合利用的重要方法。
答案:(1)分馏塔 减压分馏,为了获得沸点不同的各种成分
(2)高温裂解
(3)煤的干馏 煤的液化
15.实验室用如图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空:
(1)实验室制乙炔的化学方程式是______________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用______________来代替水。
(2)装置B中CuSO4溶液的作用是________________________。
10
(3)装置C中观察到的现象是__________________,反应的化学方程式是__________________。,(4)装置D中观察到的现象是______________,该反应的类型是______________。
解析:(1)实验室制备乙炔是利用电石和水反应生成乙炔和氢氧化钙,反应的化学方程式为CaC2+2H2O―→HC≡CH↑+Ca(OH)2,电石与水反应剧烈,用饱和食盐水可以减缓反应,所以为了得到平稳的乙炔气流,可用饱和食盐水代替水。(2)硫化氢气体具有还原性,也会导致溴的四氯化碳、高锰酸钾酸性溶液褪色,装置B中CuSO4溶液的作用是除去乙炔中的硫化氢:Cu2++H2S===CuS↓+2H+,防止干扰后续检验实验。(3)乙炔气体通过溴的四氯化碳溶液,会发生加成反应,装置C中观察到的现象是溶液褪色,反应的化学方程式为2Br2+HC≡CH―→CHBr2-CHBr2。(4)乙炔通过高锰酸钾酸性溶液,乙炔含有不饱和键,被高锰酸钾酸性溶液氧化生成二氧化碳,装置D中观察到的现象是溶液褪色,发生的反应为氧化反应。
答案:(1)CaC2+2H2O―→HC≡CH↑+Ca(OH)2,饱和食盐水
(2)除去H2S杂质,以防干扰后续实验
(3)溶液褪色 2Br2+HC≡CH―→CHBr2-CHBr2
(4)紫色褪去 氧化反应
16.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。,乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:______________________________________。
(2)甲同学设计的实验____________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是____________________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是______________,它与溴水反应的化学方程式是____________________,在验证过程中必须全部除去。
10
(4)请你选用下列四个装置(见下图,可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是__________________________。,解析:(1)根据实验原理写出有关的化学反应式。
(2)根据“乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还有可能含有少量还原性的杂质气体”,因此可得出“使溴水褪色的物质,未必是乙炔;使溴水褪色的反应,未必是加成反应”的结论,故甲同学设计的实验不能证明乙炔与溴水发生了加成反应。
(3)根据褪色后的溶液里有少许淡黄色浑浊,可推知是硫,说明乙炔气体中含有硫化氢杂质,所发生的反应方程式是Br2+H2S===S↓+2HBr。产生硫化氢的原因是电石中含有硫化钙杂质,发生的反应是CaS+2H2O===H2S↑+Ca(OH)2。(4)由于乙炔中含有硫化氢杂质,首先可利用CuSO4溶液除去H2S,然后再用CuSO4溶液检验H2S是否除尽,只有无H2S存在时方可根据溴水颜色的变化来验证乙炔与溴水是否发生了加成反应。(5)pH试纸是验证溶液的酸碱性的,实际上是验证“若发生取代反应,必定生成HBr”的结论,因此可用pH试纸检验溶液酸性有无明显增强,即可得出结论。
10
(5)若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证
10
相关文档
- 2020版高中化学课时作业4分子的立2021-08-248页
- 高中化学课时作业4离子键苏教版必2021-08-249页
- 2020新教材高中化学课时作业13乙醇2021-08-247页
- 2020新教材高中化学课时作业9化学2021-08-246页
- 2020版高中化学课时作业4原子核外2021-08-246页
- 2019-2020学年高中化学课时作业152021-08-2410页
- 2019-2020学年高中化学课时作业192021-08-247页
- 2019-2020学年高中化学课时作业5共2021-08-246页
- 高中化学课时作业3元素周期表及其2021-08-249页
- 2019-2020学年高中化学课时作业3有2021-08-2410页