- 13.48 MB
- 2022-04-01 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第10课时常见的酸和碱主题三 身边的化学物质
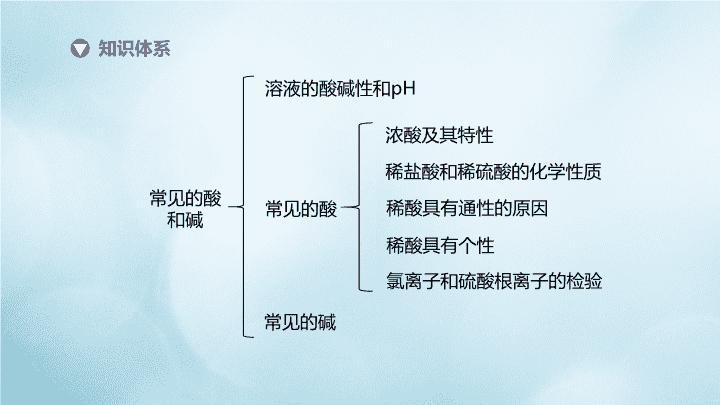
知识体系常见的酸和碱溶液的酸碱性和pH常见的酸常见的碱稀酸具有通性的原因稀酸具有个性氯离子和硫酸根离子的检验稀盐酸和稀硫酸的化学性质浓酸及其特性
挥发性白雾减小干燥剂
不变色变红Mg+H2SO4MgSO4+H2↑CuO+2HClCuCl2+H2OHCl+NaOHNaCl+H2ONa2CO3+2HCl2NaCl+H2O+CO2↑
稀硝酸硝酸银稀硝酸硝酸钡
火碱烧碱放出干燥剂腐蚀熟石灰微变红变蓝2NaOH+CO2Na2CO3+H2O2HCl+Ca(OH)2CaCl2+2H2O2NaOH+MgCl2Mg(OH)2↓+2NaCl
易错突破一、正误判断1.使石蕊溶液变红的物质一定是酸溶液()2.碱溶液能使酚酞变红,凡是能使酚酞变红的溶液都是碱溶液()××
3.用紫色石蕊溶液可以区别稀盐酸和稀硫酸()[答案]×[解析]稀盐酸和稀硫酸都显酸性,遇紫色石蕊溶液都变红。
4.稀释浓硫酸时要用玻璃棒不断搅拌,加速溶解()[答案]×[解析]稀释浓硫酸时要用玻璃棒不断搅拌,目的是加快散热。
5.浓硫酸有吸水性,可吸收气体里含有的水分,所以常用来干燥CO2、NH3()6.浓硫酸长期露置于空气中会增重、变稀()7.打开盛有稀盐酸的试剂瓶,瓶口上方出现大量白雾()8.敞口放置的浓盐酸和浓硫酸,溶液质量和溶质质量分数都会减小,原因相同()9.为了加快反应速率,可以用浓硫酸或硝酸与锌粒反应制取氢气()10.由于盐酸、硫酸在水溶液中能解离出酸根离子,所以化学性质相似()11.可用食醋除去热水瓶中的水垢()×√××××√
12.可用稀盐酸除去氧化铜中混有的铜粉()[答案]×[解析]稀盐酸和氧化铜反应,和铜不反应,不可用稀盐酸除去氧化铜中混有的铜粉。
13.氢氧化钠固体不仅易吸水潮解,而且还能与空气中的二氧化碳反应而变质()14.氢氧化钙可用生石灰与水反应制得,此反应能放出大量的热()15.氢氧化钠、氢氧化钙在水溶液中都能解离出OH-,所以化学性质相似()16.氢氧化钠的水溶液可用于除去二氧化碳中混有的氯化氢气体()17.NaOH、Ca(OH)2两种溶液久置在空气中,溶液质量都会增加()18.氢氧化钙可用于制漂白粉、改良酸性土壤、配制波尔多液、作建筑材料()19.氢氧化铝能治疗胃酸过多,是利用了氢氧化铝的碱性()√√×√×√√
20.氢氧化钠具有碱性,常用来改良酸性土壤()[答案]×[解析]氢氧化钠具有强腐蚀性,不能用来改良酸性土壤,常用熟石灰来改良酸性土壤。
21.酸中一定含有氢元素,但不一定含有氧元素()22.碱中一定含有氢、氧元素,也一定含有金属元素()23.与盐酸(或硫酸)反应生成气体的物质一定是碳酸盐,发生的反应一定是复分解反应()√××
24.某次实验中,用pH试纸测得溶液的pH=11.5()[答案]×[解析]pH试纸测定的结果只能保留到整数。
25.将稀盐酸无限稀释后,溶液pH=7()[答案]×[解析]将稀盐酸无限稀释后,溶液pH无限接近7但不会等于7。
二、规范表达26.实验室氢氧化钠固体必须密封保存的原因是_____________________________。27.治理硫酸导致的酸性废水的原理是______________________________________(用化学方程式表示)。28.小苏打用来治疗胃酸过多的原理是______________________________________(用化学方程式表示)。29.煤粉中掺入熟石灰来减轻空气污染的理由是____________________________________(用化学方程式表示)。氢氧化钠固体会吸收空气中的水蒸气而潮解,吸收空气中的二氧化碳而变质
30.生石灰常用作食品干燥剂,干燥原理是(用化学方程式表示)。31.久置的石灰水试剂瓶壁上出现白色固体的原因是_________________________(用化学方程式表示)。32.检验氯离子和硫酸根离子时,都需要加入足量稀硝酸,理由是_______________。除去可能干扰氯离子或硫酸根离子检验的碳酸根离子
化学方程式网络构建1.HCl、H2SO4的知识网络答案不唯一,合理即可)①______________________________________________________________________________________________________________________________________________;图10-1
②__________________________________________________________________________________________________________________________________________________________________________________________________________;图10-1
③__________________________________________________________________________________________________________________________________________________________________________________________________________;图10-1
④_________________________________________________________________________________________________________________________________________________________________________________________________;图10-1
⑤;⑥;⑦;图10-1
2.NaOH、Ca(OH)2的知识网络①__________________________________________________________________________________________________________________________________________________________________;②__________________________________________________________________________________________________________________________________________________________________________________________;图10-2
③_______________________________________________________________________________________________;④;⑤;图10-2
【考题分层训练】内容见Word版资源:第10课时 常见的酸和碱
1.[2019·呼和浩特]化学兴趣小组的同学在探究碱溶液的化学性质时,进行了如图10-17所示的实验。(1)实验A中,推入NaOH溶液后,可观察到的现象是。图10-17
[答案](1)气球胀大[解析](1)将氢氧化钠溶液推入锥形瓶中,氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,瓶中的二氧化碳气体体积减小,压强减小,在大气压作用下,空气从玻璃管进入气球,使气球胀大。
1.[2019·呼和浩特]化学兴趣小组的同学在探究碱溶液的化学性质时,进行了如图10-17所示的实验。图10-17
(2)实验B中发生反应的化学方程式为。实验结束后,小组同学对实验B试管中上层清液的溶质成分产生疑问,作出猜想:猜想一:只含有NaOH;猜想二:含有NaOH、Na2CO3;猜想三:含有NaOH、Ca(OH)2。同学们取少量实验B试管中的上清液分别置于甲、乙两支试管中,进行探究:实验操作实验现象结论在甲试管中滴加碳酸钠溶液不产生白色沉淀猜想三错误在乙试管中滴加足量稀盐酸猜想二正确
[答案](2)Na2CO3+Ca(OH)2CaCO3↓+2NaOH开始时无明显现象,一段时间后产生气泡[解析](2)实验B中发生的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Na2CO3+Ca(OH)2CaCO3↓+2NaOH;因为结论为猜想二正确,即上清液中含有NaOH、Na2CO3,故在乙试管中加入足量的稀盐酸,开始时无气泡产生,继续滴加稀盐酸一段时间后才有气泡产生。
1.[2019·呼和浩特]化学兴趣小组的同学在探究碱溶液的化学性质时,进行了如图10-17所示的实验。(3)A、B、C、D四个实验中能体现碱的化学通性的是(填序号)。小组同学经过讨论认为A、B、C、D四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其他化学通性。实验的方案是(写出操作和现象)。图10-17
[答案](3)ACD向D试管中继续滴加稀盐酸,溶液由红色变为无色(或在C试管中继续滴加稀盐酸,蓝色沉淀消失,合理即可)[解析](3)四个实验中,A体现了碱能与非金属氧化物反应,C体现了碱能与某些盐反应,D体现了碱溶液能与酸碱指示剂作用,B体现了钙离子和碳酸根的反应,因此,四个实验中能体现碱的通性的是ACD;碱与酸反应的通性待探究,结合以上实验,可向D试管中继续滴加稀盐酸,现象为溶液由红色变为无色,或在C试管中继续加稀盐酸,现象为蓝色沉淀消失,均能得出碱与酸反应的通性。
2.[2015·呼和浩特节选]小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,进行了如下过程。作出猜想A.石灰水已经完全变质;B.气体中有挥发出来的氯化氢气体。实验探究(1)取少量石灰水于试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到溶液变红色。于是排除了猜想A,你认为排除猜想A的理由是______________________。酚酞溶液变红,说明溶液中存在碱性物质Ca(OH)2
2.[2015·呼和浩特节选]小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为;将生成的气体通入澄清石灰水中,未见变浑浊。为探究其原因,进行了如下过程。作出猜想A.石灰水已经完全变质;B.气体中有挥发出来的氯化氢气体。实验探究(2)小明想探究所得气体中是否有挥发出来的氯化氢气体,设计如下实验。请你帮他完成实验,填写下列表格:
实验步骤实验现象实验结论气体中有氯化氢将生成的气体通入AgNO3溶液中产生白色沉淀
3.[2017·呼和浩特]化学兴趣小组同学取一定量碳酸钙固体,高温煅烧一段时间后冷却,对剩余固体成分进行如下探究。提出问题剩余固体的成分是什么?猜想与假设Ⅰ.全部是氧化钙;Ⅱ.; Ⅲ.全部是碳酸钙。实验探究(1)甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,有白色不溶物。甲同学据此认为试管中的固体有碳酸钙。乙同学认为上述实验不足以证明剩余固体中有碳酸钙,其理由是_________________________________________________。氧化钙和碳酸钙氧化钙与水反应生成的氢氧化钙微溶于水,也可能出现白色不溶物
3.[2017·呼和浩特]化学兴趣小组同学取一定量碳酸钙固体,高温煅烧一段时间后冷却,对剩余固体成分进行如下探究。(2)乙同学取一定量的剩余固体于试管中,加入一定量的水,触摸试管外壁感觉发热,据此得出猜想Ⅲ(填“成立”或“不成立”)。乙同学继续向试管中加入几滴稀盐酸,没有气泡产生,认为猜想Ⅰ成立。丙同学认为上述实验不足以证明猜想Ⅰ成立。其理由是_____________________________________________。(3)丙同学设计实验证明了猜想Ⅱ成立。丙同学的实验方案是________________(要求写出实验的操作和现象)。不成立氧化钙与水反应生成氢氧化钙,即使有碳酸钙,取少量剩余加入的少量稀盐酸也会先消耗氢氧化钙,不会出现气泡固体于试管中,滴加足量稀盐酸(或稀硝酸),有气泡产生
4.[2014·呼和浩特]某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。(1)写出该中和反应的化学方程式:。
4.[2014·呼和浩特]某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。(2)探究烧杯内溶液中溶质的成分:作出猜想(A)溶质可能是CaCl2与Ca(OH)2;(B)溶质可能是CaCl2;(C)溶质可能是CaCl2与HCl。查阅资料CaCl2溶液呈中性。
实验设计①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是________。②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写下列表格。氢氧实验步骤预计现象预计结论取少量反应后的溶液于试管中,逐滴加入碳酸钠溶液猜想(B)正确猜想(C)正确生成白色沉淀先有气泡产生,后有白色沉淀生成化钙能使无色的酚酞溶液变红
交流反思为确定猜想(C)正确,下列几种实验方案不合理的是(填序号)。A.取反应后的溶液于试管中,滴加紫色石蕊溶液变红色B.取反应后的溶液于试管中,加入锌粉冒气泡C.用洁净的玻璃棒蘸取反应后的溶液,滴在pH试纸上,测得溶液的pH<7D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀D
相关文档
- 2019九年级化学上册 第2章 身边的2021-11-1216页
- 2020中考化学复习方案主题三身边的2021-11-1225页
- 新课标RJ2020中考化学复习方案主题2021-11-129页
- 包头专版2020中考化学复习方案主题2021-11-1215页
- 新课标RJ2020中考化学复习方案主题2021-11-1241页
- 徐州专版2020中考化学复习方案第22021-11-1258页
- 呼和浩特专版2020中考化学复习方案2021-11-1215页
- 2020中考化学复习方案主题三身边的2021-11-125页
- 2019九年级化学上册 第二章 身边的2021-11-1210页
- 河北专版2020中考化学复习方案主题2021-11-1129页