- 1.10 MB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
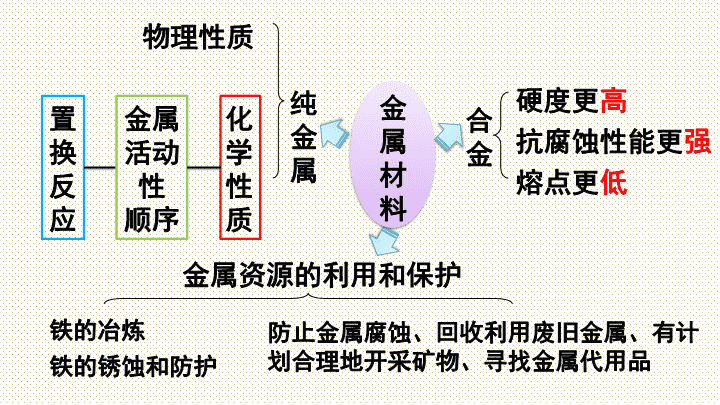
第八单元
金属和金属材料
小结与复习
纯
金
属
物理性质
化学
性质
金属
活动性
顺序
合金
硬度更
高
抗腐蚀性能更
强
熔点更
低
金属资源的利用和保护
铁的冶炼
防止金属腐蚀、回收利用废旧金属、有计划合理地开采矿物、寻找金属代用品
金
属
材
料
置换
反应
铁的锈蚀和防护
考点一 金属材料及其用途
1.金属材料包括:
__________和________。
2.合金
(1)定义:在金属中加热熔合某些金属或非金属形成的具有____________的物质。
(2)性能:合金的____________比组成它们的纯金属高,_____低,抗腐蚀性能________。
纯金属
合金
金属特征
强度和硬度
熔点
强
合金在物质分类中属于混合物,且至少含一种金属,
合金的用途比纯金属
广泛
。
注意
(3)
常见的两种铁的合金
________
:含碳量
2%
~
4.3%
的铁合金,硬度大、韧性小。
________
:含碳量
0.03%~2%
的铁合金,较硬,韧性佳。其中
__________
中含有铬、镍,不易生锈,抗腐蚀性能好,常用于制造医疗器械。
生铁
钢
不锈钢
金属的
性质
在很大程度上决定了金属的用途,但这不是唯一决定
的
因素,还需考虑
价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响
等多种因素。
3.
金属的用途
共性
个性
常温下一般是固态
汞-液态
大多呈银白色金属光泽
铜-紫红、金-黄、铁粉-黑
一般密度较大,熔点较高
一般具有良好的导电性
、
导热性
、
延展性
考点二 金属的物理性质
【练习
1
】
(2018湖南湘西州中考)下列有关“金属之最
”
的描述中,属于金属物理性质的是( )
A.
钙是人体中含量最多的金属元素
B.
铁是世界年产量最高的金属
C.
铝是地壳中含量最多的金属
D.
银是导电导热性
最好的
金属
【练习2】
(2018辽宁本溪中考)关于金属及合金的说法错误的是( )
A.
合金中至少含有两种金属元素
B.
生铁和钢是常见的铁合金
C.
黄铜的硬度比纯铜的硬度大
D.
焊锡的熔点比纯锡的熔点低
A
D
1.
金属活动性顺序
K Ca Na
Fe Sn Pb (H)
Pt Au
Mg
Al
Zn
Cu
Hg
Ag
金属活动性由强到弱
(1)在金属活动性顺序里,金属的位置越靠前,它的活动性就越强
,
越容易与
氧气
发生反应;
(2)在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
(3)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
考点三
金属的化学性质
氢前可换氢
前金换后金
许多金属都能与氧气反应,但反应的难易和剧烈程度不同。
(1)
镁、铝在常温下就能与氧气反应;
(2)
铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
(3)
金在高温下也不与氧气反应(
真金不怕火炼
)。
2.金属与氧气反应
4Al + 3O
2
=== 2Al
2
O
3
2Cu + O
2
=== 2CuO
△
3Fe + 2O
2
=== Fe
3
O
4
点燃
3.金属与盐酸、稀硫酸的反应
(氢前可换氢)
Mg + H
2
SO
4
===MgSO
4
+ H
2
↑
Zn + H
2
SO
4
=== ZnSO
4
+ H
2
↑
Fe + H
2
SO
4
=== FeSO
4
+ H
2
↑
Mg + 2HCl ====MgCl
2
+ H
2
↑
Zn + 2HCl === ZnCl
2
+ H
2
↑
Fe + 2HCl === FeCl
2
+ H
2
↑
一种
单质
与一种
化合物
反应,生成另一种
单质
与另一种
化合物
的反应。
置换反应:
表达式:
A+B
C
==B
+AC
特征:一换一
4.
金属与其他
金属化合物溶液
的反应
(前金换后金)
Cu+2AgNO
3
===2Ag+Cu(NO
3
)
2
2Al+3CuSO
4
===3Cu+Al
2
(SO
4
)
3
(1)
在初中阶段,金属活动性顺序的应用
不涉及
K
、
Ca
、
Na
(2)
Fe
在这两类置换反应中,都变成亚铁离子
(
Fe
2+
)
Fe + CuSO
4
=== FeSO
4
+ Cu
注意
【例
1
】
(2018广东中考)利用盐酸和硝酸银探究铁、 铜、银的金属活动性顺序,下列实验可以不需要进行的是( )
A.
铁+稀盐酸
B.
铜+稀盐酸
C.
银+稀盐酸
D.
铜+硝酸银溶液
解题思路:由金属活动性顺序的应用,验证试验的设计思路为:根据三种金属与盐酸反应的情况,可验证铁的活动性比铜、银强;然后利用铜和硝酸银的置换结果,验证铜的活动性比银强。对比四个实验,不做实验
C
也不影响三种金属活动性的判断。故选
C
C
【练习
3
】
(
2018新疆中考)如图是探究铁和铜金属活动性的实验,关于此实验说法
错误的是( )
A.
铁丝需要砂纸打磨
B.
溶液由蓝色变为无色
C.
金属活动性强弱:
Fe>Cu
D.
化学反应方程式为
Fe+CuSO
4
=Cu+FeSO
4
B
【例
2
】
(2018湖北宜昌中考)取一定量的
Mg
放入
Cu(N
O
3
)
2
和
AgN
O
3
的混合溶液中
,
充分反应后过滤,得到固体和滤液。下列说法错误的是( )
A.
固体中只有
Ag
时,滤液一定呈蓝色
B.
固体中有
Cu
和
Ag
时,滤液一定呈无色
C.
固体中一定有
Ag
,滤液中可能有
AgN
O
3
D.
固体中可能有
Cu
,滤液中一定有
Mg( N
O
3
)
2
解题思路:镁比铜活泼,铜比银活泼,将一定量的镁粉加入
AgNO
3
和
Cu
(
NO
3
)
2
的混合溶液中,镁先和
AgNO
3
反应,后和
Cu
(
NO
3
)
2
反应。固体中一定有
Ag
,
可能有
Cu
;滤液中一定有
Mg
(
NO
3
)
2
,可能有
Cu(N
O
3
)
2
或
Cu(N
O
3
)
2
、AgNO
3
。对于选项
B
,固体中有
Cu
和
Ag
时,可能是镁置换了部分
Cu
(
NO
3
)
2
,滤液可能呈蓝色,故
B
错误
B
【例
3
】
某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A.Zn B.Cu C.Mg D.Ag
解题思路:本题
主要考查对
“
有关
化学反应方程式计算
”
等考点的理解和运用。
5.6g
铁与
足量稀硫酸充分反应生成氢气
0.2g
,因此铁中混有的金属不可能是铜或银;
5.6g
锌、镁与
足量稀硫酸充分反应生成氢气分别是
0.17g
、
0.47g
。由此可知,不纯的铁中,如果含有锌,则生成的氢气小于0.2g,如果含有镁,则生成的氢气大于0.2g。
C
考点四
铁的冶炼
1.
一氧化碳还原氧化铁
(1)
实验装置
(
如图
)
(2)
实验步骤
一氧化碳
酒精喷灯
早出
早退
迟到
晚归
(3)
实验现象:红棕色粉末逐渐变为
______
色,澄清石灰水变
________
,尾气燃烧产生
_______
火焰。
黑
浑浊
蓝色
Fe
2
O
3
+ 3CO ==== 2Fe + 3CO
2
高温
防爆炸
防氧化
防倒吸
点燃或收集
【注意】
①先通
CO
(
早出
)
②实验完毕后要先撤掉酒精喷灯,继续通入
CO
(
晚归
)
③
CO
有毒,要进行尾气处理
(1)
原料:
铁矿石
(2)
原理:
在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石中还原出来。
(3)
主要设备:
炼铁高炉
2.
工业炼铁
石灰石
焦炭
空气
Fe
2
O
3
+ 3CO ==== 2Fe + 3CO
2
高温
焦炭:
①燃烧提供热量
②产生一氧化碳
石灰石:
将铁矿石中的
SiO
2
转变为炉渣
C + O
2
=== CO
2
C + CO
2
=== 2CO
点燃
高温
考点五 金属资源的保护
1
.金属的锈蚀与保护
(1)
铝在空气中耐腐蚀的原因:
_______________________________________________________________________________
。
(2)
铁生锈的条件:铁与空气中的
________
和
________
反应生成铁锈
(
主要成分是
Fe
2
O
3
)
。铁锈疏松易吸水,若不及时除去,会加快铁制品的锈蚀速度。
铝在空气中与氧气反应,其表面会生成一层致密的氧化铝
薄膜,阻止内部的铝进一步氧化
氧气
水蒸气
问题:
如何防止铁生锈呢?
(3)
防锈措施:①
________________________
,如菜刀用完后擦干挂起来。
②
__________________________
,如:刷漆、涂油、电镀等。
③还可以通过添加其他金属或非金属制成
合金
,如不锈钢。
2
.保护金属的有效途径
(1)______________________
。
(2)______________________
。
(3)
有计划
合理
地开采矿物。
(4)
寻找金属的代用品。
保持金属表面洁净、干燥
金属表面涂上一层保护膜
防止金属腐蚀
回收利用废旧金属
考点六
涉及杂质问题的计算
1
.化学方程式所表示的物质间的质量关系是
__________
间的关系。
2
.当参加反应的物质或生成的物质含有杂质时,要换算成纯物质的质量,再进行计算。
3
.各物质间的关系
______________
=含杂质物质的质量
×
纯度
(
或含量
)
纯净物
纯物质的质量
【练习
4
】
(2018四川巴中中考)用“W”形管进行微型实验,如下图所示。下列说法错误的是( )
A.
a
处红棕色粉末变为黑色
B.a
处实验结束时先停止通入
CO
,后
停
止加热
C.b
处澄清石灰水变浑浊证明有二氧化碳生成
D.
可利用点燃的方法进行尾气处理
【练习
5
】
(湖南株洲中考)用
1000 t
含有氧化铁
80%
的赤铁矿石,理论上可以炼出含铁
97%
的生铁的质量约是
______
。
B
577.3t
易错点归纳
1
.铁与盐酸、稀硫酸以及某些金属化合物溶液发生置换反应时,生成的是亚铁离子
(
Fe
2
+
)
,而不是铁离子
(
Fe
3
+
)
。
2
.金属与其他金属化合物溶液发生反应:
①
在金属活动性顺序里,排在前面的金属才能置换出排在后面的金属;
②
金属化合物必须能溶于水;
③
金属不能是特别活泼的钾、钙、钠;
④
描述实验现象时,既要描述金属颜色的变化,还要描述溶液颜色的变化。
化学方程式网络构建
1.
有关铁的反应
A
的化学式
__________
Fe
2
O
3
请写出图中所涉及的化学方程式
①__________________________
②__________________________
__________________________
③__________________________
④_________
___
________________
2.有关锌、铜的反应
请写出图中所涉及的化学方程式
①__________________________
②__________________________
__________________________
③
④
⑤
__________________________
__________________________ __________________,
___________________
__
_______________________
⑥
Zn + H
2
SO
4
=== ZnSO
4
+ H
2
↑
Zn + 2HCl === ZnCl
2
+ H
2
↑
Cu+2AgNO
3
===2Ag+Cu(NO
3
)
2
Zn + CuSO
4
===ZnSO
4
+ Cu
2Cu + O
2
=== 2CuO
△
CuO + H
2
=== Cu + H
2
O
2CuO + C === 2Cu + CO
2
高温
△
CuO + CO === Cu + CO
△
相关文档
- 中考数学试题课件 基础满分循环练62021-11-067页
- 广东省2020年中考物理总复习第一轮2021-11-0661页
- 初中物理中考复习单元复习课件:第262021-11-0621页
- 江苏专版2020中考化学复习方案第一2021-11-066页
- 连云港专版2020中考生物复习方案第2021-11-0625页
- 2020九年级化学上册 第二单元 检测2021-11-064页
- 安徽专版2020中考道德与法治复习专2021-11-068页
- 初中物理中考复习单元复习课件:第152021-11-0622页
- 2018届初中地理总复习课件:专题1 地2021-11-0639页
- 北师大版数学九年级上册同步练习课2021-11-0611页