- 412.57 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
五单元知识归纳
【纵横归纳】
一、质量守恒定律
微观解释
化学反应的实质就是参加化学反应的各物质(反应物)的
重新组合而生成其他物质的过程。在化学反应中
,
反应前后原子的
没有改变
,
没有增减
,
也没有改变
,
所以一切化学反应都遵守质量守恒定律。
原子
种类
数目
质量
化学
反应
中的
变与
不变
(1)化学反应前后的五个不变
(2)化学反应前后的两个变
宏观:
__________________
微观:
________________
(3)化学反应前后的两个可能变
________________
_________________
物质种类
分子种类
分子数目
元素化合价
元素
种类
物质总质量
原子种
类
原子数目
原子质量
注意
1.质量守恒定律只适用于
变化
,
且只限定在质量方面守恒
,
一切化学变化都遵守质量守恒定律。
2.
参加反应的物质质量是指真正参与反应的物质质量
,
没有参与反应(或剩余物)的质量不能计算在内。
3.
镁条在燃烧时由于白烟逸散
,
剩余固体质量也可能减轻。
化学
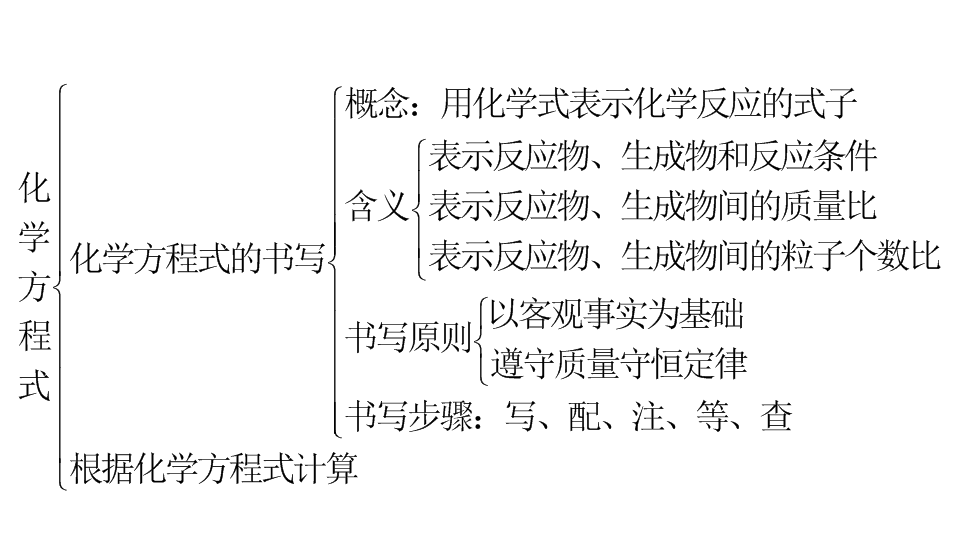
二、化学方程式
内容
知识解读
注意
概念
用
来表示
的式子
意义(以S+O
2
SO
2
为例)
质:表示反应物
,
生成物以及反应条件。(反应物是硫、氧气
,
生成物是二氧化硫
,
反应条件是点燃)量:表示反应物、生成
物之间的质量关系(即质量比)(
S:O
2
:SO
2
=32:32:64)数:表示反应物、生成物之间的粒子数关系(即粒子个数比)(S:O
2
:SO
2
=1:1:1)
化学式
化学反应
读法
(以S+O
2
SO
2
为例)
质:硫在氧气中燃烧生成
。量:每32份质量的硫与
份质量的氧气完全反应
,
生成
份质量的
。数:每1个硫原子和
个氧分子在点燃条件下反应
,
生成
个二氧化硫分子。
在读
“
质
”
和
“
数
”
时
,
不能漏掉
“
每
”
字
,
以体现这些
“
量
”
之间成正比的关系。
二氧化硫
32
64
二氧化硫
1
1
书写原则
1.以
为依据
,
不能随便臆造化学
式或化学方程式。
2
.
要遵守
,
即:等号两边各原子的
和
必须相等。
1.化学式是通过科学实验测定的不能随便更改。
2.
反应条件有
“
点燃
”“
加热(
△
)
”“
通电
”“
高温
”“
催化剂
”“
高压
”
等。
书写方法及步骤
(1)写:左边写
的化学式
,
右边写
的化学式
,
中间用短横线连接
,
反应物与生成物有多种时
,
中间用
“
+
”
连接。(2)配:在化学式前配上适当的化学计量数
,
使左右两边同种原子的个数
。(3)等:把短横线改成
“
===”。(4)注:在等号上方注明反应条件
,
在生成的气体或沉淀的化学式右边标上
“↑”
或
“↓”
符号(反应物中没有气体或难溶性固体)。
客观事实
质量守恒定律
种类
数目
反应物
生成物
相等
利用化学方程式的简单计算
依据
理论依据:化学反应都遵守质量守恒定律。计算依据:化学反应中各物质的质量成正比。
1
.在设未知数时不能带单位,而已知量都要带单位。2.有关量要写在相应化学式的正下方,带入的量必须是纯物质的量。
步骤
电解9 g水能生成多少克氢气?
(1)根据题意设
; 解:设生成氢气的质
量为
x
。
(2)正确写出相应
;
2H
2
O
2 H
2
↑
+O
2
↑
(3)写出相关物质的质量关系及
36
4
已知量、未知量;
9g
x
(4)列出
;(5)求解;
(6)简明地写出答案。
x
=1 g
答:生成1 g氢气。
未知数
化学方程式
比例式
利用化学方程式的简单计算
类型
(1)根据反应物的量求生成物的量。(2)根据生成物的量
,
求反应物的量。(3)有关含杂质的简单计算(杂质不参加反应)。(4)利用化学方程式进行综合计算。
纯度=
×
100%
【实验突破】
红磷燃烧前后质量的测定
(1)
实验装置
(
如图
)
(2)
实验步骤
①
在锥形瓶底部铺上一薄层细沙
,
在细沙上面放入一小堆干燥的红磷;
②
在锥形瓶口的橡皮塞上安装一根玻璃管
,
在其上端系牢一个
气球
,
并使玻璃管下端能与红磷接触;
③
将锥形瓶放在托盘天平上
,
用砝码调节天平
,
使天平平衡
,
记录所称的质量
m
1
;
④
取下锥形瓶
,
将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后
,
迅速用橡胶塞将锥形瓶塞紧
,
将红磷引燃;
⑤
待锥形瓶冷却后
,
重新放到托盘天平上
,
记录所称的质量
m
2
。
(3)
实验现象
①
红磷燃烧
,
产生
,
放出
;
②
玻璃管上的气球
;
③
反应后的物质总质量
m
2
与反应前的物质总质量
m
1
,
天平
。
大量的白烟
大量的热
先变大后变小
相等
保持平衡
(4)
注意事项
①
为了防止红磷燃烧而使锥形瓶炸裂
,
所以在锥形瓶底部铺上一薄层细沙;
②
在锥形瓶口的橡皮塞上安装一根玻璃管
,
并在其上端系牢一个气球是为了防止红磷燃烧放出大量的热使瓶内气体迅速膨胀而冲开胶塞;
③
冷却前瓶内气体受热膨胀气球体积变大
,
受到浮力而使实验不准确
,
所以要等锥形瓶冷却后再称量。
(5)
装置的改进:做红磷燃烧前后质
量的测定实验时
,
为了防止外界空气的进入和白烟的逸散
,
可按如图改进。
相关文档
- 人教版九年级化学复习课件第11单元2021-11-10118页
- 人教版九年级化学同步复习试题课件2021-11-1022页
- 九年级数学上册第二十二章二次函数2021-11-1016页
- 部编版九年级语文上册第二单元复习2021-11-10177页
- 北师大版数学九年级上册同步课件-42021-11-1024页
- 部编版九年级道德与法治下册第五课2021-11-1080页
- 华师版九年级上册数学同步练习课件2021-11-109页
- 江西专版2020年中考化学复习方案第2021-11-1061页
- 广东省2020年中考物理二轮复习专题2021-11-1030页
- 中考数学试卷课件 限时突破42021-11-1020页