- 236.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
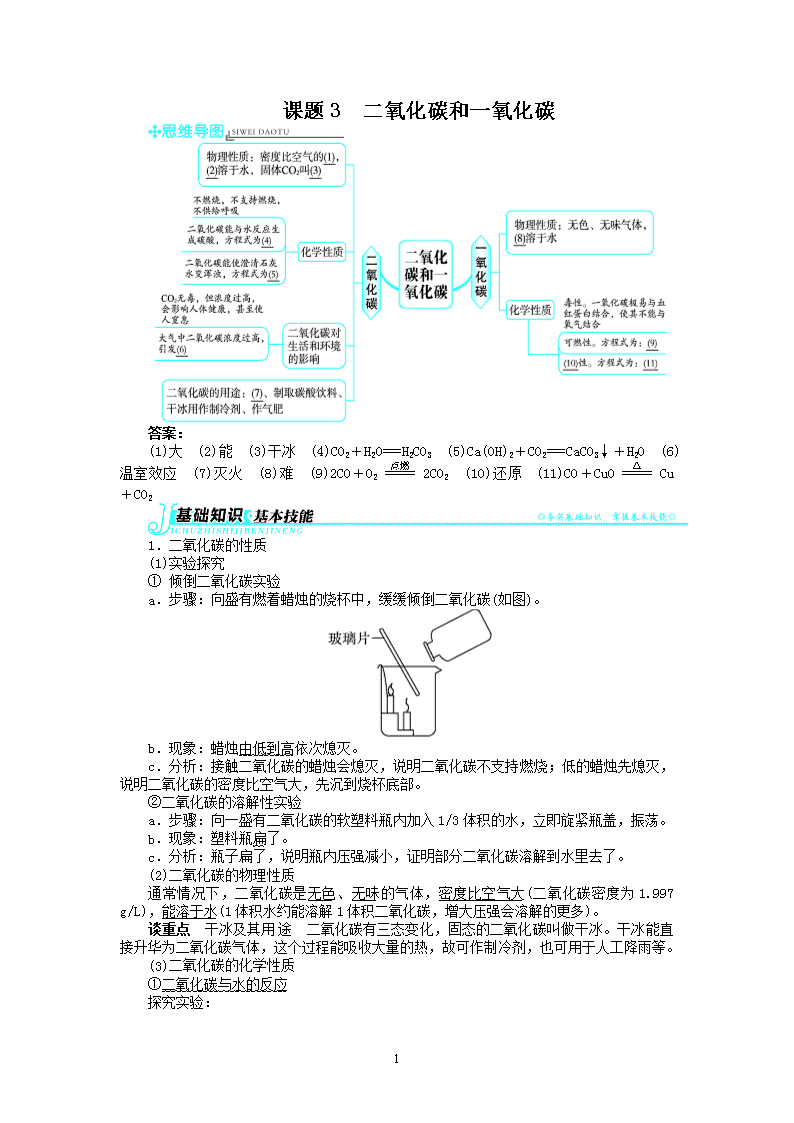
课题 3 二氧化碳和一氧化碳
答案:
(1)大 (2)能 (3)干冰 (4)CO2+H2O===H2CO3 (5)Ca(OH)2+CO2===CaCO3↓+H2O (6)
温室效应 (7)灭火 (8)难 (9)2CO+O2=====点燃 2CO2 (10)还原 (11)CO+CuO=====△ Cu+CO2
1.二氧化碳的性质
(1)实验探究
① 倾倒二氧化碳实验
a.步骤:向盛有燃着蜡烛的烧杯中,缓缓倾倒二氧化碳(如图)。
b.现象:蜡烛由低到高依次熄灭。
c.分析:接触二氧化碳的蜡烛会熄灭,说明二氧化碳不支持燃烧;低的蜡烛先熄灭,
说明二氧化碳的密度比空气大,先沉到烧杯底部。
②二氧化碳的溶解性实验
a.步骤:向一盛有二氧化碳的软塑料瓶内加入 1/3 体积的水,立即旋紧瓶盖,振荡。
b.现象:塑料瓶扁了。
c.分析:瓶子扁了,说明瓶内压强减小,证明部分二氧化碳溶解到水里去了。
(2)二氧化碳的物理性质
通常情况下,二氧化碳是无色、无味的气体,密度比空气大(二氧化碳密度为 1.997 g/L),
能溶于水(1 体积水约能溶解 1 体积二氧化碳,增大压强会溶解的更多)。
谈重点 干冰及其用 途 二氧化碳有三态变化,固态的二氧化碳叫做干冰。干冰能直
接升华为二氧化碳气体,这个过程能吸收大量的热,故可作制冷剂,也可用于人工降雨等。
(3)二氧化碳的化学性质
①二氧化碳与水的反应
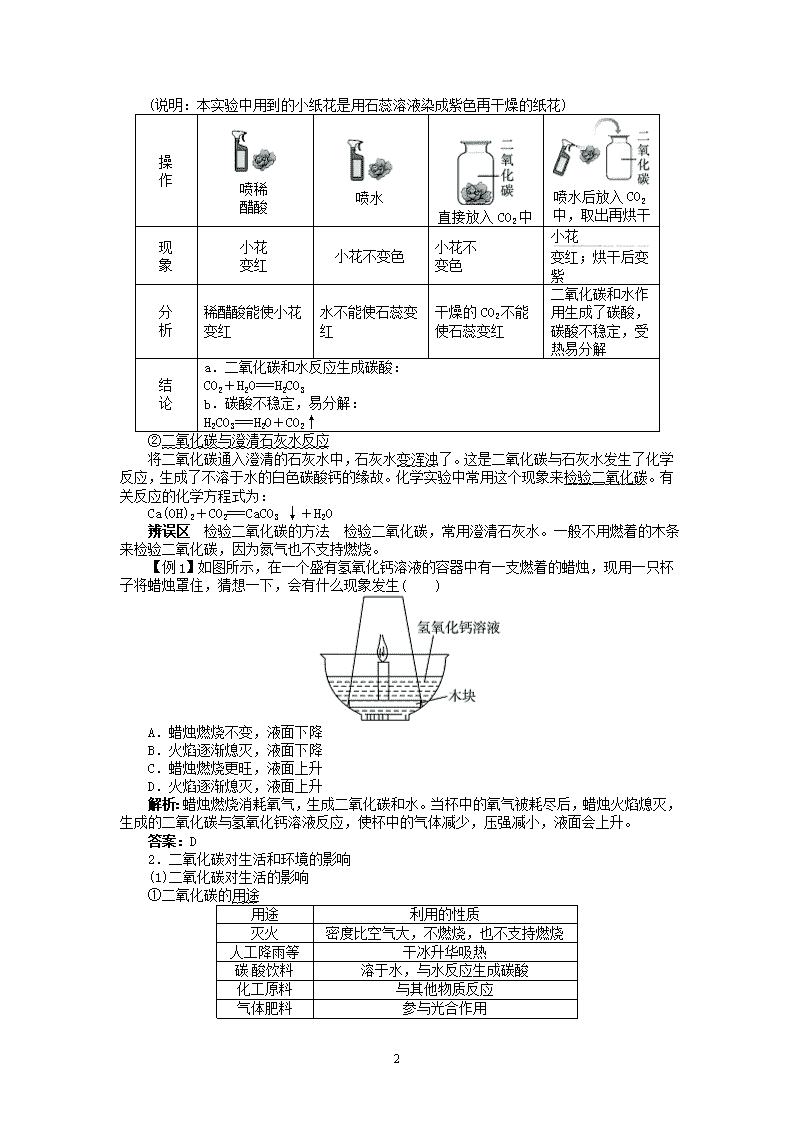
探究实验:
(说明:本实验中用到的小纸花是用石蕊溶液染成紫色再干燥的纸花)
2
操
作 喷稀
醋酸 喷水
直接放入 CO2 中
喷水后放入 CO2
中,取出再烘干
现
象
小花
变红 小花不变色 小花不
变色
小花
变红;烘干后变
紫
分
析
稀醋酸能使小花
变红
水不能使石蕊变
红
干燥的 CO2 不能
使石蕊变红
二氧化碳和水作
用生成了碳酸,
碳酸不稳定,受
热易分解
结
论
a.二氧化碳和水反应生成碳酸:
CO2+H2O===H2CO3
b.碳酸不稳定,易分解:
H2CO3===H2O+CO2↑
②二氧化碳与澄清石灰水反应
将二氧化碳通入澄清的石灰水中,石灰水变浑浊了。这是二氧化碳与石灰水发生了化学
反应,生成了不溶于水的白色碳酸钙的缘故。化学实验中常用这个现象来检验二氧化碳。有
关反应的化学方程式为:
Ca(OH)2+CO2===CaCO3 ↓+H2O
辨误区 检验二氧化碳的方法 检验二氧化碳,常用澄清石灰水。一般不用燃着的木条
来检验二氧化碳,因为氮气也不支持燃烧。
【例 1】如图所示,在一个盛有氢氧化钙溶液的容器中有一支燃着的蜡烛,现用一只杯
子将蜡烛罩住,猜想一下,会有什么现象发生( )
A.蜡烛燃烧不变,液面下降
B.火焰逐渐熄灭,液面下降
C.蜡烛燃烧更旺,液面上升
D.火焰逐渐熄灭,液面上升
解析:蜡烛燃烧消耗氧气,生成二氧化碳和水。当杯中的氧气被耗尽后,蜡烛火焰熄灭,
生成的二氧化碳与氢氧化钙溶液反应,使杯中的气体减少,压强减小,液面会上升。
答案:D
2.二氧化碳对生活和环境的影响
(1)二氧化碳对生活的影响
①二氧化碳的用途
用途 利用的性质
灭火 密度比空气大,不燃烧,也不支持燃烧
人工降雨等 干冰升华吸热
碳 酸饮料 溶于水,与水反应生成碳酸
化工原料 与其他物质反应
气体肥料 参与光合作用
②二氧化碳无毒,但不能供给呼吸。
3
当空气中二氧化碳超过正常含量时,会对人体健康产生影响,因此在人群密集的地方要
经常通风换气。浓度过高时会使人窒息。
释疑点 进入菜窖前为什么要先做灯火试验 进入久未开启的菜窖(或干涸)的深井前,
应先做一个灯火试验。方法是将一支燃着的蜡烛,放入菜窖内,若蜡烛燃烧不旺或熄灭,说
明二氧化碳的浓度较高,人不宜进入。
(2)二氧化碳对环境的影响
①大气中二氧化碳的产生和消耗途径
产生途径 消耗途径
动植物呼吸;工厂废气;含碳燃料燃烧;微生物分解 植物光合作用
以上两个方面若保持相对平衡,空气中二氧化碳的含量是相对稳定的。若产生
的二氧化碳大于消耗,会使空气中二氧化碳含量升高而导致温室效应
②温室效应
大气中的二氧化碳气体能像温室的玻璃或塑料薄膜那样,使地面吸收的太阳光的热量不
易散失,从而使全球变暖,这种现象叫温室效应。
a.产生温室效应的原因
人类消耗的能源急剧增加,向空气中排放了大量二氧化碳,同时森林遭到破坏,使二氧
化碳的吸收量减小,导致大气中二氧化碳含量不断上升。
b.温室效应的危害
气温上升导致冰川融化、海平面上升、沿海城市被淹没;地球表面的水分蒸发,使土地
沙漠化。
c.防治温室效应的措施
减少使用煤、石油、天然气等化石燃料;开发新能源,利用太阳能、风能、地热能等;
大力植树造林,禁止乱砍滥伐。
释疑点 能产生温室效应的气体 能产生温室效应的气体除二氧化碳外,还有臭氧
(O3)、甲烷(CH4)、氟氯代烷(商品名为氟利昂)等。
温室效应好可怕啊,我讨厌 CO2!
任何事物都有利弊,CO2 对人类的利大于弊,关键是我们应合理利用哦!
【例 2】联合国气候变化框架公约《京都议定书》要求发达国家限制 CO2 等温室气体的
排放量,以控制日趋严重的温室效应。请回答下列问题:
(1)绿色植物通过____________作用吸收 CO2,放出____________。
(2)为了缓解大气中的 CO2 含量的增加,以下建议可行的是______________(填字母)。
A.开发太阳能、水能、风能、地热能等新型能源
B.禁止使用煤、石油、天然气等化石燃料
C.提倡植树造林,禁止乱砍滥伐
解析:(1)绿色植物通过光合作用,将水、二氧化碳转变成有机物,同时释放氧气。(2)
能减少二氧化碳的生成及增大二氧化碳的消耗的建议都是可行的。
答案:(1)光合 氧气(或 O2) (2)AC
3.一氧化碳
(1)物理性质
通常 情况下,一氧化碳(CO)是一种无色、无味的气体,密度比空气的略小,难溶于水(1
体积水里可溶解 0.02 体积 CO)。
(2)化学性质
①可燃性:2CO+O2=====点燃 2CO2,产生蓝色火焰,放出大量的热。
②毒性:CO 有剧毒,CO 极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与
氧结合,造成生物体内缺氧,严重时会危及生命。
谈重点 使用 CO 时应注意什么 若 CO 不纯,点燃时可能发生爆炸,因此点燃前一定要
检验纯度;CO 有毒,冬天用煤取暖时一定要装烟囱,并注意通风。
③还原性:CO + CuO=====△ Cu+CO2
还原剂 氧化剂
一氧化碳和木炭一样能够夺取含氧化合物里的氧,表现还原性。
4
(3)一氧化碳的性质与用途的关系
性质 用途
可燃性 作燃料,管道煤气的主要成分就是一氧化碳
还原性
冶炼金属,如工业常用 CO 来炼铁
3CO+Fe2O3=====高温 2Fe+3CO2
CO 有利也有弊。不纯的 CO 易爆炸,CO 有剧毒,是大气污染物,它无色无味,又是“隐
形”杀手;CO 可作燃料,也是冶金工业中的重要还原剂。
(4)一氧化碳还原氧化铜的实验探究
实 验
装置
实验
步骤 ①检验 CO 的纯度 ②先通入 CO,再加
热
③实验结束后,先
停止加热,继续通
CO,直到冷却
原因
分析
防止 CO 中混有氧
气,加热时爆炸
排尽玻璃管中的空
气,防止加热爆炸
防止玻璃管中进入
空气,生成的铜重
新 被氧化
实验
现象
①黑色粉末变为红色;
②澄清的石灰水变浑浊
结论
CO 具有还原性,将氧化铜还原为铜,同时生成 CO2,即 CO+
CuO=====△ Cu+CO2
谈重点 CO 还原 CuO 实验的操作要点 ①实验开始,要先通一氧化碳再加热;实验结
束,要先停止加热,再停止通一氧化碳。即一氧化碳要“早来晚走”。“早来”的目的是排
尽试管中的空气,避免加热时发生爆炸;“晚走”的目的是保护生成的铜不被氧化。相反,
酒精灯要“迟到早退”。②因为一氧化碳有毒,所以做一氧化碳还原氧化铜实验时,一定要
有尾气处理装置,防止一氧化碳扩散到空气中。
【例 3】下列叙述中,不符合如图实验设计意图的是( )
A.说明一氧化碳具有还原性
B.说明生成物二氧化碳的密度比空气大
C.说明一氧化碳和氧化铜的反应需要加热
D.可防止有毒的一氧化碳气体对空气的污染
解析:本实验验证了一氧化碳能还原金属氧化物,具有还原性。为防止尾气中含有的
CO 对环境产生影响,采用点燃的方法除去,所以 A、C、D 三项通过本装置都能体现出来;
CO2 密度比空气大在本实验中未得到验证。
答案:B
4.CO2 和 CO 的比较
CO2 和 CO 是碳的两种氧化物,由于其分子结构不同,导致二者性质差异很大。
5
(1)物理性质
①CO 是无色、无味的气体,密度略小于空气,难溶于水;
②CO2 是无色、无味的气体,密度比空气大,能溶于水,固体二氧化碳叫干冰。
(2)化学性质
CO2 和 CO 化学性质不同:
①CO 有剧毒,它具有可燃性、还原性,但不与水发生反应,也不与石灰水发生反应;
②CO2 无毒,它无可燃性、还原性,但能跟水反应生成碳酸,跟澄清的石灰水反应,使
澄清石灰水变浑浊。
【例 4】(综合题)一氧化碳和二氧化碳只有一字之差。
(1)有人认为,二者就像孪生兄弟,这是因为____________。(填字母)
A.它们由同种分子构成
B.它们由相同元素组成
C.它们都有毒
D.它们都能溶于水
(2) 有 人 认 为 , 二 者 化 学 性 质 相 差 甚 远 , 请 给 出 一 条 支 持 他 的 理 由 :
____________________________。
(3) 其 实 , 二 者 是 可 以 相 互 转 化 的 , 请 用 化 学 方 程 式 表 示 此 过 程 :
____________________________。
解析:问题(1)要从组成上找出 二氧化碳和一氧化碳的共性;而问题(2)是找二者性质
上的差异;问题(3)二者的转化,要体现相互性。
答案:(1)B (2)二氧化碳不能燃烧,一氧化碳可以燃烧(二氧化碳能与水反应,一氧化
碳不能;或二氧化碳能与石灰水反应,一氧化碳不能;或一氧化碳能与氧化铜反应,二氧化
碳不能) (3)2CO+O2=====点燃 2CO2(或 3CO+Fe2O3=====高温 3CO2+2Fe 或 C+CO2=====高温 2CO)
5.CO2 与 CO 性质的应用
(1)鉴别 CO2 与 CO
鉴别两种物质时,要考虑利用二者性质的差异;其次,要考虑不同的性质所产生的现象
是否相同。鉴别的直 接依据是现象 的不同。鉴别 CO 与 CO2 可用下列方法:
①用燃烧的木条伸入瓶口——能被点燃的是 CO,能使燃烧的木条立即熄灭的是 CO2;
②通入澄 清的石灰水——能使澄清的石灰水变浑浊的是 CO2,不能变浑浊的是 CO;
③通入紫色 石蕊溶液——能使紫色石蕊溶液变红色的是 CO2,不能变色的是 CO;
④通过灼热的 CuO——能使黑色的氧化铜粉末变为红色的是 CO,不能变色的是 CO2。
(2)除去 CO2 中的少量 CO
CO2 中混有少量 CO 时,宜将混合气体通过灼热的 CuO,从而将 CO 转化为 CO2,不能采用
点燃的 方法,因为少量的 CO 在大量的 CO2 中不能被点燃。
(3)除去 CO 中的少量 CO2
CO 中混有少量 CO2 时,宜将混合气体通入澄清石灰水(或 NaOH 溶液),以除去少量的 CO2,
不宜通入水中,因为 CO2 在水中的溶解度不大。
【例 5—1】(探究题)CO 和 CO2 尽管分子中只差一个氧原子,但性质差别很大。下面是
四位同学设计的鉴别 CO 和 CO2 的方法,你认为不正确的是( )
①通入澄清的石灰水中 ②通入水中 ③通过灼热的氧化铜 ④闻气体的气味
A.①② B.②③
C.②④ D.①③
解析:CO2 能使澄清石灰水变浑浊,而 CO 不能;CO 能使灼热的氧化铜变为红色的铜,
而 CO2 不能,故①、③都可作为鉴别 CO 和 CO2 的方法。有些同学错误地认为,CO2 能与水反
应而 CO 不能,故也可据此鉴别 CO 和 CO2,产生这种错误认识的原因是没有想到 CO2 能与水
反应,但没有明显现象,仅用水无法鉴别,若在水中滴加紫色石蕊溶液,就可以鉴别。④中
CO 和 CO2 都无色、无味,通过气味不能鉴别,且 CO 有毒,不能直接闻,故也不正确。
答案:C
【例 5—2】(综合题)下列说法正确的是( )
6
A.二氧化碳有毒,会使人中毒死亡
B.CO2 的增加是造成温室效应的主要原因,因此空气 中 CO2 含量越低越好
C.可以用点燃的方法除去 CO2 中混有的少量 CO
D.可用澄清石灰水区别 CO2 和 CO 两种气体
解析:CO2 无毒,但不供给呼吸,A 错误;CO2 的增加是造成温室效应的主要原因,但同
时 CO2 也是光合作用的原料,B 错误;通常情况下,CO2 不支持燃烧,也不燃烧,当 CO2 中混
有少量 CO 时,CO 无法被点燃,故 C 错误;CO2 能使澄清石灰水变浑浊,CO 不能,故可用澄
清石灰水区别 CO2 和 CO。
答案:D
相关文档
- 九年级化学上册第四章生命之源--水2021-11-105页
- 人教版九年级化学上册《课题2 原子2021-11-1040页
- 人教版九年级化学上册教案(第四单元2021-11-104页
- 九年级化学上册 单元专题复习7 燃2021-11-1010页
- 人教版九年级化学上册单元测试题及2021-11-1051页
- 人教版九年级化学上册第7单元复习2021-11-10164页
- 人教版九年级化学上册教案(第三单元2021-11-105页
- 九年级化学上册 题4 化学式和化合2021-11-1027页
- 人教版九年级化学上册-第三单元检2021-11-106页
- 九年级化学上册第三章维持生命之气2021-11-103页