- 1.75 MB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
课时 中和反应和
pH
考点 一
酸和碱的中和反应
1.
概念
:_______
作用生成
_______
的反应。
2.
实质
:
酸溶液中的
__
和碱溶液中的
___
结合生成
___
。
3.
应用
:
(1)
改良土壤
:
农业上用
_______
改良酸性土壤。
(2)
处理废水
:
如用熟石灰中和硫酸厂的污水
,
化学方程式
为
:__________________________
。
(3)
用于医药
:
用含
_________
的药物中和过多的胃酸
,
反应的化
学方程式为
__________________________
。
酸与碱
盐和水
H
+
OH
-
水
熟石灰
H
2
SO
4
+Ca(OH)
2
====CaSO
4
+2H
2
O
3HCl+Al(OH)
3
====AlCl
3
+3H
2
O
碱性物质
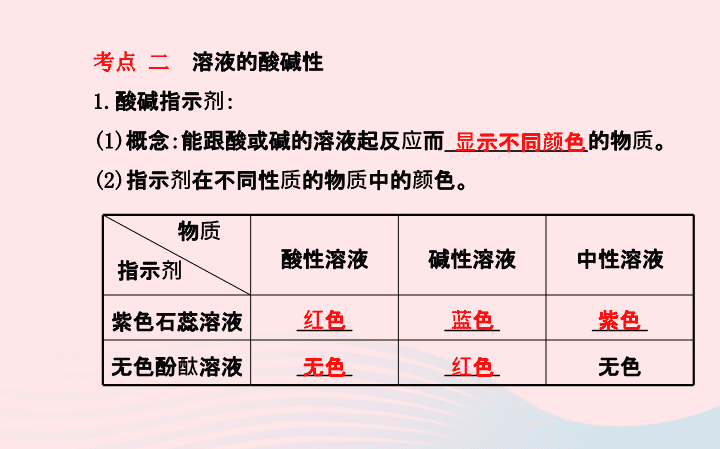
考点 二
溶液的酸碱性
1.
酸碱指示剂
:
(1)
概念
:
能跟酸或碱的溶液起反应而
_____________
的物质。
(2)
指示剂在不同性质的物质中的颜色。
酸性溶液
碱性溶液
中性溶液
紫色石蕊溶液
_____
_____
_____
无色酚酞溶液
_____
_____
无色
物质
指示剂
显示不同颜色
红色
蓝色
紫色
无色
红色
2.
溶液酸、碱度的表示方法
——pH:
(1)
溶液
pH
与酸碱性的关系。
(2)
溶液
pH
的测定方法
:
在
_______________
上放一片
pH
试纸
,
用玻璃棒蘸取被测液体滴到
_______
上
,
把
_______________
与
___________
对比
,
即可得出被测溶液的
pH,
此法测得的
pH
为整
数值。
增强
增强
白瓷板或玻璃片
pH
试纸
试纸显示的颜色
标准比色卡
(3)
溶液酸碱度的应用。
①了解土壤的酸碱性
,
农作物一般适宜在
pH
为
7
或接近
7
的土壤
中生长。
②测定雨水的
pH(
因溶解有
CO
2
,
正常雨水的
pH
约为
____,
酸雨的
pH_____),
了解空气的污染情况。
③测定人体体液的
pH,
了解人体的健康状况。
5.6
<5.6
【
易错微博
】
小博士答学生问
问题
1
酸与碱反应生成盐和水
,
因此
,
生成盐和水的反应一定是酸与碱发生的中和反应吗
?
答
:
不一定。生成盐和水的反应除酸与碱之间的反应外
,
还有金属氧化物与酸的反应、非金属氧化物与碱的反应等。
问题
2
“酸溶液
=
酸性溶液”
,“
碱溶液
=
碱性溶液”
,
这种认识是否正确
?
为什么
?
答
:
不正确。酸是指在水溶液中解离出的阳离子全部是氢离子的化合物
,
酸溶液一定显酸性
,
但显酸性的溶液不一定是酸
,
例如
:
硫酸铵显酸性
,
但它属于盐类。同理
,
碱是指在水溶液中解离出的阴离子全部是氢氧根离子的化合物。碱溶液一定显碱性
,
但显碱性的溶液不一定是碱
,
如
:
碳酸钠显碱性
,
但它是盐。
问题
3
用
pH
试纸测定溶液的
pH
时
,
若先将试纸润湿
,
对测定结果一定会产生影响吗
?
答
:
不一定。因溶液
pH
的大小与溶液的浓度有关
,
若先将试纸湿润
,
相当于将原溶液稀释。若被测溶液呈酸性
,
则测得结果将偏大
;
若被测溶液呈碱性
,
则测得结果将偏小
;
若被测溶液呈中性溶液
,
对测得结果无影响。
实验 酸和碱的中和反应的实验探究
1.
原理
:
中和反应
(
如氢氧化钠溶液与盐酸的反应
)
中
,
往往无明显的实验现象
,
无法确定反应是否发生及反应进行的程度
,
因此
,
需要借助指示剂或其他方法来判断。
2.
中和反应的实质
:
中和反应的实质是酸溶液中的氢离子和碱溶液中的氢氧根离子结合生成水。
3.
判断中和反应是否发生的方法及注意事项
:
判断依据
注意事项
方法一
借助酸碱指示剂的颜色变化
(
若用酸中和碱时
)
①
先在碱溶液中滴加几滴酚酞试液
②为防止酸过量
,
应逐滴加入
,
并不断搅拌或振荡
③当溶液恰好由红色变为无色时
,
恰好完全中和
方法二
借助反应中的温度变化
(
若用酸中和碱时
)
①
先测量加入烧杯中的碱溶液的温度
②边加酸溶液
,
边不断搅拌并及时测量、记录溶液的温度
判断依据
注意事项
方法三
借助反应中溶液
pH
的变化
(
若用碱中和酸时
)
①
先测出酸溶液的
pH
②
逐滴加入碱溶液
,
并不断搅拌
,
同时测定溶液
pH
③
需保证溶液的
pH≥7,
才能证明反应发生了
4.
问题探究
:
在
“
氢氧化钠与盐酸的反应
”
实验中
,
当溶液由红色变为无色时
,
能否说明溶液一定呈中性
?
应怎样检验
?
提示
:
不能。因酚酞试液在中性和酸性溶液中均呈无色。故当溶液由红色变为无色时
,
溶液可能是中性
,
也可能是酸性。其检验的方法有下列几种
:
方法一
:
取被测液体少量
,
滴加紫色石蕊试液
,
若试液变为红色
,
则溶液呈酸性
,
若不变色
,
说明呈中性
;
方法二
:
取被测液体少量
,
加入锌粒
,
若有气泡产生
,
说明溶液呈酸性
,
否则为中性
;
方法三
:
取被测液体少量
,
加入碳酸钠溶液
,
若有气泡产生
,
说明溶液呈酸性
,
否则为中性
(
其他合理答案均可
)
。
角度
1
结合具体的化学反应考查中和反应的实质
【
典例
1】
(2013·
德州中考
)
以下两幅微观示意图揭示了化学变化的微观实质。下列相关说法中错误的是
(
)
A.
图①表示的是化合反应
B.
图①表示的反应中元素的化合价没有改变
C.
图②说明酸碱中和反应的实质是
H
+
和
OH
-
反应生成了
H
2
O
D.
上述两图说明化学变化前后原子的种类、数目都不会发生变化
【
我的答案
】
选
B
。本题以化学反应的微观过程为背景
,
主要考查学生对化学反应类型、元素化合价的变化、中和反应实质和化学变化实质的掌握能力。图①中的反应物有两种
,
而生成物只有一种
,
故属于化合反应
;
图①中两种反应物均属于单质
,
其中元素的化合价均为
0,
而生成物属于化合物
,
其中各元素的化合价均不为
0,
所以元素的化合价在化学反应前后发生了变化
;
氢氧化钠与硫酸反应生成硫酸钠和水
,
其实质是氢氧化钠中的氢氧根离子与硫酸中的氢离子结合生成了水
;
任何化学反应前后
,
原子的种类和数目均不会发生改变。
角度
2
结合坐标图信息考查中和反应中溶液
pH
的变化
,
反应后溶液组成的探究等
【
典例
2】
(2011·
山西中考
)
已知
M
、
N
分别是稀硫酸、氢氧化钠溶液中的一种。某化学兴趣小组同学在一定量的
M
中不断滴加
N,
并测定所得溶液的
pH,
如图所示。
(1)M
是
,
该反应的化学方程式是
。
(2)
反应过程中
,
老师取
a
、
b
、
c
三处反应后的溶液
,
打乱顺序后
,
请同学们不测定溶液
pH,
用其他实验方法对三种溶液进行探究。
小明和小红分别取其中一种溶液进行实验
:
小明向所取溶液中加入
溶液
,
观察到有蓝色沉淀生成。
结论
:
是
a
处溶液。
小红向少量另一种溶液中滴加酚酞溶液
,
观察到
。
结论
:
是
b
处或
c
处溶液。
为进一步确定该处溶液成分
,
小红又设计并完成如下实验
:
剩余一种为
b
处溶液。
通过实验
,
同学们知道了酸碱反应过程中溶液
pH
的变化和用不
同方法确定溶液成分。
实验步骤
实验现象
结 论
为
c
处溶液
,
并推知溶液中的离子
有
(
填离子符号
)
【
思维导航
】
解答本题从以下两个角度入手
:
①
明确酸碱溶液的
pH
范围
,
根据图示确定药品的加入顺序
,
确定
M
、
N
的物质种类
;
②
根据图示中
a
、
b
、
c
的位置及反应现象确定溶液的酸碱性及各处的溶液组成。
【
我的收获
】
(1)
由图像中溶液的
pH
变化可判断
,
实验开始时
溶液显碱性
,
随实验不断进行溶液碱性逐渐减弱
,
最后溶液呈
酸性
,
该实验是向氢氧化钠溶液中滴加稀硫酸
,
故
M
是氢氧化
钠
,N
是稀硫酸。
(2)
生成的蓝色沉淀是氢氧化铜
,
需要氢氧化钠和可溶性铜盐
反应
,
可溶性铜盐有
CuCl
2
、
Cu(NO
3
)
2
、
CuSO
4
等
,
所取溶液应是
a
处溶液
;
所取溶液是
b
处或
c
处溶液
,
溶液呈中性或酸性
,
滴加酚
酞溶液
,
溶液呈无色
;c
处溶液中含有
Na
+
、
H
+
、 等离子
,
呈酸
性
,
能使紫色石蕊溶液变红
,
能与碳酸钠溶液生成二氧化碳气
体
,
能与
Zn
等活泼金属反应生成氢气等。
答案
:
(1)
氢氧化钠
(
或
NaOH)
2NaOH+H
2
SO
4
====Na
2
SO
4
+2H
2
O
(2)CuSO
4
[
或
CuCl
2
或
Cu(NO
3
)
2
]
溶液呈无色
(
或酚酞不变色或
酚酞呈无色
)
实验步骤
实验现象
结 论
取少量溶液
,
向其中加入石蕊溶液
(
合理即可
)
溶液变红色
Na
+
、
H
+
、
【
拓展延伸
】
中和反应中溶液
pH
的变化
(1)
酸中加入碱溶液
,
酸中的
H
+
和碱溶液中的
OH
-
结合生成水
,H
+
的数目减小
,
酸性逐渐减弱
,pH
增大
,
当加入的碱溶液与酸溶液中的
H
+
完全反应时
,
溶液呈中性
,pH=7,
加入的碱溶液过量时
,
溶液呈碱性
,pH>7
。
(2)
碱中加入酸溶液时
,
碱性逐渐减弱
,pH
减小
,
恰好反应时
,pH=7,
加入酸溶液过量时
,pH<7
。
酸碱中和反应中
pH
的变化如图所示
:
要点
溶液的
pH
与酸碱性的关系
1.pH
与溶液酸碱性及指示剂的显色情况
(
通常
):
溶液酸
碱性
pH
无色酚
酞溶液
紫色石
蕊溶液
酸性
pH<7,
且
pH
越小
,
酸性越强
无色
红色
碱性
pH>7,
且
pH
越大
,
碱性越强
红色
蓝色
中性
pH=7
无色
紫色
2.
改变溶液
pH
的方法:
(1)
酸性溶液
pH
增大。
(2)
碱性溶液
pH
减小。
加水稀释
加酸溶液
加水稀释
加碱溶液
角度
1
结合具体物质考查
pH
与溶液酸碱性的关系
【
典例
1】
(2013·
鄂州中考
)
一些食物的近似
pH
如下
:
下列说法中不正确的是
(
)
A.
鸡蛋清和牛奶显碱性
B.
苹果汁和葡萄汁显酸性
C.
苹果汁比葡萄汁的酸性强
D.
胃酸过多的人应少饮苹果汁和葡萄汁
食物
葡萄汁
苹果汁
牛奶
鸡蛋清
pH
3.5
~
4.5
2.9
~
3.3
6.3
~
6.6
7.6
~
8.0
【
我的答案
】
选
A
。本题考查溶液酸碱性与
pH
的关系。由题中表格信息可以看出牛奶的
pH
小于
7,
所以牛奶显酸性
;
苹果汁和葡萄汁的
pH
小于
7,
故都显酸性
;
苹果汁的
pH
比葡萄汁小
,
故酸性比葡萄汁的酸性强
;
苹果汁和葡萄汁都显酸性
,
胃酸过多的人应少饮用
,
否则会加重病情。
角度
2
结合溶液的
pH
或溶液使酸碱指示剂的变色情况
,
考查溶液酸碱性的判断
【
典例
2】
(2012·
泸州中考
)
根据下列实验现象可以判断某溶液一定呈碱性的是
(
)
A.
常温下
,
测得溶液的
pH<7
B.
溶液中滴入酚酞显红色
C.
溶液中滴入石蕊显红色
D.
溶液中滴入酚酞不显色
【
我的答案
】
选
B
。本题考查溶液酸碱性的判断。
pH>7
溶液呈碱性
,
使酚酞变红色的一定显碱性
,
使石蕊变红色的一定显酸性。使酚酞不变色的可能为中性溶液也可能为酸性溶液。
相关文档
- 杭州专版2020中考化学复习方案课时2021-11-1110页
- 人教版化学九下《酸和碱的中和反应2021-11-119页
- 人教版化学九年级下册第10单元酸和2021-11-116页
- 九年级化学下册[人教版]第10单元酸2021-11-118页
- 人教版九年级下册导学案课题1常见2021-11-116页
- 人教版化学九下《酸和碱的中和反应2021-11-119页
- 人教版化学九年级下册第10单元酸和2021-11-115页
- 人教版化学九年级下册第10单元试卷2021-11-105页
- 人教版化学九下《常见的酸和碱(一)》2021-11-101页
- 人教版九年级全册优秀教案第10单元2021-11-105页