- 830.50 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第八单元《金属和金属材料》单元测试题
一、选择题
1.鞍钢集团全力支持上海世博会,为上海虹桥交通枢纽建设提供4.7万吨精品钢材。关于钢的说法不正确的是
A.钢是纯净物 B.钢是铁合金
C.钢的含碳量低于生铁 D.钢的性能优于生铁
2. 芯片是电脑、“智能”加点的核心部件,它是用高纯度硅制成的。下面是生产单质硅过程中的一个重要反应:SiO2 + 2C 高温 Si +2CO↑,该反应的基本类型是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3. “金银铜铁锡”俗称五金。在这五种金属中,有一种金属与其他四种金属的盐溶液都能发生反应,这种金属是
A.金 B.铜 C.铁 D.锡
4. 光亮的铁钉在下列几种情况下,最不容易生锈的是( )
5.下列四个实验中只需要完成三个就可以证明Fe、Cu、Ag三种金属的活动性顺序。其中不必进行的是
A.将铁片放入稀盐酸 B.将铜片放入稀盐酸
C.将铁片放入硝酸银溶液 D.将铜片放入硝酸银溶液
6. 铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。铝具有良好抗腐蚀性能的原因是
A.铝的化学性质不活泼 B.铝不与酸、碱反应
C.铝常温下不与氧气反应 D.铝表面生成一层致密的氧化铝保护膜
7.电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下:2FeCl3+Cu==2FeCl2+CuCl2。FeCl3溶液也可跟铁发生反应:2FeCl3+Fe==3FeCl2。现向FeCl3溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余。下面有关说法正确的是
A.向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+
B.若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解
C.剩余固体只含有铜
D.剩余固体中如果有铁,一定也有铜
8.小明同学用6.5 g不纯的锌粉与足量盐酸完全反应,收集到H2的质量0.205 g。已知其中只含有另一种金属杂质。这种金属杂质不可能是下列物质中的
A.铁 B.铝 C.铜 D.镁
9. 通过置换反应可判断金属活动性顺序,某同学通过实验来比较铜、铝、汞的金属活动性顺序,现有铜、铝、汞的三种单质,如果另外只用一种试剂达到实验目的,则应选用下列试剂中的
A.稀硫酸 B.氯化铝溶液 C.硝酸汞溶液 D.硫酸铜溶液
10.在一定条件下,下列转化不能由一步反应实现的是
A.Fe2O3→FeCl2 B.H2CO3→CO2 C.CuCl2→Cu D.Mg→MgO
11.有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放人硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为
A.Z、Y、X B.X、Y、Z
C.Y、X、Z D.X、Z、Y
12.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是
A.滤渣中一定有Fe粉 B.滤渣中一定有Cu粉
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu 2+
13.废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是
A.Mg、Al B.Cu、Ag C.Al、Cu D.Mg、Ag
14.相同质量的M、N两种活泼金属,分别与足量质量分数为
8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量
和反应时间的关系如右图。下列叙述正确的是 ( )
A.金属的活泼性N>M B.两个反应生成H2的体积相等
C.相对原子质量N>M D.两个反应消耗盐酸的质量一定相等
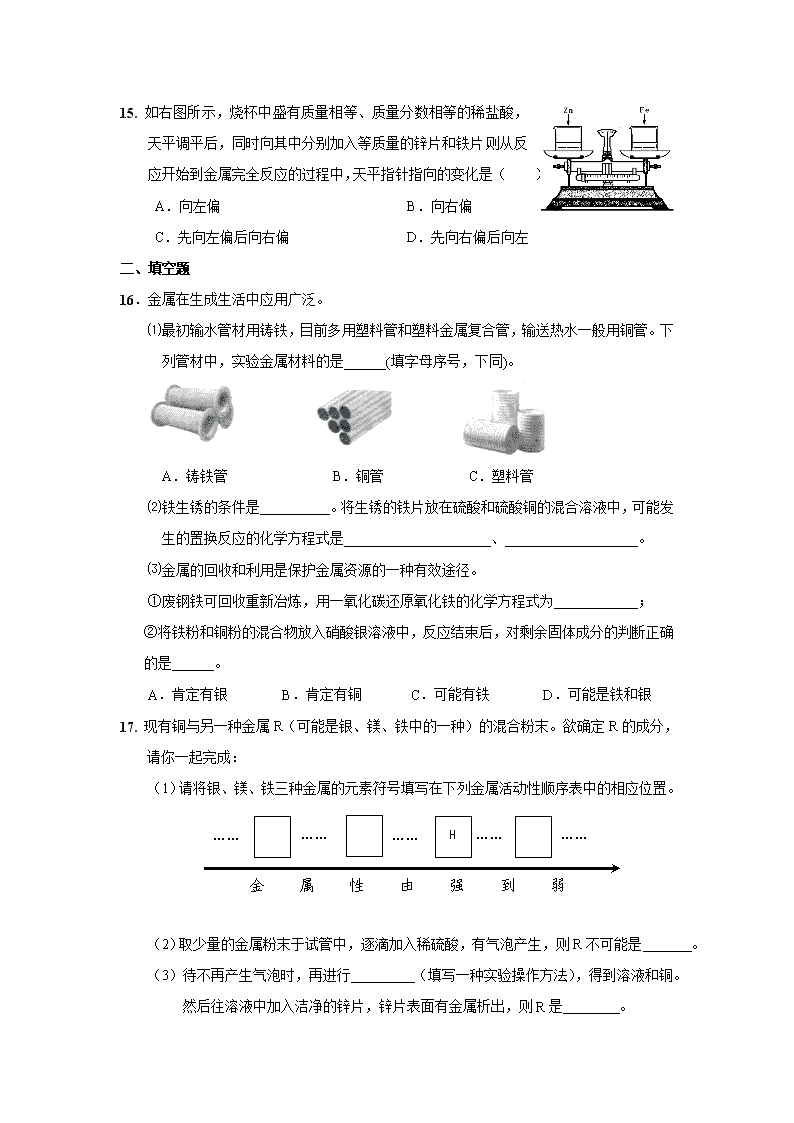
15. 如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左
二、填空题
16.金属在生成生活中应用广泛。
⑴最初输水管材用铸铁,目前多用塑料管和塑料金属复合管,输送热水一般用铜管。下列管材中,实验金属材料的是______(填字母序号,下同)。
A.铸铁管 B.铜管 C.塑料管
⑵铁生锈的条件是__________。将生锈的铁片放在硫酸和硫酸铜的混合溶液中,可能发生的置换反应的化学方程式是_____________________、___________________。
⑶金属的回收和利用是保护金属资源的一种有效途径。
①废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为____________;
②将铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后,对剩余固体成分的判断正确的是______。
A.肯定有银 B.肯定有铜 C.可能有铁 D.可能是铁和银
17. 现有铜与另一种金属R(可能是银、镁、铁中的一种)的混合粉末。欲确定R的成分,请你一起完成:
(1)请将银、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置。
……
……
金属性由强到弱
……
……
……
H
(2)取少量的金属粉末于试管中,逐滴加入稀硫酸,有气泡产生,则R不可能是 。
(3)待不再产生气泡时,再进行 (填写一种实验操作方法),得到溶液和铜。然后往溶液中加入洁净的锌片,锌片表面有金属析出,则R是 。
(4)写出金属R与稀硫酸反应的化学方程式 。该反应的基本类型属于 (选填“化合”、“分解”、“置换”或“复分解”)反应。
18. 人类生活离不开金属。
(1)铁是生活中常用的金属。下图是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热 。
①发热剂需接触到空气才会发热,原因是铁要与
、 等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是
。
(2)应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4 溶液 B.Mg和MnSO4 溶液 C.Mn和FeSO4 溶液
①写出Fe 和CuSO4 溶液反应的化学方程式 。
②Mn、Fe、Mg 、Cu四种金属的活动性由强到弱的顺序 。
19. 某工厂产生的铜屑中含有少最铁屑.现要回收利用其中的铜,需除去其中的铁屑,张山同学设计了甲、乙两个实验方案:
(1)以上两个实验方案中,从回收利用率角度考虑,你愿意选择 。
(2)两个方案中都有过滤操作,该操作中必须用到的玻璃仪器有
(3)写出两个实验方案中有关反应的化学方程式:
方案甲
方案乙
(4)你能否再设计一个不同原理的方案?写出你的方案
20.钛具有硬度大、密度小、熔点高、抗腐蚀性远优于不锈钢等优良性能,被誉为“未来金属”。地球表面富含钛铁矿石,钛铁矿石的主要成分是FeTiO3。
⑴ 已知FeTiO3中钦的化合价为+4价,则铁的化合价为 。
⑵ 冶炼金属钛时,将铁铁矿石转化为下TiCl4,TiCl4再与Na在一定条件下反应生成Ti和NaCl。
请写出后一步反应的化学方程式: (不要求标出反应条件),其反应类型是 。
⑶ 在冶炼钛的同时,还得到金属铁,请举出铁的一种用途: 。
⑷ 铁比钛易生锈,请写出防止铁生锈的一种方法: 。
21.青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具。
(1)图中标示的物质属于金属材料的有
______________(填序号)。
(2)灯管后面的反光片为铝箔。铝块能制成
铝箔是利用了铝的_____________性。
(3)铝比铁活泼,但铝箔比铁螺丝钉耐腐蚀。
铝制品耐腐蚀的原因是
_________________________ _______。
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是________________________________________。
22.钢铁在生产、生活中有广泛的用途。建造上海世博会的中国馆
——“东方之冠”的核心筒就是用四根巨型钢筋混凝土制成的,
其中用了大量的钢铁。
(1)钢铁属于 (填“纯净物”或“混合物”);
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁Fe2O3)、空气等为主要原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:
;
(3)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的 和 共同作用的结果;
(4)为了防止钢铁锈蚀,人们常采用 的方法(任写一种)来达到目的。
(5) 市场上有一种含铁粉的麦片,食用后在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为
。这种麦片必须真空保存,原因是 。
23.置换反应是化学反应的基本类型之一。金属与盐溶液之间的置换反应,一般是活动性较强的金属可把活动性较弱的金属从其盐溶液中置换出来。非金属单质也具有类似金属与盐溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,如在溶液中可发生下列反应:
C12+2NaBr=2NaCl+Br2 ; Br2+2KI=2KBr+I2; I2+Na2S=2NaI+S↓
由此可判断下列化学方程式书写错误的是 。
A.C12+2NaI = 2NaCl+I2 B.I2+2KBr = 2KI+Br2
C.Br2+Na2S = 2NaBr+S↓ D.C12+K2S = 2KCl+S↓
24.人们常说的“五金”是指“金、银、铜、铁、锌”,根据所学知识判断,不能与盐酸反应的金属是 ① (填名称)。世界上常用黄金作金融储备、货币等,其原因是 ② 。黄铜是铜锌合金,其硬度比纯铜 ③ (填“大”、“小”或“相同”)。
三、实验探究题
25.某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液。实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与。
【提出问题】废液中含有什么物质?
【交流表达】
(1)小明通过观察,认为废液中一定含有硫酸铜。他观察到的现象是 。
(2)小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是:
。
【作出猜想】小华认为废液中还可能含有硫酸。
【实验验证】(1)小华测得废液的pH小于7,证明废液中含有硫酸。用pH试纸测定溶
液pH的方法: 。
(2)小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论。小明的实验
现象是 。
通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸。
【拓展应用】
(1)若将废液中的溶质全部转化为硫酸亚铁,应向废液中加入过量的 。写出该反应过程中的一个化学方程式 。
(2)反应完全后,过滤,滤渣中物质为 ,滤液中溶质为硫酸亚铁。
四、计算题
26.我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑黄铜中的其他杂质)。将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次
第二次
第三次
连续加入盐酸的体积/mL
10
10
10
生成氢气的质量/g
0.08
0.08
0.04
(1)从上表数据分析,小华用10 g合金粉末总共收集到氢气_______g;
(2)求该合金中铜的质量分数。
参考答案
一、选择题
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
C
C
B
C
D
D
C
D
A
B
C
B
C
D
二、填空题
16. ⑴AB ⑵潮湿空气 Fe+H2SO4=FeSO4+H2↑ Fe+CuSO4=FeSO4+Cu
⑶①3CO+Fe2O32Fe+3CO2 ②AC
……
……
金属性由强到弱
……
……
……
Mg
Fe
Ag
17. (1)
(2)银(或Ag)
(3)过滤;铁(或Fe)
(4)Fe + H2SO4 = FeSO4 + H2↑;置换
18.(1)①水、氧气 ②加速铁粉生锈,更快地放出热量
(2) ①Fe+ CuSO4 === Fe SO4+ Cu ②Mg Mn Fe Cu
19.(1)方案乙 (2)漏斗、烧杯、玻璃棒
(3)方案甲:Fe +CuSO4=== FeSO4+Cu 方案乙:Fe +H2SO4=== FeSO4+ H2↑
(4)能 用磁铁吸
20. ⑴ +2 ⑵ 4Na + TiCI4=Ti +4NaCl 置换反应 ⑶ 铁用于制作机床底座
⑷ 铁表面刷油漆
21.(1) ①②④ (2) 延展 (3) 铝与氧气反应表面形成致密氧化膜 (4) CuSO4和Al2(SO4)3或硫酸铜和硫酸铝(其他合理答案均可)
22. (1) 混合物 (2) 3CO+Fe2O32Fe+3CO2 (3) 氧气(O2)和水( H2O) 或
水(H2O)和氧气(O2) (4) 喷漆(合理答案均可) (5) Fe+2HCl=FeCl2+H2↑防止铁与氧气、水蒸气等反应而变质
23. B
24.①金、银、铜 ②化学性质稳定 ③大
三、实验探究题
25.【交流表达】(1)溶液显蓝色
(2)铁丝与稀硫酸(或硫酸铜溶液)反应生成硫酸亚铁
(或反应生成的硫酸亚铁不与其他物质反应)
【实验验证】(1)将待测液滴到试纸上,把试纸呈现的颜色与标准比色卡比较,确定 pH
(2)滴加一定量氢氧化钠溶液后才有沉淀生成
【拓展应用】(1)铁片(或 Fe、铁粉、铁丝等)
Fe + H2SO4=FeSO4 + H2↑(或 Fe + CuSO4=FeSO4 + Cu)
(2)铁和铜(或 Fe 和 Cu)
四、计算题
26.(1)0.2g
(2)解:设该合金中锌的质量为 x
Zn + 2HCl == ZnCl2 + H2↑
65 2
x 0 .2g
=
x=6.5g (1分)
该合金中铜的质量分数为: ×100% = 35 %
答:该合金中铜的质量分数为35 % 。
答:理论上可炼出纯铁336 t。