- 398.00 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
《化学方程式》单元检测题
一、单选题
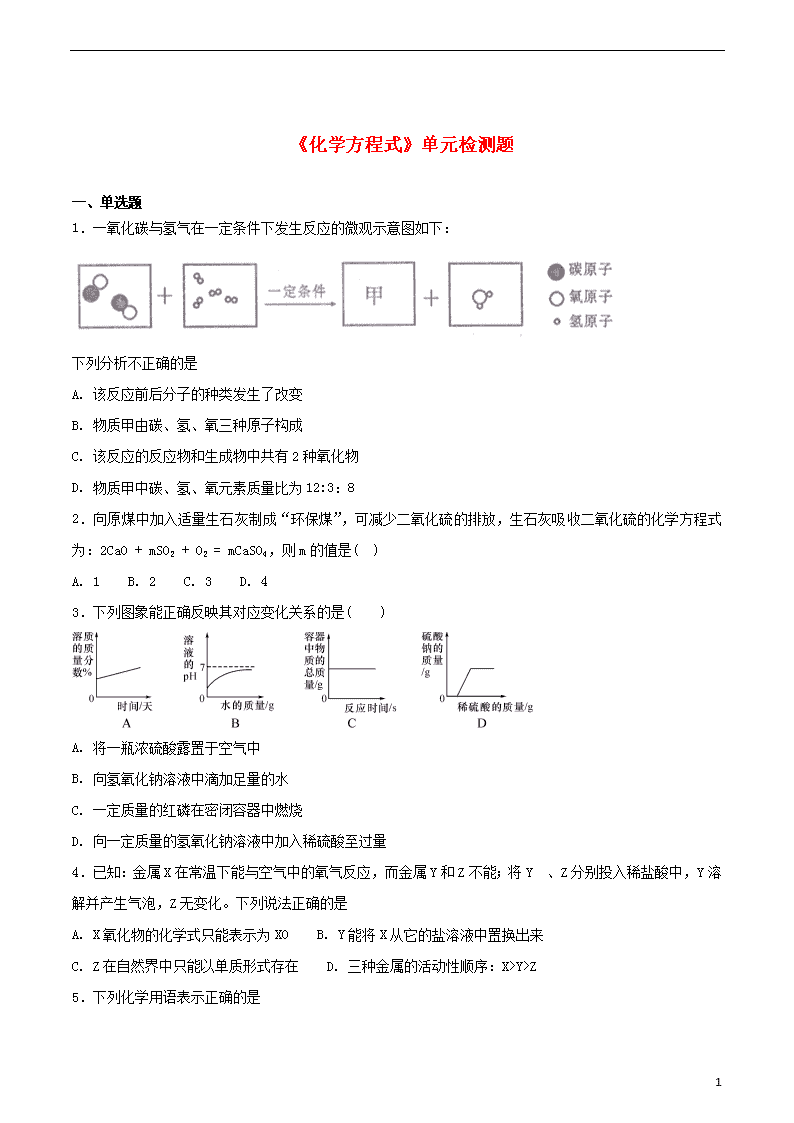
1.一氧化碳与氢气在一定条件下发生反应的微观示意图如下:
下列分析不正确的是
A. 该反应前后分子的种类发生了改变
B. 物质甲由碳、氢、氧三种原子构成
C. 该反应的反应物和生成物中共有2种氧化物
D. 物质甲中碳、氢、氧元素质量比为12:3:8
2.向原煤中加入适量生石灰制成“环保煤”,可减少二氧化硫的排放,生石灰吸收二氧化硫的化学方程式为:2CaO + mSO2 + O2 = mCaSO4,则m的值是( )
A. 1 B. 2 C. 3 D. 4
3.下列图象能正确反映其对应变化关系的是( )
A. 将一瓶浓硫酸露置于空气中
B. 向氢氧化钠溶液中滴加足量的水
C. 一定质量的红磷在密闭容器中燃烧
D. 向一定质量的氢氧化钠溶液中加入稀硫酸至过量
4.已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y 、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是
A. X氧化物的化学式只能表示为XO B. Y能将X从它的盐溶液中置换出来
C. Z在自然界中只能以单质形式存在 D. 三种金属的活动性顺序:X>Y>Z
5.下列化学用语表示正确的是
7
A. 3个铁离子:3Fe2+ B. 1个臭氧分子:O3
C. 锰酸钾的化学式:KMnO4 D. 氟离子的结构示意图:
6.在某密闭容器中,加入一定质量的甲、乙、丙、丁四种物质,一段时间后,测得各物质 的质量如下表。下列说法正确的是( )
A. 丙一定是催化剂 B. X 的值是 5.3
C. 参加反应的甲、乙质量比为 4:3 D. 丁可能是单质
7.工业上使用黄铁矿(主要成分为 FeS2)经多步反应制取硫酸,其中第一步反应为 4FeS2 + 11O2 2X + 8SO2,则 X 的化学式为( )
A. Fe B. FeO C. Fe2O3 D. Fe3O4
二、填空题
8.厉害了我的国!厉害了复兴号!复兴号动车组列车(如右下图)是由中国铁路总公司牵头组织研制、具有完全自主知识产权、达到世界先进水平的动车组列车。
(1)列车利用碳滑板与接触网接触来获取电。碳滑板通常用石墨制成,是因为石墨具有_____________性;石墨在常温下,受日光照射或与空气、水分接触都不容易起变化,说明其化学性质________。
(2)制造列车的材料有:铝合金、不锈钢、高强度钢、高分子材料等。不锈钢、铝合金属于______(选填“金属材料”或“合成材料”);铝合金的硬度比纯铝的硬度_____;在空气中,铝制品耐腐蚀的原因是____________。
(3)列车轨道建设中常用铝和氧化铁(化学式为Fe2O3)在高温条件下发生反应,生成熔融状态下的铁单质对钢轨中的缝隙进行焊接。其反应的化学方程式为:Fe2O3+2AlX+2Fe,则X的化学式为______,该反应属于______(选填“置换”或“复分解”)反应。
7
9.元素化学性质与最外层电子数有密切关系。钾原子的结构示意图为,下图表示的微粒中共有_________种元素,其中与钾原子具有相似化学性质的是_______,B与C形成化合物的化学式为__________。
10.水是生命之源。请回答下列问题。
(1)自来水消毒过程中发生化学反应的微观示意图如下
①该反应的反应物和生成物中,共有_____________种氧化物。
②参加反应的A、B两种物质的分子个数比为_________________。
(2)饮用硬度过大的水不利于人体健康,生活中常用______________的方法降低水的硬度。
(3)写出家庭中节约用水的一种做法______________________。
11.(1)炒菜时油锅着火可用锅盖盖灭,其灭火原理是________。
(2)家用液化气的主要成分之一是丙烷(C3H8),丙烷属于________ (填字母)。
a.氧化物 b.化合物 c.无机物 d.有机物
(3)热水壶中水垢的主要成分是CaCO3和________ (填化学式), 可用食醋洗涤。食醋的重要成分是醋酸(设其化学式为HA),写出其与CaCO3反应的化学方程式:________。
(4)利用厨房中的物品鉴別食盐和苏打:取一固体于碗中,加入________(填物质名称),若有________,则该固体为苏打;若无此现象,则为食盐。
12.2018年“世界水日”的宣传主题为 "Nature for water"。
(1)爱护水资源,一方面要防治水体污染,另一方面要______________。
(2)“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起____________作用,生活中常用_________检验饮用水是硬水还是软水,常用___________的方法降低水的硬度,并起到消毒杀菌的作用。
(3)下图为电解水的实验装置图。通电一段时间后,玻璃管b中收集到的气体是______;该实验说明水是由___________ 组成的。
7
(4)C1O2是饮用水常用的消毒剂,制取C1O2的化学方程式为:C12+2NaC1O2=2C1O2+2X,X的化学式__________。
(5)下列是初中化学中常见的实验。相关说法错误的是______(填序号)。
①甲实验的目的是测定空气中氧气的含量
②乙实验,水中的白磷没有燃烧,是因为温度没有达到着火点
③丙实验加水后,立即旋紧瓶盖,振荡,看到的现象是软塑料瓶向内凹陷
④丁实验,酒精灯上放的金属网罩是为了提高温度
13.用化学用语填空
(1)氖的元素符号_____
(2)人体中含量最高的金属元素_____
(3)2 个铵根离子_____
(4)氧化铝的化学式_____
14.化学用语是国际通用语言,是学习化学的重要工具。
(1)用化学用语填空。
①钾元素________。 ②2个氮原子________。
③2个水分子________。 ④铵根离子________。
⑤标出“MgO”中镁元素的化合价________。
(2)写出“3CH4”中“4”的含义______________。
三、推断题
7
15.A~G是初中化学常见的七种物质,且A、B、C、D、E属于单质、氧化物、酸、碱、盐五种不同类别的物质,它们之间的关系如图所示。(“﹣”表示相连的物质能相互反应;“→”表示物质间的转化关系;部分反应物、生成物及反应条件未标出)。已知A物质中含有三种元素;B是单质,其组成元素在地壳中的含量位居第四;物质C的溶液呈蓝色;反应①②的现象相同,都产生白色沉淀;D、G两种物质类别相同,且都易溶于水。
试回答:
(1)写出A、B、G的化学式:A_____、B_____、G_____。
(2)物质C在农业生产中的一种用途是_____。
(3)D与E反应的化学方程式是_____。
16.A、B、C、D是初中化学常见的物质,这四种物质中均含有同一种元素。其中A是无色气体单质,B、C均为氧化物,且B为有毒气体,D是大理石的主要成分。它们之间的转化关系如图所示(图中反应条件及部分反应物、生成物已省略)。
(1)写出物质A的化学式___。
(2)写出B与氧化铁反应的化学方程式____________________________________。
(3)写出实验室用D制得C的化学方程式___________________________;该反应类型属于______________。
17.A、B、C、D四种化合物,均含有同一种金属元素,它们的转化关系如图所示(部分物质已略去)。
己知A是大理石的主要成分。请回答下列问题:
(1)B的一种用途是_________;
(2)C的化学式为_________;
7
(3)B转化为D的化学方程式为__________________。
四、简答题
18.“见著知微”是化学学习者应该具备的基本素养,也是学习化学的重要思想方法。
资料一
资料二:氟及其化合物常运用于原子弹制造、航天工业等领域。氟气(F2)化学性质极其活泼,水都能在氟气中燃烧,且燃烧产物是氧气。
结合以上信息,回答下列问题:
(1)氮原子核外有____个电子层,图1﹣B中x=____,在氟元素形成的化合物中,氟元素通常显____价
(2)图2是水与氟气反应的微观示意图。图2方框内应填图3中的____选项,选择此选项的理由是______。
(3)作为航天大国,我国自主研发的运载火箭型号众多。某型火箭曾采用N2H4和H2O2作为火箭推进剂,N2H4和H2O2在点燃条件下生成一种常温下为液态的氧化物和一种单质,反应的化学方程式为_________,该反应是______(填“放热”或“吸热”)反应。
五、计算题
19.将氯酸钾和二氧化锰的固体混合物20g加入试管中,加热。待完全反应后,将试管冷却、称量。试管内固体物质为15.2g。计算:
(1)反应生成的氧气质量为_______g。
(2)列式计算原固体混合物中氯酸钾的质量为_______________。
20.实验室中发现一瓶因长期放置而被氧化的铝粉。取6.0克铝粉样品,将100克稀硫酸逐滴加入其中,固体质量随加入硫酸溶液质量的变化情况如图所示,实验过程中测得产生氢气0.1克。请计算:
(1)样品中铝单质的质量___________。(写出计算过程)。
(2)硫酸溶液的溶质质量分数为_____。
7
7
参考答案
1.B
【解析】由质量守恒定律可知,一个甲物质的分子中含有两个碳原子、一个氧原子、六个氢原子。A、由质量守恒定律可知,该反应前后分子的种类发生了改变,正确;B、一个甲物质的分子中含有两个碳原子、一个氧原子、六个氢原子构成,错误;C、该反应的反应物和生成物中共有2种氧化物,分别是一氧化碳和水,正确;D、由质量守恒定律可知,一个甲物质的分子中含有两个碳原子、一个氧原子、六个氢原子,物质甲中碳、氢、氧元素质量比为=12:3:8,正确。故选B。
2.B
【解析】根据质量守恒定律可知,反应前后原子的种类和数目不发生改变,反应前钙原子的数目为2,所以反应后钙原子的数目为2,硫酸钙前的计量系数为2,即m=2,再次验证反应前后氧原子、硫原子的个数可知当m=2时,数目相等,所以m=2。故选B。
3.C
【解析】A、浓硫酸具有吸水性,敞口放置在空气中溶质质量分数减小,图象不能正确反映其对应关系,错误;B、氢氧化钠溶液呈碱性,pH>7。向氢氧化钠溶液中加入水,则碱性减弱,pH减小,但是不会小于等于7,错误;C、在密闭容器中化学反应前后物质的总量不变,正确;D、氢氧化钠溶和稀硫酸反应生成硫酸钠和水,滴入硫酸立刻开始反应,随着反应的进行,硫酸钠的质量增加,完全反应后,硫酸钠的质量不变,图像不是从原点开始,错误。故选C。
点睛:要准确解答此类题,关键要对化学反应的知识熟练掌握,并能结合图象的数学意义,综合考虑;图象的意义要抓住三点:①抓图象的起点,②抓图象的终点,③抓图象的变化过程。
4.D
【解析】金属X在常温下能与空气中的氧气反应,而金属Y和Z不能,说明金属x比金属Y和Z活泼;将Y 、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化,说明金属Y比Z活泼。A、X氧化物的化学式不一定只能表示为XO,故A错误;B、Y不能将X从它的盐溶液中置换出来,故B错误;C、Z在自然界中不一定只能以单质形式存在,也可能以化合物 形式存在,故C错误;D、三种金属的活动性顺序:X>Y>Z,故D正确。
点睛∶金属在自然界中通常以两种形式存在一种是以单质形式存在,另一种是以化合物 形式存在。
5.B
【解析】A、3个铁离子是3Fe3+ ,Fe2+ 是亚铁离子, 故A错误;B、1个臭氧分子是O3,故B正确;C、高锰酸钾的化学式是KMnO4,锰酸钾的化学式是K2MnO4 ,故C错误;D、氯原子的结构示意图:
,故D错误。
点睛∶高锰酸钾的化学式是KMnO4,锰酸钾的化学式是K2MnO4。铁离子是Fe3+ ,Fe2+ 是亚铁离子。
6.B
【解析】由表中数据分析可知,反应前后甲的质量减少了5.2g-2.0g=3.2g,故是反应物,参加反应的甲的质量为5.2g-2.0g=3.2g;同理可以确定乙是反应物,参加反应的乙的质量为2.3g-1.5g=0.8g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应。由质量守恒定律,丁应是生成物,生成的丁的质量为3.2g+0.8g=4g,故X的数值为1.3g+4g=5.3g。A、丙的质量不变,可能作该反应的催化剂,也可能没有参加反应,错误;B、X的数值为1.3g+4g=5.3g,正确;C、参加反应的甲、乙质量比为3.2g:0.8g=4:1,错误;D、该反应的反应物为甲和乙,生成物是丁,符合“多变一”的特征,属于化合反应,丁是化合反应的生成物是化合物,不可能是单质,错误。故选B。
7.C
【解析】由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式4FeS2 + 11O2 2X + 8SO2,反应前铁、硫、氧原子个数分别为4、8、22,反应后的生成物中铁、硫、氧原子个数分别为0、8、16,根据反应前后原子种类、数目不变,则,2X分子中含有4个铁原子和6个氧原子,则每个X分子由2个铁原子和3个氧原子构成,则物质X的化学式为Fe2O3。故选C。
点睛:化学变化的实质是反应物的分子分成原子,原子重新组合成新的分子,反应前后元素种类不变,原子的种类不变、数目、质量都不变;物质的种类、分子的种类一定发生变化。
8. 导电 稳定 金属材料 大 铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化 Al2O3 置换
【解析】(1)石墨是由碳元素形成的一种单质,石墨具有导电性可以使列车利用碳滑板与接触网接触来获取电,石墨在常温下的化学性质稳定,不易与其他的物质发生反应;(2)金属材料包括纯金属和合金,铝合金属于金属材料;合金的硬度要比相应的纯金的硬度大、抗腐蚀性能好,熔点低;铝制品在空气中会与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,所以铝制品耐腐蚀;(3)根据质量守恒定律可知反应前后原子的种类、数目不变,反应前有2个铁原子、3个氧原子和2个铝原子,反应后有2个铁原子,则X 中有3个氧原子和2个铝原子,则X的化学式是Al2O3;该反应的反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,所以该反应是置换反应。
9. 3 C或Na Na2S
【解析】根据质子数相同,表示同种元素解答;根据最外层电子数相同,化学性质相似解答;根据B与C
所属元素解答。粒子结构中圆圈内的数字表示质子数。A中质子数为10,B中质子数为16,C中质子数为11,D中质子数为16,故表示3种元素;钾原子的结构中最外层电子数为1,C中最外层电子数也是1,故其中与钾原子具有相似化学性质的是C或Na;B所属的元素是硫元素,C所属元素是钠元素。钠在形成化合物时通常显+1价,硫显-2价,故B与C形成化合物的化学式为Na2S。
10. 一 1:1 煮沸 淘米水浇花(合理即可)
【解析】①由两种元素组成,且其中一种是氧的化合物叫氧化物。该反应的反应物和生成物中,只有B-水是氧化物;②据质量守恒定律可知,反应前后原子的种类、个数不变,所以参加反应的A、B两种物质的分子个数比为1:1;(2)生活中常用煮沸的方式,降低水的硬度,水中的钙镁离子随温度升高变为溶解度低的物质,从而析出。(3)节约用水的一种做法:淘米水浇花、及时关闭水龙头,农业上用滴灌代替浇灌,用洗衣服的水充厕所等。
11. 隔绝空气(或氧气) b、d Mg(OH)2 CaCO3+2HA = CaA2+CO2↑+H2O 食醋(或白醋) 气泡产生
【解析】(1)炒菜时油锅着火可用锅盖盖灭,其灭火原理是隔绝空气(或氧气),这是灭火所采取的措施之一。(2)家用液化气的主要成分之一是丙烷(C3H8),丙烷属于有机物化合物。故选b、d。(3)热水壶中水垢的主要成分是CaCO3和Mg(OH)2,可用食醋洗涤。食醋的重要成分是醋酸(设其化学式为HA),其与CaCO3反应的化学方程式是CaCO3+2HA = CaA2+CO2↑+H2O。(4)利用厨房中的物品鉴別食盐和苏打:取一固体于碗中,加入食醋(或白醋) ,若有气泡产生,则该固体为苏打;若无此现象,则为食盐,食醋与碳酸钠反应生成二氧化碳气体。
点睛∶水垢的主要成分是碳酸钙和氢氧化镁,灭火常用的方法是设立隔离带或隔绝空气或降低可燃物周围环境的温度使其低于可燃物的着火点。
12. 节约用水 吸附 肥皂水 煮沸 氧气(或O2) 氢元素和氧元素 NaCl ②
【解析】(1)根据爱护水资源的方法解答;(2)根据活性炭有吸附作用解答;根据生活中常用肥皂水检验硬水和软水;根据生活中常用煮沸的方法降低水的硬度解答;(3)根据电解水实验结论分析解答;(4)根据质量守恒定律分析解答;(5)根据相关实验分析解答。(1)爱护水资源,一方面要防治水体污染,另一方面要节约用水;(2)活性炭有吸附性,“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起吸附作用;生活中常用肥皂水检验饮用水是硬水还是软水,硬水泡沫少浮渣多,软水泡沫多浮渣少;常用煮沸的方法降低水的硬度,并起到消毒杀菌的作用;(3)由图可知,b管连接电源的正极,根据电解水实验结论“负氢正氧 氧一氢二”可知,b管收集到的气体是氧气(或O2);该实验说明水是由氢元素和氧元素组成的;(4)化学反应前后Cl、Na、O原子的个数分别为4、2、4,2、0、4,化学反应前后相差2个Cl原子、2个Na原子,又X前的化学计量数为2,故X中含1个Cl原子、1个Na原子,因此X的化学式为NaCl;(5) ①过量的红磷在空气燃烧,生成五氧化二磷固体,消耗空气中的氧气,可以测定空气中氧气的含量,正确;
②乙实验,水中的白磷没有燃烧,是因为没有与氧气接触,错误;③通常状况下,1体积的水能溶解1体积的二氧化碳,丙实验加水后,立即旋紧瓶盖,振荡,二氧化碳溶于水,瓶内压强降低,故看到的现象是软塑料瓶向内凹陷,正确;④丁实验,酒精灯上放的金属网罩是为了将火焰聚拢,提高温度,正确。故选②。
13. Ne Ca 2NH4+ Al2O3
【解析】(1)元素符号的书写要注意“一大二小”,氖的元素符号是Ne;
(2)人体中含量最高的金属元素是钙元素,元素符号可以表示为Ca;
(3)1个铵根离子含有1个氮原子和4个氢原子且带有1个单位的正电荷,因此1个铵根离子表示为NH4+,2个铵根离子就表示为2NH4+;
(4)氧化铝中铝元素为+3价,氧元素为-2价,化合价交叉得化学式为 Al2O3 。
14. K 2N 2H2O NH4+ 每个甲烷分子中含有4个氢原子
【解析】(1) 书写元素符号时应注意:①由一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写;原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字;分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个该离子,就在其符号前加上相应的数字;元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后;(2)根据标在化学式中元素右下角的数字表示一个分子中所含原子的数目解答。(1) ①钾元素的符号为K;②2个氮原子的符号为2N;③2个水分子的符号为2H2O;④铵根离子的符号为NH4+;⑤ “MgO”中氧元素显-2价,根据化合物中各元素正负化合价代数和为0可得,镁元素的化合价为+2价,故“MgO”中镁元素的化合价可表示为;(2) “3CH4”中“4”的含义是每个甲烷分子中含有4个氢原子。
点睛:解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目。
15. H2SO4 Fe Ba(OH)2 配制波尔多液 2NaOH+CO2=Na2CO3+H2O
【解析】根据A~G是初中化学常见的七种物质,且A、B、C、D、E属于单质、氧化物、酸、碱、盐五种不同类别的物质,A物质中含有三种元素,B是单质,其组成元素在地壳中的含量位居第四,所以B是铁,物质C的溶液呈蓝色,所以C中含有铜离子,反应①②的现象相同,都产生白色沉淀;D、G两种物质类别相同,且都易溶于水,A会转化成C,所以A是硫酸,C是硫酸铜,G是氢氧化钡,F可以是碳酸钠,D
是氢氧化钠,E是二氧化碳,然后将推出的物质进行验证即可。(1)A~G是初中化学常见的七种物质,且A、B、C、D、E属于单质、氧化物、酸、碱、盐五种不同类别的物质,A物质中含有三种元素,B是单质,其组成元素在地壳中的含量位居第四,所以B是铁,物质C的溶液呈蓝色,所以C中含有铜离子,反应①②的现象相同,都产生白色沉淀;D、G两种物质类别相同,且都易溶于水,A会转化成C,所以A是硫酸,C是硫酸铜,G是氢氧化钡,F可以是碳酸钠,D是氢氧化钠,E是二氧化碳,经过验证,推导正确,所以A是H2SO4,B是Fe,G是Ba(OH)2;(2)物质C在农业生产中的一种用途是配制波尔多液;(3)D与E的反应是氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式是:2NaOH+CO2=Na2CO3+H2O。
点睛:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
16. O2 3CO+Fe2O33CO2+2Fe CaCO3+2HCl===CaCl2+CO2↑+H2O 复分解反应
【解析】A、B、C、D是初中化学常见的物质,这四种物质中均含有同一种元素。B、C为氧化物,且B为有毒气体,则B为一氧化碳;D是大理石的主要成分,则D为碳酸钙;A为无色气体单质,能转化为B和C,B和C能相互转化,结合氧气和碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳和二氧化碳之间能相互转化,则A为氧气,C为二氧化碳;且二氧化碳与碳酸钙之间能相互转化,据此进行分析解答。(1)A的化学式分别是O2;(2)B是一氧化碳,一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO2Fe+3CO2;(3)D是碳酸钙,C是二氧化碳,在实验室中用碳酸钙与稀盐酸反应制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;该反应类型属于复分解反应。
点睛:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
17. 用作干燥剂 Ca(OH)2 CaO+2HCl=CaCl2+H2O
【解析】A是大理石的主要成分,则A是碳酸钙;A、B、C、D四种化合物,均含有同一种金属元素,故该金属元素是钙元素;碳酸钙在高温的条件下反应生成B,则B是氧化钙;氧化钙与水反应生成C,则C是氢氧化钙;氢氧化钙与二氧化碳或碳酸钠等反应生成碳酸钙;氧化钙与稀盐酸反应生成D,则D是氯化钙;碳酸钙与稀盐酸反应也可以生成氯化钙。(1)B是氧化钙(俗称生石灰),氧化钙能与水反应,它的一种用途是用作干燥剂;(2)C为氢氧化钙,故C的化学式为Ca(OH)2;(3) B转化为D是氧化钙与稀盐酸反应生成氯化钙和水,反应的化学方程式为CaO+2HCl=CaCl2+H2O。
18. 2 7 ﹣1 D 反应前后原子的种类及数目不变 N2H4+2H2O24H2O+N2 放热
【解析】(1)由原子结构示意图的意义可知,氮原子核外有2
个电子层,在原子中核内质子数等于核外电子数,所以x=7,大于4,在反应中易得到一个电子,所以,在氟元素形成的化合物中,氟元素通常显-1价;(2)图2是水与氟气反应的微观示意图。图2方框内应填图3中的选项D,选择此选项的理由是反应前后原子的种类及数目不变;(3)某型火箭曾采用N2H4和H2O2作为火箭推进剂,N2H4和H2O2在点燃条件下生成一种常温下为液态的氧化物和一种单质,由质量守恒定律和物质的性质可知,液态的氧化物和一种单质分别是水和氮气,反应的化学方程式为N2H4+2H2O24H2O+N2,该反应是放热反应。
19. 4.8g 12.25g
【解析】该反应是氯酸钾在加热和二氧化锰作催化剂的条件下反应生成氯化钾和氧气。(1)反应前固体混合物为20g,反应后固体混合物为15.2g,固体物质减少的质量即为生成氧气的质量,即20g-15.2g=4.8g;(2)根据反应生成的氧气的质量,可以通过化学方程式求出参加反应的氯酸钾的质量;
解:设原固体混合物中氯酸钾的质量为x
2KClO3 MnO2 2KCl+3O2↑
245 96
x 4.8g
=
答:原固体混合物中氯酸钾的质量为12.25g。
20. 0.9g, 24.5%。
【解析】解:(1)设铝的质量为x,
2Al+3H2SO4=Al2(SO4)3+3H2↑
54 6
x 0.1g
=,解得x=0.9g
故样品中铝的质量为0.9g。
(2)设与铝反应的硫酸溶质的质量为m,与氧化铝反应的硫酸溶质质量为n,
因铝的质量为0.9g,所以样品中氧化铝的质量为6g﹣0.9g=5.1g
2Al+3H2SO4=Al2(SO4)3+3H2↑ Al2O3+3H2SO4=Al2(SO4)3+3H2O
98×3 6 102 3×98
m 0.1g 5.1g n
= 解得m=4.9g =解得n=14.7g
总共消耗硫酸溶质为4.9g+14.7g=19.6g,根据图象可看到共用去硫酸溶液为80g,
硫酸的溶质质量分数为=×100%=24.5%
答:(1)样品中铝单质的质量为0.9g,(2)硫酸溶液的溶质质量分数为24.5%。
相关文档
- 2019九年级化学上册 第五单元 化学2021-11-116页
- 淮安专版2020年中考化学复习方案专2021-11-1120页
- 2019九年级化学上册 第四章 生命之2021-11-112页
- 2020九年级化学上册第五单元化学方2021-11-116页
- 《同步课时作业》九年级化学(上册)第2021-11-114页
- 2020九年级化学上册第5单元化学方2021-11-115页
- 初中化学九年级上册第五单元化学方2021-11-1119页
- 2019九年级化学上册 课题 4.4化学2021-11-112页
- 初中化学九年级上册第五单元化学方2021-11-1124页
- 2020九年级化学上册如何正确书写化2021-11-115页