- 13.03 MB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 9 课时
构成物质的微粒 认识化学元素
主题二 物质构成的奥秘
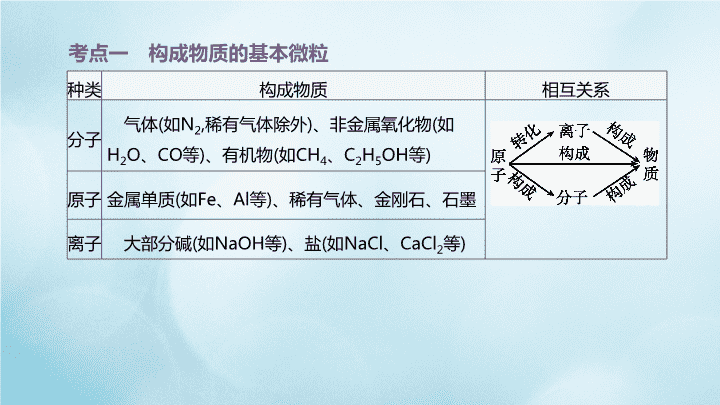
考点一 构成物质的基本微粒
种类 构成物质 相互关系
分子
气体(如N2,稀有气体除外)、非金属氧化物(如
H2O、CO等)、有机物(如CH4、C2H5OH等)
原子 金属单质(如Fe、Al等)、稀有气体、金刚石、石墨
离子 大部分碱(如NaOH等)、盐(如NaCl、CaCl2等)
考点二 分子
1.概念
由分子构成的物质, 是保持物质 的最小粒子。
2.性质
(1)分子的质量和体积都 。
(2)分子在不断地运动着。
(3)分子之间 。
(4)分子间存在相互作用力——斥力和引力。
分子 化学性质
很小
有间隔
3.分子运动的实验
(1)现象:烧杯A中的溶液逐渐由 色变为 色。
(2)结论:分子在不断 ;浓氨水能使酚酞溶液变红。
无 红
图9-1
运动
1.定义
中的最小粒子(但不是一定不可分,一定条件下可再分,如核裂变)。
2.原子的结构
(1)构成
原子是不显电性的,原子序数=质子数= 数=核外 数。
考点三 原子
化学变化
原子核
核外电子
中子
质子
核电荷 电子
(2)表示(原子结构示意图)
图9-2
质子数
各层上的电子数
(3)应用
应用分类 结论及判断依据
判断
原子、
离子
原子 核内质子数=核外电子数
离子
阴离子 核内质子数<核外电子数
阳离子 核内质子数>核外电子数
判断
元素
种类
金属元素 最外层电子数<4(氢、氦、硼除外)
非金属元素 最外层电子数≥4
稀有气体元素 最外层电子数是8(氦为2)
应用分类 结论及判断依据
判断得失
电子情况
易失电子 最外层电子数<4
易得电子 最外层电子数>4
既不易得也不易失电子 最外层电子数为8或2
化学性
质对比
原子的 数相等,化学性质相似
(续表)
最外层电子
3.相对原子质量
(1)定义:以一种碳-12原子质量的 作为标准,其他原子的质量跟碳-12原子质
量的的比值,称为该原子的 相对原子质量。
(2)近似计算式:原子质量主要集中在 上,相对原子质量≈ 数+
数。
(3)单位:相对原子质量的单位是“1”,不是“g”,一般省略不写。
原子核 质子
中子
考点四 离子
1.定义
带电的原子或原子团。
2.分类
阳离子带 电;阴离子带 电。
3.表示
在元素符号的右上角用“+”“-”号表示离子的电性,用数字表示离子所带的
电荷数,先写数字,后写正负号,当数字为“1”时,省略不写。
正 负
4.离子符号及其周围的数字
图9-3
考点五 元素
1.元素
(1)定义: 数(即 数)相同的一类原子的总称。元素属于宏观概
念,只讲种类不讲个数。
质子 核电荷
分类 内容
金属元素
“钅”字旁(汞除外),最外层电子数一般 4个,易
电子,形成 离子
非金属元素
“石”“氵”“气”字旁,最外层电子数一般 4个(H、
He、B除外),易 电子,形成 离子
稀有气体元素
稀有气体最外层电子数为8(氦为2),化学性质稳定,不易得
失电子
(2)分类
<
失去 阳
≥
得到 阴
(3)在自然界中的分布(按质量分数)
①地壳中含量居前四位的元素是 。
②生物体内含量最多的元素是 ;人体中含量最高的金属元素是 。
③空气中含量最多的元素是 。
④农作物生长必需的化学元素: 、磷、钾。
(4)元素与原子结构的关系:元素的种类由原子中 决定,元素的化学性
质和原子的 密切相关。
氧、硅、铝、铁
氧 钙
氮
氮
质子数
最外层电子数
(5)元素符号
①写法:由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个
字母大写,第二个字母小写,即“一大二小”。
②意义
分类 举例
宏观
表示一种元素 O表示__________
表示由 构成的一种物质 Cu表示___________
微观 表示组成元素的一个原子 O表示________________
氧元素
原子
物质铜
一个氧原子
2.元素周期表
(1)组成及规律
①横行(周期)
每一个横行叫作一个周期,共7个周期;同周期 数相同, 从
左至右逐渐增加。
②纵行(族)
每一个纵行叫作一个族,共18个纵行,16个族(8,9,10三个纵行共同组成一个族);
同族 数相同(化学性质相似), 数逐渐增加。
电子层 最外层电子数
最外层电子 电子层
(2)在元素周期表中,每一种元素均占据一格。如图9-4。
图9-4
还可以得出的信息有 。
原子序数 元素符号
相对原子质量
碳属于非金属元素
考向一 粒子的性质(6年6考)
1.[2019·益阳]建立宏观和微观之间的联系对学
习化学十分重要。下列宏观事实的微观解释错
误的是 ( )
A.品红在水中扩散——分子在不断运动
B.水蒸发由液态变成气态——水分子发生改变
C.NO与NO2化学性质不同——构成物质的分
子不同
D.10 mL H2O与10 mL C2H5OH混合后体积小
于20 mL——分子间有间隔
[答案] B
[解析]水蒸发由液态变成气态,
是因为水分子间的间隔发生
了改变。
2.[2019·武汉]下列说法正确的是 ( )
A.分子是化学变化中的最小粒子
B.不同元素的本质区别是电子数不同
C.原子核由电子和质子构成
D.墙内开花墙外香说明分子在不断运动
[答案] D
[解析]化学变化中的最小粒子是
原子而不是分子;不同种元素之
间的本质区别是质子数不同;原
子核由质子和中子构成;墙内开
花墙外香,是因为花香中含有的
分子是在不断运动的,向四周扩
散,使人们闻到花香。
考向二 粒子结构示意图
3.[2019·营口]根据以下几种粒子的结构示意图,回答
下列问题(填序号)。
(1)属于同种元素的粒子是 。
图9-5
[答案] (1)②和④
[解析] (1)元素是质子
数(即核电荷数)相同的
一类原子的总称,质子
数相同的粒子属于同种
元素。②和④的质子数
相同,属于同种元素。
3.[2019·营口]根据以下几种粒子的结构示意图,回答
下列问题(填序号)。
(2)在化学反应中易失去电子的粒子是 。
图9-5
[答案] (2)③
[解析] (2)③的最外层
电子数是2,在化学反应
中易失去电子。
3.[2019·营口]根据以下几种粒子的结构示意图,回答
下列问题(填序号)。
(3)具有相对稳定结构的粒子是 。
图9-5
[答案] (3)①和④
[解析] (3)①和④的最
外层电子数均为8,均具
有相对稳定结构。
3.[2019·营口]根据以下几种粒子的结构示意图,回答
下列问题(填序号)。
(4)化学性质相似的原子是 。
图9-5
[答案] (4)②和⑤
[解析] (4)②和⑤表示
的粒子为氟原子和氯原
子,最外层电子均为7,化
学性质相似。
4.[2019·宿迁节选]“宏观辨识与微观探析”是化学学科的核心素养之一。在
宏观、微观和符号之
间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图,回答问题。
(1)上述示意图中,共包含 种元素。
图9-6
[答案] (1)4
[解析] (1)从粒子结构示意图中可以看出,共包含氢、钠、硫、氯四种元素。
4.[2019·宿迁节选]“宏观辨识与微观探析”是化学学科的核心素养之一。在
宏观、微观和符号之
间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图,回答问题。
(2)A、B、C、E中属于阴离子的是 (填离子符号)。
图9-6
[答案] (2)S2-
[解析] (2)A粒子中电子数等于质子数,表示氢原子;B粒子中质子数大于电子数,
表示钠离子,属于阳离子;C粒子中质子数等于电子数,表示硫原子;E粒子中质子
数小于电子数,表示硫离子,符号为S2-,属于阴离子。
4.[2019·宿迁节选]“宏观辨识与微观探析”是化学学科的核心素养之一。在
宏观、微观和符号之
间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图,回答问题。
(3)若D表示某元素的原子,则该粒子在化学变化中容易 (填“得到”或
“失去”)电子。
图9-6
[答案] (3)得到
[解析] (3)若D表示某元素的原子,质子数等于电子数,故m为7,最外层电子数大
于4,在化学反应中易得到电子。
4.[2019·宿迁节选]“宏观辨识与微观探析”是化学学科的核心素养之一。在
宏观、微观和符号之
间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图,回答问题。
(4)若D为离子,则B、D构成的化合物的化学式为 。
图9-6
[答案] (4)NaCl
[解析] (4)B钠元素与D氯元素形成的化合物为氯化钠,化学式为NaCl。
考向三 元素和元素周期表(6年7考)
5.[2018·益阳]下列有关元素的说法不
正确的是 ( )
A.原子的质子数不同,则元素种类不同
B.Cl 与 Cl-可以相互转化
C.元素可分为金属元素和非金属元素
D.混合物中一定含有多种元素
[答案]D
[解析]决定元素种类的是原子的核内质
子数或核电荷数,所以原子的质子数不同,
元素种类不同;氯原子能通过得到电子形
成氯离子,氯离子能通过失去电子形成氯
原子;元素可以分为金属元素、非金属元
素;混合物中不一定含有多种元素,如氧
气和臭氧的混合物,含有一种元素。
6.[2019·兰州]据西安电子科技大学芜湖研究所介绍,国内5G通信芯片用氮化镓
材料制成。图9-7是氮元素在元素周期表中的信息以及镓原子的结构示意图。
下列说法不正确的是 ( )
A.氮原子核内质子数为7
B.图中x=18
C.镓原子核内中子数为31
D.氮原子的相对原子质量为14.01
图9-7
[答案] C
[解析]镓原子核内质子数为31,从原子结构示意图中无法获得原子核内中子数
的信息。
1.[2019·安徽]我国科学家最新研制出一种新型石墨烯-铝电池,手机使用这种电
池,充电时间短,待机时间长。碳、铝元素的相关信息如图9-8,有关说法正确的
是 ( )
A.它们的化学性质相同
B.碳在地壳中含量最高
C.铝的原子序数为13
D.铝的相对原子质量为26.98 g 图9-8
[答案]C
[解析]本题主要考查元素周期表。碳的原子序数为6,核外有6个电子,最外层电
子数为4,铝的原子序数为13,核外有13个电子,最外层电子数为3,最外层电子
数不同,化学性质不同;地壳中含量最多的元素是氧元素;铝的原子序数为13;相
对原子质量不能表示原子的实际质量,而是一个相对质量,是一个比值,单位为
“1”不是“g”,因此铝的相对原子质量为26.98。
2.[2018·安徽]硼是作物生长必需的微量营养元
素,硼元素的相关信息如图9-9所示。下列有关
硼的说法正确的是( )
A.相对原子质量为10.81 g
B.属于金属元素
C.原子的核电荷数为5
D.原子核外有6个电子
图9-9
[答案]C
[解析]根据元素单元格知识判
断硼元素的相对原子质量为
10.81;属于非金属元素;原子
的质子数=核电荷数=原子序
数=核外电子数=5。
相关文档
- 2019九年级化学上册 第三单元 物质2021-11-112页
- 2020九年级化学上册第三单元物质构2021-11-112页
- 2019九年级化学上册 第三章 物质构2021-11-117页
- 2020九年级化学上册第三单元物质构2021-11-115页
- 2020九年级化学上册第三单元物质构2021-11-114页
- 2019九年级化学上册 第三单元 物质2021-11-117页
- 2019九年级化学上册 第三单元 物质2021-11-115页
- 2019九年级化学上册 第三单元 物质2021-11-115页
- 2019九年级化学上册 第三章 物质构2021-11-113页
- 2020学年度初中人教版九年级化学第2021-11-118页