- 269.00 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专项(六)
质量守恒定律应用
第
4
章 认识化学变化
考点突破
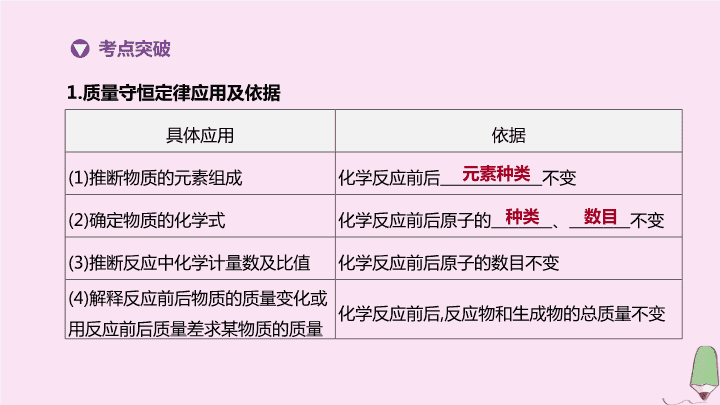
1.
质量守恒定律应用及依据
具体应用
依据
(1)
推断物质的元素组成
化学反应
前后
不变
(2)
确定物质的化学式
化学反应
前后原子的
、
不变
(3)
推断反应中化学计量数及比值
化学反应
前后原子的数目不变
(4)
解释反应前后物质的质量变化或用反应前后质量差求某物质的质量
化学反应
前后
,
反应物和生成物的总质量不变
元素种类
种类
数目
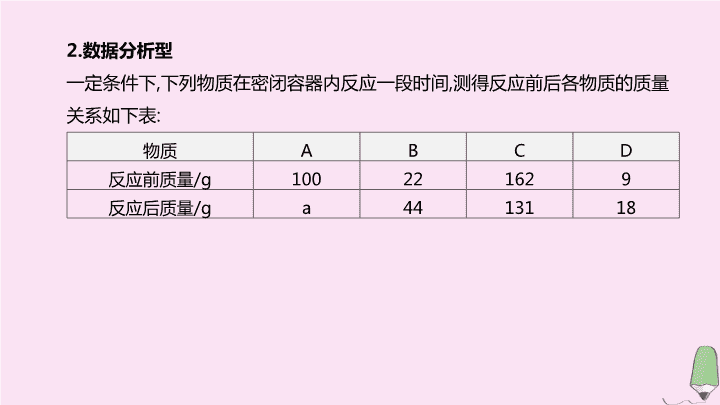
2.
数据分析型
一定条件下
,
下列物质在密闭容器内反应一段时间
,
测得反应前后各物质的质量关系如下表
:
物质
A
B
C
D
反应前质量
/g
100
22
162
9
反应后质量
/g
a
44
131
18
思路分析
(1)
定反应物、生成物
:
反应后质量增加的为生成物
,
减少的为反应物
①
a
=
②
反应物为
,
生成物为
(2)
写反应表达式
(
可判断出化合或分解反应
)
C
→
B
+
D
(3)
定变化量
31 g
22 g
9 g
(4)
分析判断
①A
(
填“一定”或“可能”
)
是该反应的催化剂
②
物质
C
(
填“属于”或“不属于”
)
化合物
③
参加反应的
B
和
D
的质量比为
100
C
B
、
D
可能
属于
22∶9
3.
微观反应示意图
某反应的微观示意图如图
G6-1:
图
G6-1
思路分析
(1)
判断有无物质剩余
:
反应前后有无相同粒子
反应
前的分子个数为
3
个
,
反应后还剩余
1
个
,
即实际参加反应的分子个数为
个
(2)
写出反应物和生成物的化学式
反应物
;
生成物
(3)
写出化学方程式
2
NO
、
CO
CO
2
、
N
2
2NO+2CO 2CO
2
+N
2
(续表)
(4)
分析
①
物质种类
属于
,
属于
②
反应物、生成物的粒子个数比
粒子个数比即为化学方程式中化学计量数之比
,
根据化学方程式
,
这四种分子个数比为
③
各物质质量比
物质质量比即为各物质的相对分子质量与化学计量
数
乘积
的
比
,
根据化学方程式
,
这
四种物质的质量比
为
④
判断反应类型
该反应
(
填“属于”或“不属于”
)
基本反应类型
氧化物
单质
2∶2∶2∶1(
合理即可
)
15∶14∶22∶7(
合理即可
)
不属于