- 6.46 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010年中考必备—2009年中考化学试题分单元汇编(第十单元)
(09肇庆)10.用pH试纸测定溶液pH的正确操作是
A.pH试纸直接浸入待测液 B.pH试纸先用水润湿再浸入待测液
C.pH试纸浸液后过一会儿观察 D.用玻棒蘸取待测液涂于pH试纸上,马上观察
(09眉山)10、下列化学知识运用错误的是( )
A、施加熟石灰可以改良酸性土壤
B、用氢氧化钠溶液清除餐具上的油污
C、用活性炭可除去冰箱异味
D、被雨淋湿的自行车应立即擦干以防生锈
(09眉山)14、下列离子能在PH = 12的水溶液中大量共存的是( )
A、SO42-、NO3-、K+、H+ B、Na+、Cl-、OH-、Al3+
C、Cl-、NO3-、K+、Na+ D、Ag+、Cl-、CO32-、K+
(09眉山)17、向澄清石灰水中通入过量的CO2,发生如下反应:Ca(OH)2 + CO2 = CaCO3↓+ H2O ,
CO2 + CaCO3 + H2O = Ca(HCO3)2 ,Ca(HCO3)2易溶于水。下列图示正确的是( A )
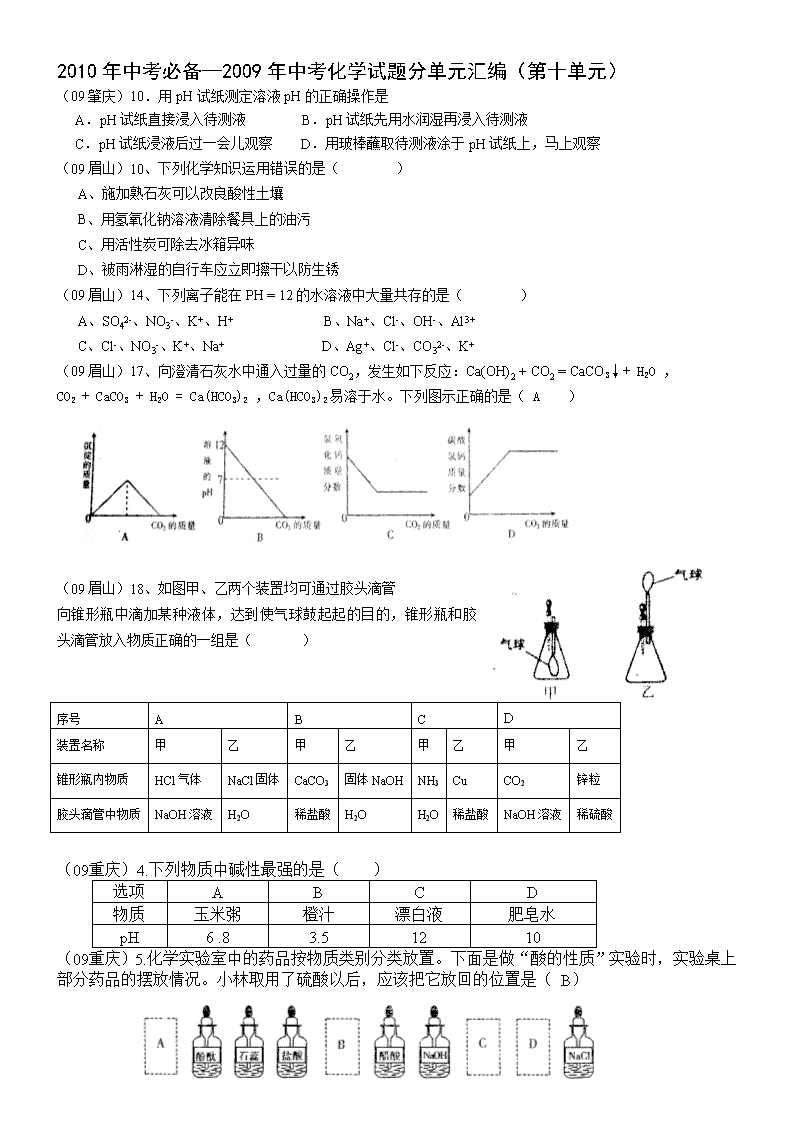
(09眉山)18、如图甲、乙两个装置均可通过胶头滴管
向锥形瓶中滴加某种液体,达到使气球鼓起起的目的,锥形瓶和胶头滴管放入物质正确的一组是( )
序号
A
B
C
D
装置名称
甲
乙
甲
乙
甲
乙
甲
乙
锥形瓶内物质
HCl气体
NaCl固体
CaCO3
固体NaOH
NH3
Cu
CO2
锌粒
胶头滴管中物质
NaOH溶液
H2O
稀盐酸
H2O
H2O
稀盐酸
NaOH溶液
稀硫酸
(09重庆)4.下列物质中碱性最强的是( )
选项
A
B
C
D
物质
玉米粥
橙汁
漂白液
肥皂水
pH
6 .8
3.5
12
10
(09重庆)5.化学实验室中的药品按物质类别分类放置。下面是做“酸的性质”实验时,实验桌上部分药品的摆放情况。小林取用了硫酸以后,应该把它放回的位置是( B)
(09重庆)6·关于物质的用途,下列说法不合理的是( )
A.稀盐酸用于除铁锈 B.碳酸氢钠用于治疗胃酸过多
C.干冰用作制冷剂 D.氢氧化钠固体用于干燥CO2
(09泉州)12.下列实验不能达到预期目的的是
A.用肥皂水区别硬水和软水 B.用碘水区别淀粉和蔗糖
C.用酚酞试液区别盐酸和食盐水 D.用点燃法区别聚乙烯和聚氯乙烯
(09福州)3.植物在缺氮的情况下,生长迟缓、叶色发黄。这时需施用的化肥是
A.KCl B.NH4HCO3 C.K2CO3 D.Ca(H2PO4 )2
(09南京)7.酶是一类重要的蛋白质,能催化生物体内的反应。某同学用查阅资料的方法研究pH对某种酶催化活性的影响,结果如图所示。据图推测,这种酶催化活性最佳的pH约为
A.pH=0
B. 1”), 纯碱属于 (填“酸”、“碱”或“盐”)类化合物。学科网
(2)结合小明的实验,请你联想紫甘蓝汁液的用途 。学科网
9.(1)< 盐
(2)代替酸碱指示剂(或检验其它物质的酸碱性)(其它合理答案也可得分)
(09黔东南)12.氢氧化钠是化学实验室中常用的试剂。学科网
(1)氢氧化钠固体曝露在空气中,容易吸收水分而使表面覆盖一层溶液(这一现象又叫“潮解”);它还能 ,这一变化的化学方程式可表示为学科网
。所以氢氧化钠固体必须密封保存。学科网
(2)实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,反应的化学方程式为:SiO2 + 2NaOH == X + H2O,试推断X的化学式为 。学科网
12.(1)吸收二氧化碳(或与二氧化碳反应) 2NaOH+CO2==Na2CO3+H2O(2)Na2SiO3
(09兰州)33.(5分)某校化学课外活动小组在一次活动中,取刚降到地面的雨水水样,每隔5分钟用pH计测定一次pH,其数据如下表:
测定时刻
6︰05
6︰10
6︰15
6︰20
6︰25
6︰30
p H
4.95
4.94
4.94
4.88
4.86
4.85
已知:正常雨水的pH约为5.6,酸雨的pH小于5.6。
(1)所取的雨水是否为酸雨? (填“是”或“否”);在测定的期间,雨水水样的酸性随着时间的变化逐渐 (填“增强”或“减弱”)。
(2) 经调查,这一地区有一座燃煤发电厂(生产过程中产生SO2),某同学设计用火碱来吸收生产过程中产生的SO2,将其转化成亚硫酸钠(Na2SO3)。请你帮他写出该反应的化学方程式: 。
(3)若用pH试纸测定雨水的酸碱度,测定方法是: 。
(09烟台) 21.(5分)化学就在我们身边,与我们的生活息息相关。请回答以下生活中的问题:
(1)“沙里淘金”说明黄金在自然界中能够以 (填“单质”或“化合物”)形式存在。
(2)葡萄表皮上因喷洒“波尔多液”而呈现的蓝色魔点,可以用厨房调料 洗净。
(3)刘大爷种的小麦出现倒伏现象,你会建议他使用化肥中的 肥。
(4)长期使用的暖水瓶内胆常有一层水垢(主要成分为碳酸钙),可以用稀盐酸除去。请写出反应的化学方程式: 。
(5)通常所说的煤气中毒是指由 (填物质化学式)引起的中毒。
21.(5分)(1)单质 (2)食醋 (3)钾 (4)CaCO3 + 2HCl=CaCl2 + CO2↑+ H2O (5)CO
(09青岛)25.位于某著名旅游区的一条母亲河,昔日被严重污染。近年来经过综合治理,河面上已见成群的鸟儿上下翻飞。为确保母亲河的治理成果,某中学环保小组的同学配合环保部门,定期对河水进行取样测试。
(1)除去水样中难溶性的固体,需将水样(填序号)_________;
①加热 ②过滤 ③蒸发 ④冷却
(2)在白瓷板上放一小片pH试纸,用玻璃棒蘸取少量(1)中所得到的液体,滴在试纸上,把试纸显示的颜色与标准比色卡比较,pH大于7,则说明该水样显_______性;
(3)由上述数据分析,该河水的主要污染物可能是(填序号)___________;
①带有酸臭味的城市生活污水 ②化工厂排放的污水
(4)2009年“中国水周”活动的宣传主题为“落实科学发展观,节约保护水资源”。水是生命之源,作为青少年,要珍惜水、保护水,让水造福人类。下列生活习惯应该摈弃的是(填序号)_____________。
①用盆接水洗菜 ②用养鱼水浇花草
③使用节水龙头 ④大量使用含磷洗衣粉洗衣服
25、(1)② (2)碱 (3)② (4)④
(09青岛)29.某化学实验室有一瓶失去标签的碱溶液,可能是氢氧化钠或氢氧化钙溶液;小王同学认为是氢氧化钙溶液。请你按小王同学的猜想,进行下列实验探究,并按要求填写写表:
猜想
实验步骤
实验现象
结论与相应的化学方程式
(若不反应可不写化学方程式)
可能
是氢
氧化
钙溶
液
方案Ⅰ:
用试管取约2mL该溶
液,向其中滴加几滴
____________溶液
_______________
该溶液是_______________,
化学方程式:
__________________________
方案Ⅱ:(选用与方案Ⅰ
不同类别的其他物质)
____________________
____________________
_______________
该溶液是_______________,
化学方程式:
__________________________
29、方案Ⅰ:无色酚酞试液 试液变红 氢氧化钙溶液
方案Ⅱ:用试管取约2mL该溶液,向其中通入二氧化碳气体 生成白色沉淀
Ca(OH)2 + CO2 == CaCO3↓+ H2O
(09青岛)30.氨气是一种重要的化工原料,在工农业生产中有广泛的应用。某兴趣小组的同学为了探究氨气的某些性质,进行以下实验。下图中从左到右依次是实验步骤及相应的现象。
请根据上图中所示的信息,归纳出有关氨气的性质:
(1)物理性质
①_______________________________________
②_______________________________________。
(2)化学性质:
氨气与水反应后所得氨水显_________性
(09福州)17.(12分)同学们在学习碱的化学性质时,进行了如图8所示的实验。
图8
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】 废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称) 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有
如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是 。(写一种猜想)
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
实验内容
预计现象
预计结论
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。
①有白色沉淀,溶液呈红色。
的猜想正确。
② 。
的猜想正确。
③ 。
的猜想正确。
【反思拓展】 在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑
。
17.(12分)(1)NaOH+HCl===NaCl+H2O (3分)
(2)气球胀大 (1分)
(4)
【交流讨论】① NaCl ②氢氧化钠(合理答案均可) (每空1分)
【实验设计】 ①小林 (1分)
②有白色沉淀,溶液由红色变为无色 小云 (每空1分)
③ 没有白色沉淀,溶液呈红色 小红 (每空1分)
(合理答案均可)
【反思拓展】 反应物是否有剩余 (合理答案均可) (1分)
(09眉山)26、(8分)已知Cl2通入水中形成的溶液叫氯水。发生的反应为:
Cl2 + H2O = HCl + HclO(次氯酸)、 2HClO 2HCl + O2↑。
(1)HClO中氯元素的化合价为 。
(2)将氯水在阳光下照射一段时间后,溶液中的溶质是 (填化学式)。任写一个体现该溶液化学性质的方程式: 。
(3)往新制氯水中放入一小块红色布条,一段时间后观察,红布条褪色。请对此现象进行探究(只需提出假设、方案,不需要说出方案实施的具体结果)。
假设一:生成的HClO使红布条褪色
方案一:往新制备的HClO溶液中放入一小块红布条,一段时间后观察布条颜色变化。
假设二: 。
方案二: 。
假设三: 。
方案三: 。
26、(1)+1 (2)HCl Zn + 2HCl = ZnCl2 + H2↑等
(3)假设二:生成的HCl使红布条褪色 方案二:往盐酸溶液中放入一小块红色布条,一段时间后观察布条颜色变化 假设三:水使红布条褪色 方案三:往水中放入一小块红色布条,一段时间后观察布条颜色变化(其它答案合理也给分)
(09重庆)22.(6分)化学实验操作的先后顺序和试剂的用量常常影响实验的结果。
(1)按操作的先后顺序填空(填序号):
①给试管中的药品加热时,先 ,后 。
A.对准药品部位加热 B.均匀预热
②实验室制备气体时,先 ,后 。
A.检查装置的气密性 B.加入药品
(2)小菌认为NaOH溶液和H2SO4溶液混合时没有明显的现象,无法说明二者是否发生了反应。
①她设计下图实验证明二者之间确实发生了反应,所用的试剂有NaOH溶液H2SO4溶液,CuSO4溶液。请在箭头上方的括号中填入试剂名称,并用“少量”、“足量”等指明试剂的用量。
②如果把CuSO4溶液换成另一种试剂,只要各试剂的用量适当,则不管加入试剂的顺序如何,都能证明二者发生了反应,这种试剂是 。
22.(6分)(1)①B A(全对得1分) ②A B(全对得I分)
(2)①足量H2SO4溶液(2分)少量(或足量)CuSO4溶液(1分)
②酚酞试液(或石蕊试液)(I分)
(09肇庆)21.(8分)兴趣小组的同学在开展“废物利用、减少污染”的活动中,取某工厂合金废料(含铝、铁、铜)进行如下实验:
(1)操作Ⅰ的名称是 ;该操作需用到的铁制仪器为 。
(2)固体A的成分是 ;操作Ⅱ反应的化学方程式为 。
(3)黑色固体C加适量稀硫酸反应的方程式为 。
(4)图中由含铝的钠盐制备氯化铝有两种途径,你认为合理的途径是 (填:“Ⅰ”或“Ⅱ”),理由是 。
21.(8分)
(1)(2分)过滤(1 分) 铁架台(带铁圈)、或三角架(1 分)
(2)(3分)铁、铜(或Fe、Cu)(2分) Fe + H2SO4 = FeSO4 + H2↑(1 分)
(3)(1分)CuO + H2SO4 = CuSO4 +H2O
(4)(2分)Ⅱ(1 分) 途径Ⅱ没有引入新的杂质,得到的是纯净的氯化铝溶液(或途径Ⅰ引入的杂质钠盐,得到的氯化铝不是纯净。合理表述均给分。1 分)
(09黔东南)16.维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。学科网
【实验目的】测定不同饮料中维生素C的含量。学科网
【实验原理】学科网
(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;学科网
(2)淀粉遇到碘水变 色。学科网
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水学科网
【实验过程】学科网
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,学科网
③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。学科网
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数。学科网
【实验记录】学科网
测定物质
①
②
③
④
滴入碘水的数量(滴)
1
8
15
5
试回答下列问题:学科网
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高;学科网
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由: 学科网
;学科网
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。学科网
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同学科网
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水学科网
【回顾与反思】实验中所用的淀粉溶液的作用是 。16.【实验原理】(2)蓝
【实验记录】(1)橙汁(或③)
(2)不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度(其他合理答案也可)
(3)A B D
【回顾与反思】确定维生素C是否与碘水完全反应
(09宿迁18.(8分)化学电池是一类重要的能源,按工作性质可分为:一次电池(例如干电池)和二次电池(可充电电池,例如铅酸蓄电池)。请简要回答下列各空
(1)铅酸蓄电池放电时能量转变是 能转变成 能。
(2)宿迁经济开发区某铅酸电池厂生产电池用的是28%的稀硫酸,将浓硫酸稀释配制成该稀硫酸时,一定将 沿器壁缓慢注入 中,并不断搅拌以防液体飞溅。
(3)使用铅酸蓄电池的电动车与使用汽油燃料的轻便摩托车相比,电动车不会产生
等有害气体,但电池对土壤和水体的污染是不容忽视的。
(4)废旧干电池中许多物质是可以回收利用的。某种型号干电池的剖面如下图所示。
现对干电池内的填充物(MnO2、C、可溶性糊状物和水)进行探究,请填空:
① 取填充物溶于水,过滤、洗涤、干燥,得到黑色不溶物。再
经过__________处理,即可得到纯净的MnO2;
② 取①中过滤得到的滤液,分为两份,一份加入烧碱溶液,加热
产生一种刺激性气味的气体,该气体的水溶液pH>7,且常用作化
肥,则该气体的化学式为______;另一份加入AgNO3溶液,产生
白色沉淀,滴加稀HNO3沉淀不溶解,则可推知糊状物的化学式为________ 。
18、(每空1分,共8分)(1)化学能 电能 (2)浓硫酸 水
(3)CO (答案中含有CO即可) (4)①灼烧(或加热),②NH3;NH4Cl
(09徐州)42.(5分)A、B、C、D、E均为初中化学中不同类别的物质,它们的变化关系如图所示,其中红色物质A在一定条件下可以转化为单质B,“——”表示相连的两种物质能发生反应。则:
(1)D的化学式为_______。
(2)A转化为B的化学方程式_。
(3)C与E反应的化学方程式_______。
化学方程式2分,其余每空l分。
(1)CuSO4等 (2)Fe2O3+3CO高温2Fe+3CO2等 (3)NaOH+HCl=NaCl+H2O等
(09徐州)45.(8分)某化学课外兴趣小组通过查阅资料知道过氧化钠(Na2O2)能与水反应生成氢氧化钠和氧气,于是他们做了以下探究实验。
实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。
请你对脱脂棉燃烧的原因进行分析_______。
实验2:向盛有过氧化钠粉末的试管中加入水,充分反应后,取试管中的少量溶液放入另一小试管中加入几滴无色酚酞试液,溶液变红,过了一会,红色又褪去了。
【提出问题】溶液为什么先变红,过了一会,红色又褪去了呢?
【猜想】甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故。乙同学认为甲同学的猜想不正确,理由是_____________________。
【查阅资料】①滴加酚酞呈现红色的溶液遇到H2O2时,H2O2可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;②酚酞在稀碱性溶液中稳定显红色,而在浓氢氧化钠等溶液中显红色后又褪色。
【猜想】通过查阅资料后,该兴趣小组对溶液的红色褪去的主要原凶义进行了猜想。
猜想A:过氧化钠与水反应可能生成了H2O2;猜想B:生成的氢氧化钠溶液可能太浓。
【实验探究】请你将下列实验方案填写完整。
猜想
实验操作
实验现象
结论
A
取过氧化钠与水反应后的溶液放入试管中,_____
___________________________________________
_________________
猜想A
正确
B
取过氧化钠与水反应后的溶液放入试管中,
________________________________________
________________
猜想B
错误
【得出结论】根据实验分析,过氧化钠与水反应除了生成氢氧化钠和氧气外,还存在另一反应,则另一反应的化学方程式为____________________________________。
.(8分)化学方程式2分,其余每空l分。
实验l:反应中产生氧气和放出热量,使脱脂棉达到燃烧的条件
实验2:猜想:氢氧化钠溶液与二氧化碳反应后生成的碳酸钠溶液也显碱性,也能使酚酞试液变为红色
实验操作
实验现象
结论
加入适量的二氧化锰后,将
带火星的术条放在试管口
产生气泡,木条复燃
猜想A正确
先加入适量的水,然后再滴
加酚酞试液
溶液变红,一会红色又消失
猜想B错误
【得出结论】Na2O2+2H2O=2NaOH+H2O2
(09扬州)7.现有三种物质:①洁厕灵(含无机酸等)②生理盐水③烧碱溶液,pH大小关系为
A.①>②>③ B.③>②>① C.②<①<③ D.③<①<②
25.(4分)模拟酸雨形成的流程如下图所示。硫在单质气体A中燃烧发出蓝紫色火焰,生成刺激性气味的气体B;通常情况下C为无色液体,B、C、D是氧化物;E、F和X都是酸,G是白色沉淀。
试填空。
(1)E的化学式为: ▲ 。
(2)反应①的化学方程式为: ▲ 。
(3)反应④的化学方程式为: ▲ 。
(4)反应⑥的化学方程式为: ▲ 。
25.(4分,每空l分)
(1)H2SO3 (2)S+O2SO2
(3)SO3+H2O===H2SO4 (4)BaCl2+H2SO4===BaSO4↓+2HCl
(09乐山)34.(3分)如图所示,A、B、C、D、E、F均是初中化学常见物质。A与B发生的是复分解反应,B与C发生的是中和反应,F是人体正常生理活动必不可少的一种盐。
结合图中信息,回答有关问题:
(1)E的化学式为 ;
(2)A与B反应的化学方程式为 ;
(3)C与D反应的化学方程式为 ;
(09临沂)13、分别将盛有浓盐酸、浓硫酸、固体氢氧化钠、固体氯化钠的试剂瓶,敞口放置一段时间后,试剂质量减少的是 ,试剂质量增加而且变质的是 (填写试剂名称)。
(09娄底)24. 下图为初中化学几种常见物质及其转化关系,请根据图示回答:
(1)化合物甲中的元素有 40 种。
(2)金属单质B可能是 41 (填名称),化合物乙可能是 42 (填化学式)。
24题. 40. 2 41. 铜(铁或其他合理答案均记分)42. CO2 (H2O或其他合理答案均记分
(09娄底)29.小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
(1) 如右图所示,在白色点滴板上进行实验,请将实验现象填入下表:
氢氧化钠溶液
氢氧化钙溶液
加紫色石蕊溶液
56
57
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方 程式 58 。
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式
59 。
(4)如右图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液,溶液显 60 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 61 反应。
(5)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)
① 62
② 63
29题. 56. 溶液变蓝 57. 溶液变蓝58.CO2+Ca(OH)2 =CaCO3↓+H2O(2分)
59.SO3+2NaOH =Na2SO4+H2O(2分) 60 红 61 中和
62 都能使指示剂变色
63都能和某些非金属氧化物反应(或都能跟酸反应,其他合理答案均记分)
(09杭州)26. (4分)实验室有两瓶标签脱落的溶液,只知道是盐酸溶液和硫酸溶液。请选择下列试剂:
①氧化铁②氢氧化钠溶液③碳酸钠溶液④氢氧化钡溶液⑤氯化钡溶液,用两种方法,每次只用一种试剂把它们鉴别出来。请填写下表:
选择的试剂编号
有明显反应现象的化学方程式
方法一
方法二
(09湖州32 .绝大多数古代青铜器和铜器上都有绿色斑点,这些绿色斑点是铜长时间和氧气等物质发生化学反应生成的铜绿【 Cu2 ( OH )2 CO3 ] ,铜绿不稳定,受热后可分解生成三种物质。
为探究铜绿受热后生成的物质,小莉同学从某种铜器上取下适量的铜绿,进行实验。
① 连接装置如图,并检查装置的气密性。
② 将干燥后的铜绿放入试管A 中加热。
( l )试管口为什么要略向下倾斜?
( 2 ) A 装置中绿色固体逐渐变成黑色。取少量黑色固体放人另一试管中,加入稀硫酸,观察到黑色固体逐渐溶解,变成蓝色溶液。则可推测铜绿分解产物中有
( 3 ) B装置中澄清石灰水变浑浊,则可推测铜绿分解产物中
( 4 ) C 装置中无水硫酸铜变蓝色,小莉同学认为铜绿分解产物中有水,但小明同学认为这还不能作出确切的推断。若要推断铜绿产物中是否有水,应如何改进实验装置?
(09嘉兴)9.右图是某同学测量几种食品的pH后绘制的图象,其中偏碱性的是
A.腌萝卜 B.南瓜
C.莴苣 D.甜玉米
(09嘉兴)31.在制取氢气实验时,同学们发现老师在准备用于反应的锌粒中滴人了少量的硫酸铜溶液。他们想:锌会与硫酸铜溶液反应生成铜,难道铜会影响锌和稀硫酸反应的快慢吗?他们决定对此开展有关实验:
(1)在设置对照组的时候,除了要控制好锌粒和稀硫酸的量之外,其中一组中要添加 ▲ 。
(2)实验中要比较锌和稀硫酸反应快慢,可以观察记录 ▲ 。
(09烟台)31.(6分)小青在实验室发现一瓶长期敞口放置的浓盐酸,为方便以后使用,他对其浓度进行了测定。取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下:
加入氢氧化钠的体积/mL
0
1.0
8.0
9.5
10.5
12.0
16.5
烧杯中溶液的pH
1.0
1.3
2.0
3.9
9.9
11.9
12.8
(1)请你绘制出烧杯中溶液的pH与加人氢氧化钠溶液体积(V)之间的变化关系图。
(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数。(氢氧化钠溶液的密度按1.0g/mL计算)
(1)(2分)评分要点:描点正确,曲线平滑。
(2)解:由上图可知,恰好完全反应时消耗氢氧化钠溶液的体积约为10.0mL(9.7mL~10.3mL之间取值均可)……………………………………………………………………(1分)
答:此瓶盐酸的溶质质量分数是3.65%。
(09苏州)28.(6分)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题。
【实验1】用酚酞试液
(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为 ▲
色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为 ▲ (结果精确到0.1%)。反应后溶液中的溶质可用 ▲ 的方法(填一操作名称)使其析出。用酚酞作指示剂可逐滴控制酸、碱溶液反应的量,视觉效果灵敏,操作简便。
【实验2】用pH试纸
(2)向一支试管内倒入约2mL氢氧化钠溶液,再逐滴滴入盐酸,边滴边振荡。然后用玻璃棒蘸取反应液沾到pH试纸上,与标准比色卡对照。因无法通过肉眼观察到反应进程,需间隔数滴多次检测溶液的pH,所以每使用玻璃棒蘸取溶液前,必须进行 ▲ 的预处理。
【小 结】
(3)除了用酸碱指示剂、pH试纸外,还可用 ▲ (填力法)检测中和反应是否发生。
28.(6分)
(1)无(1分)2.9%(2分)蒸发结晶(或蒸发)(1分)
(2)洗净并擦干(全写得1分,不全不给分)
(3)测温度变化(或用pH计测试或测反应前后溶液导电性)(1分)
(09达州)13.(7分)请根据下列已知条件设问,使其成为一道完整的计算题,然后解答。
一定质量的氯化钡(BaCl2)固体和100g溶质质量为9.8%的稀硫酸恰好完全反应。
13.(7分)此题为开放性题,答案比较多。
例如:生成沉淀的质量是多少克?或所取氯化钡固体的质量是多少克?等合理的补充。答案略。
(09达州)A
B
C
D
高温
H2O
14.(6分)有A、B、C、D四种物质,如图所示,A、B、C在一定下可以发生转
化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A。D与A、B、C均能
发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶
液反应,可产生不溶于稀硝酸的白色沉淀。
⑴请根据已知条件推断四种物质的化学式:
A B C D
⑵请写出下列反应的化学方程式:
C溶液中通入CO2,溶液变浑浊
D与A反应
14.(6分) ⑴A:CaCO3 B:CaO C:Ca(OH)2 D:HCl
⑵Ca(OH)2+CO2 = CaCO3↓+H2O CaCO3+2HCl = CaCl2+H2O+CO2↑