- 1.05 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考化学试题涉及反应先后顺序及相应图像分析
潮州市饶平县上饶中学 张世壁
纵观广东省近几年压轴题计算题,涉及到一种物质和某混合物中的两种物质都能发生化学反应,而且往往存在反应的先后顺序问题及图像分析,很多学生都感到非常棘手,解题思路混乱。下面归类分析初中化学反应的先后顺序及相关习题解法。
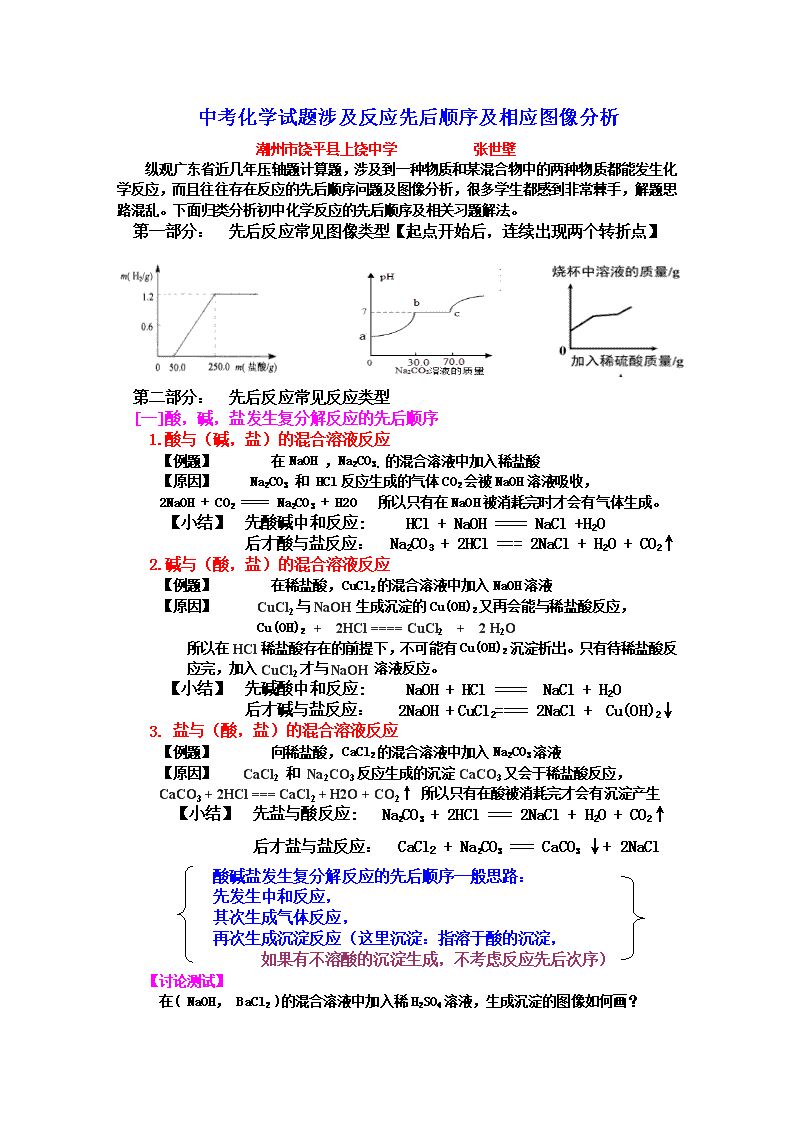
第一部分: 先后反应常见图像类型【起点开始后,连续出现两个转折点】
第二部分: 先后反应常见反应类型
[一]酸,碱,盐发生复分解反应的先后顺序
1.酸与(碱,盐)的混合溶液反应
【例题】 在NaOH ,Na2CO3,的混合溶液中加入稀盐酸
【原因】 Na2CO3 和 HCl反应生成的气体CO2会被NaOH溶液吸收,
2NaOH + CO2 ==== Na2CO3 + H2O 所以只有在NaOH被消耗完时才会有气体生成。
【小结】 先酸碱中和反应: HCl + NaOH ==== NaCl +H2O
后才酸与盐反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
2.碱与(酸,盐)的混合溶液反应
【例题】 在稀盐酸,CuCl2的混合溶液中加入NaOH溶液
【原因】 CuCl2与NaOH生成沉淀的Cu(OH)2又再会能与稀盐酸反应,
Cu(OH)2 + 2HCl ==== CuCl2 + 2 H2O
所以在HCl稀盐酸存在的前提下,不可能有Cu(0H)2沉淀析出。只有待稀盐酸反应完,加入CuCl2才与NaOH溶液反应。
【小结】 先碱酸中和反应: NaOH + HCl ==== NaCl + H2O
后才碱与盐反应: 2NaOH + CuCl2==== 2NaCl + Cu(OH)2↓
3. 盐与(酸,盐)的混合溶液反应
【例题】 向稀盐酸,CaCl2的混合溶液中加入Na2CO3溶液
【原因】 CaCl2 和 Na2CO3反应生成的沉淀CaCO3又会于稀盐酸反应,
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 所以只有在酸被消耗完才会有沉淀产生
【小结】 先盐与酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
后才盐与盐反应: CaCl2 + Na2CO3 === CaCO3 ↓+ 2NaCl
酸碱盐发生复分解反应的先后顺序一般思路:
先发生中和反应,
其次生成气体反应,
再次生成沉淀反应(这里沉淀:指溶于酸的沉淀,
如果有不溶酸的沉淀生成,不考虑反应先后次序)
【讨论测试】
在( NaOH, BaCl2 )的混合溶液中加入稀H2SO4溶液,生成沉淀的图像如何画?
[二]酸,金属单质,金属氧化物反应的先后顺序
【例题】 表面生锈的铁钉投入到足量的稀盐酸中。
【原因】 铁锈在表面,先与稀硫酸接触,后过量的酸才与内部的铁继续反应
【小结】 酸先与金属氧化物反应: Fe2O3 + 6HCl === 2FeCl3 + 3H2O
酸后与金属单质反应: Fe + 2HCl === FeCl2 + H2↑
[三](强,弱)酸性气体与碱溶液反应的先后顺序
【例题】 把CO2和HCl的混合气体通入澄清石灰水中
【原因】 Ca(OH)2 和 CO2反应生成的沉淀(CaCO3)溶于稀盐酸,
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 所以只有在盐酸被消耗完才会有沉淀产生
【小结】 碱先与强酸性气体反应: 2HCl + Ca(OH)2 ==== CaCl2 + 2 H2O
碱后与弱酸性气体反应: Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
[四]活泼金属单质与金属盐溶液发生置换反应的先后顺序
1.几种活泼金属与一种金属盐溶液的反应先后
【例题】 把锌片和铜片同时放入盛有硝酸银溶液的试管里
【原因】 金属活动性由强到弱的顺序Zn>Cu>Ag, 锌片最活泼,锌片先和硝酸银生成硝酸锌和银, 只有锌片完全反应完, 铜片才与剩余的硝酸银反应生成
硝酸铜和银
【小结】 最活泼的金属优先于盐反应: Zn + 2AgNO3 ===Zn (NO3)2+ 2 Ag
次活泼的金属较后于盐反应 Cu + 2AgNO3 === Cu (NO3)2+ 2 Ag
2.一种活泼金属与几种金属盐溶液的反应先后
【例题】 向AgNO3 Cu (NO3)2的混合溶液中加入Zn片
【原因】 金属活动性由强到弱的顺序Zn>Cu>Ag, 银最不活泼,锌先和硝酸银AgNO3生成硝酸锌和银,只有当AgNO3完全反应完,锌才与Cu (NO3)2反应。
【小结】 最不活泼的金属盐溶液先于金属单质反应:
Zn + 2AgNO3 ===Zn (NO3)2+ 2 Ag
次活泼的金属盐溶液后于金属单质反应:
Zn + 2Cu(NO3)2 === Zn(NO3)2 + 2 Cu
金属单质与金属盐溶液发生置换反应的先后顺序一般思路:
金属单质与盐溶液中的金属,活动性差距越大的先反应,
即金属活动性表位置“先远后近”的原则进行反应
【讨论测试】
1.在Cu(NO3)2、 AgNO3 的混合溶液中加入锌粉,溶液质量与加入锌粉的质量关系如图所示,下列说法正确的是( B )
A. a点溶液中的溶质有2种
· B. c点溶液中溶质为Zn(NO3)2
· C. 若取b~c段溶液,滴加稀盐酸,有白色沉淀
D. 取d点的固体,加入稀盐酸,无气泡产生
2.实验室用盐酸与石灰石制取二氧化碳,若装置气密性良好,石灰水也未变质,生成气体通入石灰水时未变浑浊,可能的原因是【使用的盐酸浓度过浓,生成的CO2带有HCl气体。】
第三部分: 先后反应常见中考试题类型
1. 某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。
(1)锌和硝酸银溶液反应的化学方程式是 【Zn + 2AgNO3=== Zn (NO3)2 +2Ag 】。
(2)同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:①溶质为 【 硝酸锌和硝酸铜】②溶质为【硝酸锌,硝酸铜和硝酸银】 。
(3)请你设计两种不同实验方案来验证以上猜想。
实验操作
实验现象
结论
方案一:取少量滤液于试管中,在滤液中插入一根铜丝
如果铜丝表面无变化
证明猜想①成立
方案二:取少量滤液于试管中,滴加几滴稀盐酸
如果滤液无明显变化
证明猜想①成立
2. 某澄清溶液由HN03、K2C03、H2SO4、CuCl2中的两
种混合而成,向该混合液中加Ba(0H)2溶液,产生沉淀
量与加的Ba(OH)2溶液的体积关系如图:
(1)该混合溶液是由 HN03 和 CuCl2 组成。
(2)不含另两种物质的理由:
一是 在溶液中,K2C03与HN03、H2S04、CuCl2均能反应,
所以,该混合液中肯定没有K2C03; 。 ;
二是 往混合液中加入Ba(OH)2溶液超过20mL时,才有沉淀产生,
说明该混合液中不含硫酸
3.【广东2011】某兴趣小组从废铝锅底部剪一块铝片,将它放入21.9%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如右下图(假设酸与氧化膜反应时没有H2产生,其它杂质不与酸反应)。请回答: (1)从图中看出,该反应产生了H2 g。
(2)产生氢气的化学方程式为: ;
铝片中铝单质的质量为 g。
(3)求废铝片Al2O3的质量,写出计算过程。
4.【广东2014】同学们做甲、乙两个中和反应实验的探究(见下图)。
题25-1图 题25-2图
(1)甲实验恰好中和,则该溶液中的溶质是 (填化学式)。
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%Na2C03溶液(见丙图),溶液pH的变化如题25-2图所示。则与CaCl2反应的碳酸钠溶液的质量为
g
请计算该 溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
(3)根据计算所得数据在题25-3图中画出产生沉淀的曲线。
(4)乙组的中和反应实验设计存在的是 。
5.(2015•广东)现有10%的Na2CO3溶液,请按照下面要求计算:
(1)106g上述溶液中所含溶质的质量为 g.
(2)106g上述溶液与足量10%的盐酸反应,最多可生成CO2多少克?
(3)向106g上述溶液中逐滴加入10%的盐酸并不断搅拌,此时先发生的反应为:Na2CO3+HCl=NaHCO3+NaCl;
当Na2CO3全部转化为NaHCO3后,再加入盐酸才开始放出CO2. NaHCO3+HCl= NaCl+ CO2↑+ H2O
请在图中画出产生气体的曲线.
(4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如表格:
物质
Na2CO3
HCl
x
NaCl
CO2
H2O
质量/g
31.8
14.6
16.8
23.4
4.4
m
则m= ,该反应的化学方程式为 .
6 工业生产制得的Na2CO3中常含有少量的NaOH。为测定其纯度,某同学取14g样品加水配成100g溶液,慢慢滴入某浓度的稀盐酸,反应所得溶液质量与滴加盐酸的质量关系
如图1所示。
(1)加入盐酸25g时发生反应的化学方程式 ;
(2)反应过程中共生成CO2的质量是 g;
(3)列式计算样品中Na2CO3的质量分数(结果保留0.1%);
(4)在图2中画出生成CO2质量与稀盐酸的质量关系。
7.向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )