- 216.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一部分 第九单元
命题1 溶液的组成
1.(2018·云南8题2分)下列选项属于溶液的是( B )
A.泥水 B.白糖水
C.玉米粥 D.蒸馏水
2.(2018·昆明8题2分)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( B )
A.沙子 B.食盐
C.面粉 D.橄榄油
3.(2017·昆明9题2分)把少量下列物质加入足量水中,充分搅拌,不能得到溶液的是( B )
A.氯化钠 B.花生油
C.葡萄糖 D.硝酸铵
4.(2016·云南10题2分)下列溶液中,溶剂不是水的是( C )
A.蔗糖溶液 B.生理盐水
C.碘的酒精溶液 D.稀盐酸
命题2 物质溶解时的吸、放热现象
5.(2014·云南20题2分)如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀。如表中液体X和固体Y的组合,符合题意的是( B )
①
②
③
④
X
双氧水
水
水
水
Y
二氧化锰
氯化钠
氢氧化钠
硝酸铵
A.①② B.①③
C.①③④ D.②③④
命题3 乳化作用
6.[2015·云南23(1)③题1分](1)化学与生活密切相关,化学就在我们身边。
③洗涤剂能够清除餐具上的油污,这是因为洗涤剂具有乳化作用。
命题4 溶解度及溶解度曲线
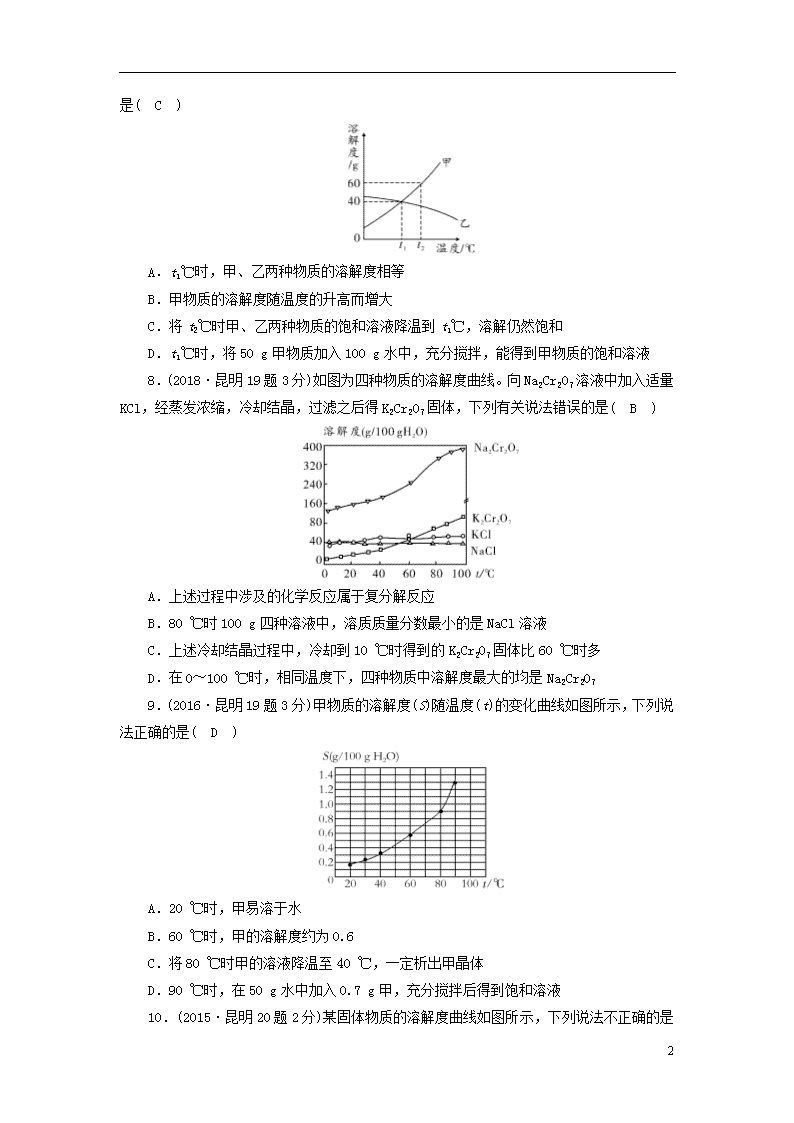
7.(2018·云南17题3分)如图是甲、乙两种物质的溶解度曲线, 下列说法不正确
8
的是( C )
A.t1℃时,甲、乙两种物质的溶解度相等
B.甲物质的溶解度随温度的升高而增大
C.将t2℃时甲、乙两种物质的饱和溶液降温到t1℃,溶解仍然饱和
D.t1℃时,将50 g甲物质加入100 g水中,充分搅拌,能得到甲物质的饱和溶液
8.(2018·昆明19题3分)如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KCl,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( B )
A.上述过程中涉及的化学反应属于复分解反应
B.80 ℃时100 g四种溶液中,溶质质量分数最小的是NaCl溶液
C.上述冷却结晶过程中,冷却到10 ℃时得到的K2Cr2O7固体比60 ℃时多
D.在0~100 ℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
9.(2016·昆明19题3分)甲物质的溶解度(S)随温度(t)的变化曲线如图所示,下列说法正确的是( D )
A.20 ℃时,甲易溶于水
B.60 ℃时,甲的溶解度约为0.6
C.将80 ℃时甲的溶液降温至40 ℃,一定析出甲晶体
D.90 ℃时,在50 g水中加入0.7 g甲,充分搅拌后得到饱和溶液
8
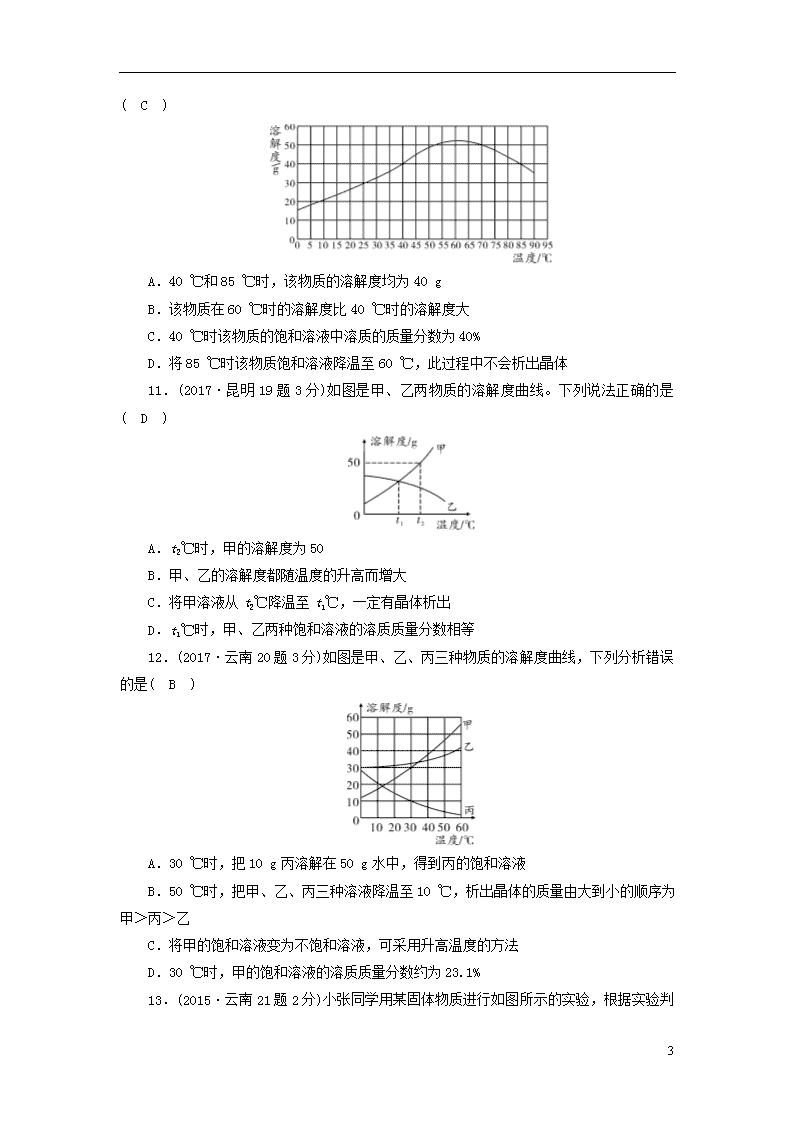
10.(2015·昆明20题2分)某固体物质的溶解度曲线如图所示,下列说法不正确的是( C )
A.40 ℃和85 ℃时,该物质的溶解度均为40 g
B.该物质在60 ℃时的溶解度比40 ℃时的溶解度大
C.40 ℃时该物质的饱和溶液中溶质的质量分数为40%
D.将85 ℃时该物质饱和溶液降温至60 ℃,此过程中不会析出晶体
11.(2017·昆明19题3分)如图是甲、乙两物质的溶解度曲线。下列说法正确的是( D )
A.t2℃时,甲的溶解度为50
B.甲、乙的溶解度都随温度的升高而增大
C.将甲溶液从t2℃降温至t1℃,一定有晶体析出
D.t1℃时,甲、乙两种饱和溶液的溶质质量分数相等
12.(2017·云南20题3分)如图是甲、乙、丙三种物质的溶解度曲线,下列分析错误的是( B )
A.30 ℃时,把10 g丙溶解在50 g水中,得到丙的饱和溶液
B.50 ℃时,把甲、乙、丙三种溶液降温至10 ℃,析出晶体的质量由大到小的顺序为甲>丙>乙
C.将甲的饱和溶液变为不饱和溶液,可采用升高温度的方法
D.30 ℃时,甲的饱和溶液的溶质质量分数约为23.1%
8
13.(2015·云南21题2分)小张同学用某固体物质进行如图所示的实验,根据实验判断下列说法不正确的是( C )
A.该固体物质的溶解度随温度的升高而增大
B.溶液b一定是不饱和溶液
C.溶液d中的溶质质量可能大于溶液e中的溶质质量
D.溶液d和溶液e的溶质质量分数可能相同
14.[2017·曲靖24(3)题4分](3)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题。
①t3℃时,三种物质的溶解度由大到小的顺序是甲>丙>乙。
②交点m表示的含义是t2℃时,甲和丙的溶解度相等。
③若甲物质中混有少量丙物质,要得到较纯净的甲物质,可采用的方法是降温结晶。
④将t3℃时甲、乙、丙三种物质的饱和溶液降温至t1℃时,所得溶液溶质质量分数的大小关系是丙>甲=乙。
15.[2018·曲靖23(3)题4分](3)如图是不含结晶水的甲、乙、丙三种固体物质的溶解度曲线,看图并回答下列问题。
①M点表示的含义是t2℃时,甲、丙两种物质的溶解度相等。
②t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是丙>乙>甲。
③t3℃时,将35 g甲物质加入到50 g水中,充分溶解后所得溶液的质量是80g。
④t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质质量分别由大到小的顺序是乙>丙>甲
命题5 溶质质量分数的计算
16.(2018·云南28题6分)请回答并完成下列计算。
8
(1)实验室要配制50 g溶质质量分数为8%的氢氧化钠溶液,需称取4g氢氧化钠固体。
(2)向上述配制好的溶液中加入50 g稀硫酸,恰好完全反应,求反应后所得溶液中溶质的质量分数。
(反应的化学方程式:2NaOH+H2SO4=== Na2SO4+2H2O)
解:设反应生成硫酸钠的质量为x。
2NaOH+H2SO4=== Na2SO4+2H2O
80 142
4 g x
= x=7.1 g
反应后溶液中硫酸钠的质量分数为×100%=7.1%。
答:反应后溶液中硫酸钠的质量分数为7.1%。
17.(2018·昆明28题6分)已知:Si+2NaOH+H2O=== Na2SiO3+2H2↑,向100 g NaOH溶液中加入足量Si,充分反应后生成0.4 g H2。求:
(1)参加反应的Si的质量。
(2)该NaOH溶液中溶质的质量分数。
解:设参加反应的Si的质量为x,100 g NaOH溶液中溶质的质量为y。
Si+2NaOH+H2O=== Na2SiO3+2H2↑
28 80 4
x y 0.4g
= x=2.8 g
= y=8 g
NaOH溶液中溶质的质量分数为×100%=8%。
答:(1)参加反应的Si的质量为2.8 g。
(2)该NaOH溶液中溶质的质量分数为8%。
18.(2018·曲靖28题6分)现有18.8 g氯化钠和碳酸氢钠的固体混合物,将其放入烧杯中,再加入127 g稀盐酸,恰好完全反应,反应后所得溶液的质量为137 g。
(温馨提示:化学反应方程式为NaHCO3+HCl=== NaCl+H2O+CO2↑)
(1)反应中生成气体的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
解:设混合物中碳酸氢钠的质量为x,反应生成的氯化钠的质量为y。
由题意可知,生成的二氧化碳气体质量为18.8 g+127 g-137 g=8.8 g。
8
NaHCO3+HCl=== NaCl+H2O+CO2↑
84 58.5 44
x y 8.8 g
= x=16.8 g
= y=11.7 g
原混合物中氯化钠的质量为18.8 g-16.8 g=2 g,
反应后所得溶液中溶质的质量分数为×100%=10%。
答:(1)生成的二氧化碳气体质量为8.8 g。
(2)反应后所得溶液中溶质的质量分数为10%。
19.(2016·云南28题6分)为测定某硫酸溶液中溶质的质量分数,化学小组同学取10 g该硫酸溶液,向其中加入21.2 g BaCl2溶液,二者恰好完全反应,过滤后称得滤液的质量为28.87 g。请计算:
(1)反应后生成沉淀的质量是2.33g。
(2)该硫酸溶液中溶质的质量分数。(计算结果精确到0.1%)
解:设该硫酸溶液中溶质的质量为x。
H2SO4+BaCl2===BaSO4↓+2HCl
98 233
x 2.33 g
= x=0.98 g
硫酸溶液中溶质的质量分数为 ×100%=9.8%。
答:该硫酸溶液中溶质的质量分数为9.8%。
20.(2017·曲靖28题6分)现有一瓶贴有如下标签的氯化钠溶液,为检测该溶液的实际浓度与所贴标签上的浓度是否相符,取该氯化钠溶液10 g,向其中加入10 g溶质质量分数为3.4%的硝酸银溶液,恰好完全反应,请计算并回答问题。
(温馨提示:化学反应方程式为NaCl+AgNO3=== AgCl↓+NaNO3,该题中的“浓度”指溶质质量分数。)
名称 氯化钠溶液
浓度 0.9%
8
(2)计算恰好完全反应时所得溶液中溶质的质量分数。(计算结果保留到0.1%)
解:设恰好完全反应时生成氯化银的质量为x,生成硝酸钠的质量为y。
NaCl+AgNO3 === AgCl↓+NaNO3
170 143.5 85
10 g×3.4% x y
= x=0.287 g
= y=0.17 g
恰好完全反应时溶液中溶质的质量分数为
×100%=0.9%。
答:恰好完全反应时溶液中溶质的质量分数为0.9%。
命题6 一定溶质质量分数溶液的配制
21.(2016·昆明5题2分)实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( C )
A.烧杯 B.量筒
C.集气瓶 D.托盘天平
22.(2015·云南6题2分)如图是配制100 g溶质质量分数为5%的氯化钠溶液的操作过程。以下说法错误的是( C )
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠
C.配制该溶液需要称取5 g氯化钠,量取100 mL水
D.操作①中玻璃棒的作用是搅拌,加速溶解
23.[2015·昆明24(3)题4分](3)配制50 g质量分数为6%的氯化钠溶液,实验步骤是:
①计算:氯化钠3g,水47g;②称量;③量取;④溶解:该步骤中玻璃棒的作用是搅拌,加速溶解。
24.(2015·曲靖27题4分)实验室欲配制100 g溶质质量分数为6%的氯化钠溶液。请回答:
(1)配制该溶液时,需称取氯化钠6g;用量筒量取所需水时,若俯视读数,所得溶液中溶质的质量分数>6%(填“>”“<”或“=”)。
8
(2)溶解氯化钠固体时用玻璃棒搅拌的目的是加快溶解速度。
(3)将配制好的溶液转移到细口瓶中时,不慎洒落少许,所得溶液中溶质的质量分数不变(填“变大”“不变”或“变小”)。
8