- 107.25 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2008年上海市初中毕业生统一学业考试
理化试卷
(满分150分,考试时间100分钟)
化 学 部 分
考生注意:化学部分第十大题分为两组,A组适合学习一期教材的考生,B组适合学习二期试用教材的考生。
相对原子质量:H-1 C-12 O-16 F-19 Na–23 S-32 Ca-40
六、填表题(共10分)
27.在下表中填写相应的物质名称、化学式、物质类别(指单质、氧化物、酸、碱、盐)。
物质名称
碳酸
硝酸银
化 学 式
Zn
SO3
物质类别
碱(任写一种)
七、单项选择题(共10分)
28.生活中的以下物质属于溶液的是……………………………………………………( )
A.蒸馏水 B.食盐水 C.牛奶 D.石灰乳
29.常温下某同学测得一些食物的近似PH,显碱性的是………………………………( )
A.桃子汁:3.5 B.苹果汁:3.2 C.鸡蛋清:7.8 D.牛奶:6.5
30.矾(V)被誉为金属中的“维生素”,其氧化物V2O5中矾元素的化合价是…………( )
A.+1 B.+3 C.+5 D.+7
31.物质在变化中表现出来的性质,属于物理性质的是…………………………………( )
A.木炭的稳定性 B.一氧化碳的还原性 C.酒精的可燃性 D.浓盐酸的挥发性
32.SO2是形成酸雨的主要物质,能有效吸收SO2的溶液是………………………………( )
A.NaOH B.Na2SO4 C.H2SO4 D.NaCl
33.人类的生产和生活都离不开O2。有关O2的正确认识是………………………………( )
A.木炭在空气中燃烧比在O2中燃烧更旺
B.工业上可以通过分离液态空气制取O2
C.O2易溶于水,不能用排水法收集
D.实验室中可用加热分解水来制取O2
34.根据实验规范,图示的操作中正确的是………………………………………………( )
C.加热液体
A.取用少量液体
B.过滤
D.加入块状固体
35.为确保生命安全,处理事故的正确方法是……………………………………………( )
A.进入深洞,燃着的火把熄灭后继续前进
B.厨房内管道煤气(主要成分为CO)泄漏,马上点火燃尽
C.桌面上酒精灯内酒精洒出,着火燃烧,立即用湿抹布扑灭
D.炒菜时油锅着火,立刻浇水灭火
36.分子和原子都是构成物质的微粒,关于分子和原子的正确认识是…………………( )
A.分子是运动的,原子是静止的 B.化学变化中分子和原子种类都发生变化
C.分子可分为原子,原子不可再分 D.物理变化中分子和原子种类都不改变
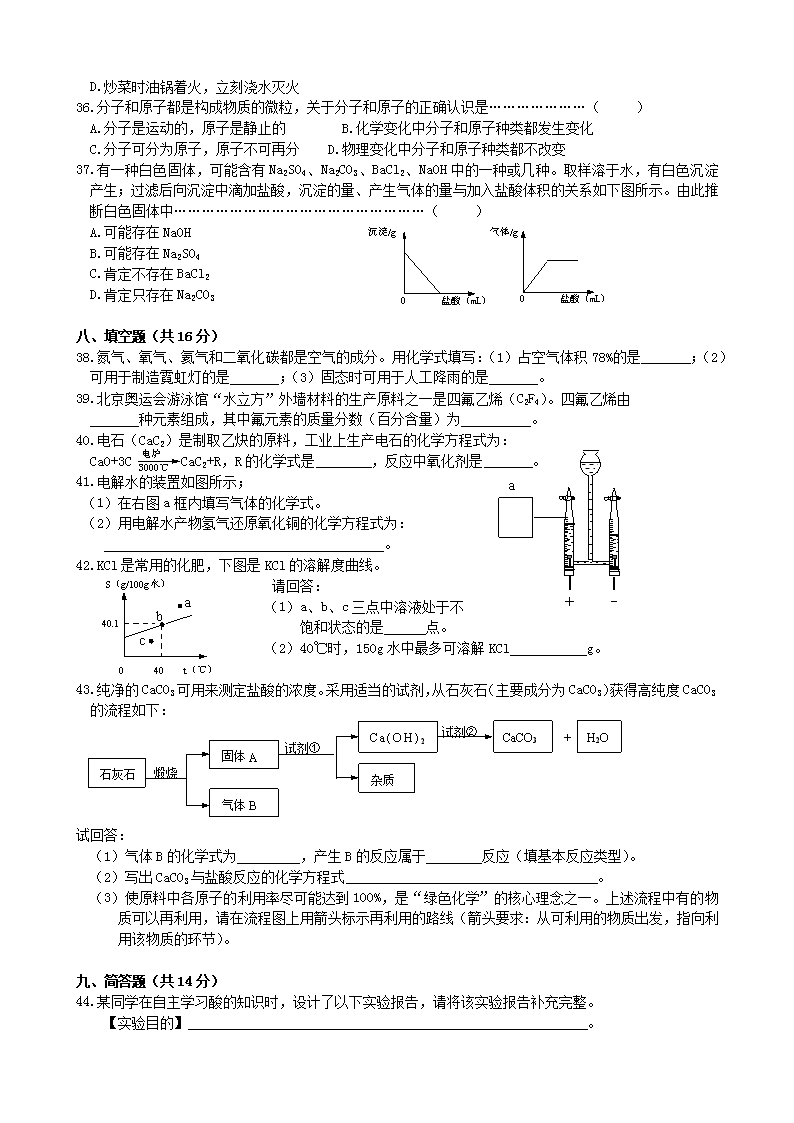
37.有一种白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如下图所示。由此推断白色固体中………………………………………………( )
0 盐酸(mL)
沉淀/g
气体/g
0 盐酸(mL)
A.可能存在NaOH
B.可能存在Na2SO4
C.肯定不存在BaCl2
D.肯定只存在Na2CO3
八、填空题(共16分)
38.氮气、氧气、氦气和二氧化碳都是空气的成分。用化学式填写:(1)占空气体积78%的是 ;(2)可用于制造霓虹灯的是 ;(3)固态时可用于人工降雨的是 。
39.北京奥运会游泳馆“水立方”外墙材料的生产原料之一是四氟乙烯(C2F4)。四氟乙烯由
种元素组成,其中氟元素的质量分数(百分含量)为 。
3000℃
电炉
40.电石(CaC2)是制取乙炔的原料,工业上生产电石的化学方程式为:
+
a
-
CaO+3C CaC2+R,R的化学式是 ,反应中氧化剂是 。
41.电解水的装置如图所示;
(1)在右图a框内填写气体的化学式。
(2)用电解水产物氢气还原氧化铜的化学方程式为:
。
0 40 t(℃)
c
S(g/100g水)
a
b
42.KCl是常用的化肥,下图是KCl的溶解度曲线。
请回答:
(1)a、b、c三点中溶液处于不
饱和状态的是 点。
(2)40℃时,150g水中最多可溶解KCl g。
43.纯净的CaCO3可用来测定盐酸的浓度。采用适当的试剂,从石灰石(主要成分为CaCO3)获得高纯度CaCO3的流程如下:
固体A
气体B
石灰石
煅烧
Ca(OH)2
+
杂质
试剂①
试剂②
CaCO3
H2O
试回答:
(1)气体B的化学式为 ,产生B的反应属于 反应(填基本反应类型)。
(2)写出CaCO3与盐酸反应的化学方程式 。
(3)使原料中各原子的利用率尽可能达到100%,是“绿色化学”的核心理念之一。上述流程中有的物质可以再利用,请在流程图上用箭头标示再利用的路线(箭头要求:从可利用的物质出发,指向利用该物质的环节)。
九、简答题(共14分)
44.某同学在自主学习酸的知识时,设计了以下实验报告,请将该实验报告补充完整。
【实验目的】 。
【实验用品】试管、铁片、铜片、稀盐酸、稀H2SO4、NaOH溶液、石蕊和酚酞试液等
【实验内容】
实验步骤
稀硫酸
盐酸
石蕊试液
1.
铁片
铜片
稀硫酸
铁片
铜片
盐酸
2.
含酚酞试液的NaOH
稀硫酸
盐酸
3.
实验现象
溶液变为 色
稀酸中的Fe片表面都有 产生。
Cu片表面都没有明显现象
溶液由红色变为无色
分析与
结论
结论:
稀酸能与指示剂作用
铁与稀硫酸反应的化学方程式为
。
结论:稀酸能与较活泼金属反应
结论:
酸能
【实验思考】从物质组成角度解释酸具有通性的原因 。
45.某科技小组的同学利用天然资源获得了红褐色的铜粉(含杂质炭),为了测定该铜粉样品中铜的质量分数(百分含量),取Wg铜粉样品,设计如下实验装置:
⑤
④
(MnO2)
KClO3
①
②
Cu(C)
③
NaOH
溶液
澄清
石灰水
(1)仪器②、⑤的名称是 、 。
(2)①、④中发生反应的化学方程式为:
① ,④ 。
(3)装置③中的实验现象是 。
(4)结束实验时,先熄灭两个酒精灯,在冷却过程中可能导致的后果是
。
(5)利用上述装置,通过称量反应前后装置④的质量,得到CO2的质量,进而求出铜的质量分数(实验过程中忽略水蒸气的影响)。为了确保测得的CO2质量准确可靠,在保证装置不漏气、称量准确、操作规范的前提下,你认为还需要的条件是:
。
十、
46.燃烧产物对环境影响最小的物质是…………………………………………………( )
A.液化气 B.煤气 C.氢气 D.天然气
47.金属镁能在CO2中燃烧,发生反应的化学方程式为 。1mol金属镁中约含 个镁原子。
48.为了探究影响硝酸钾固体在水中溶解质量多少的因素,某研究小组开展了以下的探究活动,请你根据实验数据归纳出结论。
实验一: 实验二:
KNO3在20℃水中达饱和时溶解的质量 KNO3在20g水中达饱和时溶解的质量
水的质量(g)
10
50
100
KNO3的质量(g)
3.2
15.8
31.6
温度(℃)
20
40
60
KNO3的质量(g)
6.3
12.8
22.0
结论:当 相同时,水的质 结论:当水的质量相同时,
量越多,溶解KNO3的质量越多 。
讨论:如果是气体物质,除上述因素外,影响其在水中溶解质量多少的因素还有:
(写一种)。
49.某工厂每天产生浓度为0.49%的废H2SO4溶液1×106g,需要用碱溶液中和处理。
试计算:
(1)该厂每天要处理的废酸液中含H2SO4 g,是 mol H2SO4。
(2)若用烧碱处理废酸液,每天需要NaOH mol。
(3)若改用熟石灰处理废酸液,每天需要Ca(OH)2的物质的量 NaOH物质的量(填“大于”、“小于”或“等于”)。
2008年上海市初中毕业生统一学业考试
理化试卷答案及评分标准
化 学 部 分
说明:
1.本试卷答案每格1分(标明的除外)。
2.物质名称、仪器名称和概念名称有错(包括错别字)不得分。
3.化学方程式中化学式有错不得分;配平、反应条件、气体或沉淀符号等有错误,整卷共扣1分。
六、填表题(10分)
27.
锌
氢氧化铜
三氧化硫
Cu(OH)2
H2CO3
AgNO3
单质
酸
氧化物
盐
*碱一列的名称和化学式对应且无错别字可得2分,如不对应则得1分。
七、单项选择题(10分)
题号
28
29
30
31
32
33
34
35
36
37
答案
B
C
C
D
A
B
A
C
D
A
八、填空题(16分)
38. N2 He CO2
39. 2 0.76(或76%)
40. CO 氧化钙(或CaO)
41. O2 CuO + H2Cu + H2O
42.(1)C (2)60.15
43.(1)CO2 分解 (2)CaCO3 +2HCl → CaCl2 + CO2↑ + H2O
(3)(本小题2分,答出1点得1分)
固体A
试剂①
H2O
气体B
试剂②
九、简答题(14分)
44.研究(或学习、探究、认识)酸的化学性质(写酸的性质、通性也得分)
红色
气泡
Fe +H2SO4 → FeSO4 +H2↑
与碱发生中和反应
酸的组成中都含有氢元素(或酸中都含有氢原子,或酸溶液中都含有氢离子,或酸电离产生的阳离子全部是氢离子)
45.(1)酒精灯 烧杯
△
MnO2
(2)2KClO3 2KCl +3O2↑ 2NaOH + CO2 → Na2CO3 +H2O
(3)红褐色变成黑色
(4)溶液倒吸或硬质玻璃管破裂
(5)O2的量要充足,保证杂质炭全部转化为CO2;⑤中澄清石灰水不变浑浊,保证CO2被NaOH完全吸收(本空2分,答出1点得1分)
十、(10分)
46.C
47.2Mg +CO22MgO + C 6.02×1023
48.温度 温度越高,溶解KNO3越多 压强(或气体类型)
49.(1)4900 50
(2)100
(3)小于