- 499.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
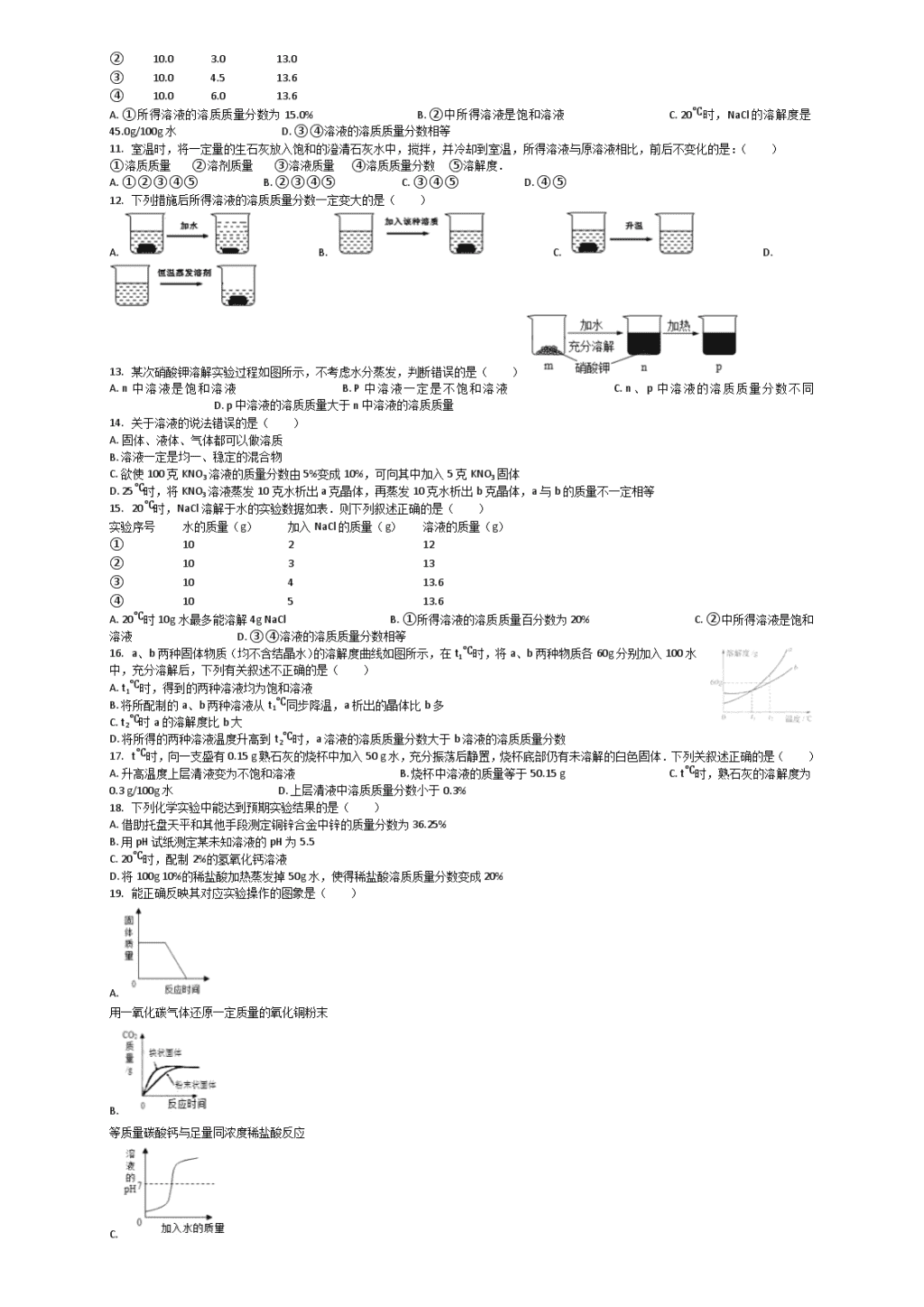
中考化学专项练习之溶液---溶质质量分数的概念和计算(含解析、全国通用)
一、单选题(本大题共19小题,共38.0分)
1. 依据相关信息完成31-33题:
小资料:硝酸钾的溶解度数值如下所示:
项目
10℃
20℃
30℃
40℃
50℃
60℃
70℃
KNO3
21g
32g
46g
64g
86g
110g
138g
现有a、b、c、d四个烧杯中分别盛有50g水,在40℃时,向四个烧杯中分别加入55g、43g、32g、16g硝酸钾,充分溶解后,如图所示.
若将a、b烧杯升温至65℃,c、d烧杯保持不变,则溶质质量分数最大的是( )
A. a B. b C. c D. d
2. 如图是甲、乙、丙三种固体物质在0℃~50℃之间的溶解度随温度变化的曲线图,某同学从图中获得如下几条信息,其中错误的是( )
A. 30℃时,甲、乙两种固体物质的溶解度一样
B. 在0℃~50℃之间,甲、乙两固体物质的溶解度随温度上升而增加
C. 在0℃~50℃之间,乙、丙两固体物质的溶解度相差越来越大
D. 在30℃~40℃之间,三者的溶液中甲溶液的溶质质量分数最大
3. 化学学习中经常会遇到一些“相等”,下列有关“相等”的说法中错误的是( )
A. 化学反应前后原子的总数一定相等 B. 催化剂在反应前后质量一定相等 C. 中和反应中参加反应的酸和碱的质量一定相等 D. 溶液稀释前后溶质的质量一定相等
4. 20℃时,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,有关说法不正确的是( )
物质
甲
乙
丙
未溶解固体的质量/g
7
0
3
A. 升高温度,三溶液中溶质的质量分数一定会改变 B. 所得溶液可能都是饱和溶液 C. 三溶液中溶质的质量分数乙>丙>甲 D. 20℃时,甲的溶解度最小
5. 下列各选项与如图所示曲线相符的是 ( )
选项
横坐标
纵坐标
A
向一定量稀硫酸中加入锌粉的质量
溶液中氢元素的质量
B
向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量
产生气体的质量
C
向一定量的澄清石灰水中加入碳酸钠溶液的质量
生成沉淀的质量
D
在一定温度下,向一定量的饱和硝酸钾溶液中加入硝酸钾固体的质量
溶液中溶质的质量分数
A. A B. B C. C D. D
6. 下列说法正确的是( )
A. 100g 10%的硝酸钾溶液的溶质质量分数增大到20%,需再加入10g硝酸钾固体
B. 将10g食盐溶解在100g水中,所得溶液的溶质质量分数为10%
C. 20%的食盐溶液中取出的5 g溶液的溶质质量分数比原溶液小
D. 当溶液被水稀释时,溶液中保持不变的是溶质的质量
7. 下列关于溶液说法正确的是( )
A. 将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B. 把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C. 配制50g16%的氯化钠溶液一般经过计算、称量、溶解等步骤
D. 向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
8. 有关如图试剂的描述正确的是( )
A. 溶质为胆矾 B. 溶液呈蓝色 C. CuSO4的摩尔质量为160 D. 溶质与溶剂的质量比是1:20
9. 如图是恒温下模拟海水晒盐的过程示意图,根据图示判断正确的是( )
A. 氯化钠溶解度受温度影响不大,且随温度升高而增大 B. 乙烧杯的溶液是饱和溶液 C. 丙和丁溶液中溶质质量分数相同 D. 甲乙烧杯中的溶液溶质的质量分数可能相同
10. 20℃时,NaCl溶解情况见表,相关叙述正确的是( )
实验
序号
水的
质量(g)
加入NaCl
的质量(g)
溶液的
质量(g)
①
10.0
1.5
11.5
②
10.0
3.0
13.0
③
10.0
4.5
13.6
④
10.0
6.0
13.6
A. ①所得溶液的溶质质量分数为15.0% B. ②中所得溶液是饱和溶液 C. 20℃时,NaCl 的溶解度是45.0g/100g 水 D. ③④溶液的溶质质量分数相等
11. 室温时,将一定量的生石灰放入饱和的澄清石灰水中,搅拌,并冷却到室温,所得溶液与原溶液相比,前后不变化的是:( )
①溶质质量 ②溶剂质量 ③溶液质量 ④溶质质量分数 ⑤溶解度.
A. ①②③④⑤ B. ②③④⑤ C. ③④⑤ D. ④⑤
12. 下列措施后所得溶液的溶质质量分数一定变大的是( )
A. B. C. D.
13. 某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,判断错误的是( )
A. n中溶液是饱和溶液 B. P中溶液一定是不饱和溶液 C. n、p中溶液的溶质质量分数不同 D. p中溶液的溶质质量大于n中溶液的溶质质量
14. 关于溶液的说法错误的是( )
A. 固体、液体、气体都可以做溶质
B. 溶液一定是均一、稳定的混合物
C. 欲使100克KNO3溶液的质量分数由5%变成10%,可向其中加入5克KNO3固体
D. 25℃时,将KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量不一定相等
15. 20℃时,NaCl溶解于水的实验数据如表.则下列叙述正确的是( )
实验序号
水的质量(g)
加入NaCl的质量(g)
溶液的质量(g)
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
13.6
A. 20℃时10g水最多能溶解4g NaCl B. ①所得溶液的溶质质量百分数为20% C. ②中所得溶液是饱和溶液 D. ③④溶液的溶质质量分数相等
16. a、b两种固体物质(均不含结晶水)的溶解度曲线如图所示,在t1℃时,将a、b两种物质各60g分别加入100水中,充分溶解后,下列有关叙述不正确的是( )
A. t1℃时,得到的两种溶液均为饱和溶液
B. 将所配制的a、b两种溶液从t1℃同步降温,a析出的晶体比b多
C. t2℃时a的溶解度比b大
D. 将所得的两种溶液温度升高到t2℃时,a溶液的溶质质量分数大于b溶液的溶质质量分数
17. t℃时,向一支盛有0.15 g熟石灰的烧杯中加入50 g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列关叙述正确的是( )
A. 升高温度上层清液变为不饱和溶液 B. 烧杯中溶液的质量等于50.15 g C. t℃时,熟石灰的溶解度为0.3 g/100g水 D. 上层清液中溶质质量分数小于0.3%
18. 下列化学实验中能达到预期实验结果的是( )
A. 借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B. 用pH试纸测定某未知溶液的pH为5.5
C. 20℃时,配制2%的氢氧化钙溶液
D. 将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
19. 能正确反映其对应实验操作的图象是( )
A.
用一氧化碳气体还原一定质量的氧化铜粉末
B.
等质量碳酸钙与足量同浓度稀盐酸反应
C.
向一定体积的稀盐酸中逐滴加入足量的水
D.
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾固体
二、双选题(本大题共3小题,共12.0分)
20. 下列图象不能正确反映其对应变化关系的是( )
A.
一定温度下,向不饱和KNO3溶液中加入KNO3固体
B.
向硝酸和硫酸铜的混合溶液中滴加氢氧化钡溶液
C.
向等质量的金属镁和铝中分别加入等质量且质量分数相等的足量稀硫酸
D.
向等质量的氧化钙、氢氧化钙中分别加入等质量分数的稀盐酸至过量
21. 现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生氢气的质量为m.下列说法正确的是( )
A. 若混合物为Fe、Cu,m一定小于0.2g
B. 若混合物为Fe、A1,m可能是0.2g
C. 若混合物为Fe、Cu,则稀盐酸中溶质质量分数一定小于7.3%
D. 若混合物为Fe、A1,则稀盐酸中溶质质量分数可能是7.3%
22. 下列说法不正确的是( )
A. 不同元素之间最本质的区别是质子数不同
B. 煤炉上方的蓝色火焰是一氧化碳在燃烧
C. 空气中混有可燃性气体,遇明火可能发生爆炸,若混有面粉则不可能发生爆炸
D. 不饱和溶液转化为饱和溶液,溶液中溶质质量分数一定增大
三、填空题(本大题共3小题,共3.0分)
23. 随着经济的发展,水的污染越来越严重.加入______可以除去水中的色素或异味;生活中既可以降低水的硬度又可以除去水中的细菌的方法是______;水也是一种常用的溶剂,某同学若用9g氯化钠配制成0.9%的生理盐水,需要加入水的质量是______g.
24. 在人体组织里葡萄糖在酶的催化作用下发生缓慢氧化,化学方程式为______,同时释放出能量,供机体活动和维持恒定体温的需要.现要把10g浓度为5%的葡萄糖溶液稀释为2%的葡萄糖溶液,需要加水的质量为______g.
25. 如图是甲乙两种固体物质的溶解度曲线,回答:
(1)在t1℃甲的饱和溶液变为不饱和溶液可采用的方法是______
(2)t2
℃时,将25g甲放入100g水中,发现固体先全部溶解,一段时间后又有晶体析出,请你解释甲固体全部溶解的原因______
(3)下列说法正确的是______
①甲中含有少量的乙可采用降温结晶的方法提纯甲
②t2℃时,甲溶液溶质的溶质质量分数比乙溶液大
③t2℃时,将等质量的甲乙两物质分别加水配成饱和溶液,甲溶液质量比乙溶液质量小
④将t1℃甲乙的升温至t2℃时,甲乙溶液的溶质质量分数都不变.
四、简答题(本大题共11小题,共55.0分)
26. 生命必需的水在化学中用途广泛.
(1)电视节目《荒野求生》中的生命吸管(如图1所示),是一 种将污水净化为饮用水的吸管装置,可以出去 99.3%的细菌和 病毒,但难以出去汞等金属离子.野外环境中很多地下水含较 多______称为硬水;生命吸管中活性炭______(“能”或“不能”)使硬水软化.家庭中使硬水软化一般采取______方法.
(2)配制 1000g 质量分数是 16%的氯化钠溶液,所需氯化钠 的质量为______,水的体积为______mL(水的密度近似看 作 1g/mL).
(3)图2是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
①t1℃时,甲、乙、丙三种物质的溶解度大小关系______.
②t1℃时,完全溶解 5g 丙物质至少需要水______g.
③t2℃时,将 20g 甲加入到 100g 水中,充分搅拌后所得溶液是 甲的______溶液(填“饱和”或“不饱和”),可以用图2中______点(填“a”“b”“c”)表示.
④将甲、丙的饱和溶液从 t2℃降温到 t1℃,对所得溶液的叙述不 正确的是______
A.都是饱和溶液 B.溶剂质量:甲<丙
C.析出固体质量:甲>丙 D.溶质质量分数:甲=丙.
27. 为了测定某含杂质的赤铁矿样品中氧化铁的含量(杂质不溶于水,不与其它物质反应)某化学小组进行了如下实验:
(1)若用质量分数98%的浓硫酸配制上述实验所用稀硫酸,所加水的质量是______;
(2)发生反应的化学方程式为______
(3)根据已知条件列出求解40g该赤铁矿样品中氧化铁的质量(X)的化例式______
(4)该赤铁矿中氧化铁的含量为______
(5)向所得滤液中加入284g氷,则最终所得滤液中溶质的质量分数为______;
(6)现用400t此种赤铁矿石炼制生铁,冶炼过程中损失铁元素10%,则最终可炼得含铁90%的生铁的质量为______.
28. 溶解度可表示物质溶解性的大小
(1 )甲,乙、丙三种固体的溶解度曲线如图一:10℃时,将等质量不含结晶水的甲、乙两种固体分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图二,请回答下列问题:
①______℃时,乙的溶解度与丙的溶解度相等.
②50℃时,甲物质的饱和溶液70g中,甲物质的质量是______g,若在100g水中恰好形成甲物质的饱和溶液,再把该饱和溶液稀释成质量分数为10%的溶液,应加水______g.
③20℃时,烧杯中分别盛有相同质量甲、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃,盛两固体烧杯中的现象是______.
④如图二,10℃时,乙的溶液______是不饱和溶液(填“一定”、“一定不”或“可能”).
⑤若固体甲中混有少量固体乙,则提纯甲的操作步骤是______(填序号).
a.溶解b.过滤c.降温结晶d.加热浓缩
(2)气体的溶解度也有一定的变化规律,打开可乐瓶会溢出大量气泡,由此可见,在温度不变时,压强越小,CO2的溶解度越______.为增大CO2的溶解度,可采用的一种方法是______.
29. 水是一种重要的资源.
(1)电解水实验揭示了水的组成.图1实验中得到氧气的试管是______(填“1”或“2”).
(2)水分解的微观示意图如图2,方框内应是______(填字母序号).
A
B
C
D
(3)海水淡化可缓解淡水资源匮乏的问题.图3为太阳能海水淡化装置示意图.
①水变成水蒸气的过程中,不发生变化的是______(填字母序号).
A.分子质量 B.分子种类 C.分子间隔
②利用该装置将一定量的海水暴晒一段时间后,剩余海 水中氯化钠的质量分数会______(填“变大”“变小”或“不变”).
30. 同学们利用如图所示的装置,对质量守恒定律进行了谈究.实验结束后,老师另外提出了几个问题,请你一起参与思考.
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是______(选填“A”、“B”或“A和B”)
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红.根据上述已知条件,通过分析可以确定的是______(选填序号)
①原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是多少?
31. 水在生产、生活中有着十分重要的作用.
①科学家在不断研究水的开发和利用技术.图1是水在一定条件下的转化过程.
Ⅰ.写出电解水装置反应的化学方程式______.
Ⅱ.燃料电池反应的微观模拟图如图2所示
“”表示的微粒名称是______;
反应后的容器中成分判断正确的是______.(选填编号)
A.是混合物 B.氧元素只存在化合态
C.原子总数减少 D.分子总数减少
Ⅲ.该转化过程中,可循环利用的甲物质是______.该技术的优点是______.(选填编号)
A.开发使用新能源 B.减少 生产过程对环境的污染
C.可以彻底替代化石燃料 D.主要用于证明水的组成
②净化水有多种方法.
Ⅰ.活性炭去除异味,活性炭主要起______作用.消毒水时常用二氧化氯,ClO2中氯元素的化合价是______.
Ⅱ.应急净水器可以将海水淡化.如用此装置将2000g含氯化钠3%的海水暴晒4小时,可收集到500g可饮用水,此时剩余海水中氯化钠的质量分数为______.
32. 如表是氢氧化钙和氢氧化钠的溶解度数据.请回答下列问题:
温度/℃
0
20
40
60
80
100
溶解度
(g/100gH2O)
氢氧化钙
0.19
0.17
0.14
0.12
0.09
0.08
氢氧化钠
31
91
111
129
313
336
①氢氧化钠溶解度曲线是______(选填“甲”或“乙”)
②把接近饱和的氢氧化钙溶液变成饱和溶液的方法是______.
③20℃时,10g水中溶解______克氢氧化钠恰好饱和.
④20℃时,分别在100克水中加入m克氢氧化钠和氢氧化钙固体,可得到质量分数相同的两种溶液,则m的取值范围是______ .
⑤60℃时,氢氧化钠的饱和溶液中含少量氢氧化钙,把其降温,结晶后过滤,对滤渣、滤液成分分析正确的是______.
Ⅰ.滤渣中只有氢氧化钠
Ⅱ.滤渣中一定有氢氧化钠,可能有氢氧化钙
Ⅲ.滤液中一定有氢氧化钙,可能有氢氧化钠
Ⅳ.滤液中一定有氢氧化钠和氢氧化钙
⑥氢氧化钙溶液和氢氧化钠溶液都是无色溶液,都能与二氧化碳发生反应.
氢氧化钠与二氧化碳反应的方程式为:2NaOH+CO2→Na2CO3+H2O.
氢氧化钙与二氧化碳反应的方程式为______.
根据以上信息,你认为______(选填“能”或“不能”)用二氧化碳来鉴别这两种溶液.
33. 水是宝贵的自然资源,让我们一起走进“水”的世界.
①如图1电解水实验中,反应的化学方程式是______.电解水过程发生改变的微粒名称是______.
②医疗上常用0.9%NaCl溶液作生理盐水,配制1000g生理盐水需要氯化钠固体的质量为______g;水还可以制取碳酸饮料,该过程中发生反应的化学方程式为______.
③某化学兴趣小组欲进行粗盐的初步提纯.
粗盐的提纯实验步骤包括:a 计算产率;b 过滤,c 溶解,d 蒸发,e 称量.实验步骤的正确顺序是:e、______、a(填序号).
若NaCl的产率偏低,则可能的原因是______(填字母).
A.过滤时滤纸有破损 B.蒸发后所得精盐未完全蒸干,含有水;
C.溶解含泥沙的粗食盐时,加入的水量不足
提示:产率=(所得晶体的质量)/(所取样品的质量)*100%
④已知KCl的溶解度20℃时为34g/100g 水,40℃时为40g/100g水.某实验小组做了如图2所示实验.
A所得溶液中溶质与溶剂的质量比为______;
溶质的质量分数相等的是______.
Ⅰ.B和CⅡ.B和EⅢ.C和DⅣ.D和E.
34. 如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是______.
(2)若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是______.
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
(3)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是______.
35. (1)如表是CO2气体在水中的几组溶解度数据(单位:mL/100mL水)
0
25
50
75
100
1
1.79
0.752
0.423
0.307
0.231
10
15.92
7.14
4.095
2.99
2.28
25
29.30
16.20
9.71
6.82
5.73
①根据CO2的溶解度表,可以得出气体的溶解度随外界条件的变化规律是:______、______.
②打开可乐瓶有气体逸出,说明原瓶中的压强______(填“>”、“<”或“=”)瓶外大气压强.
(2)甲、乙两物质(均不含结晶水)的溶解度曲线如图,请回答.
①t2℃时,甲、乙两物质溶解度较大的是______.
②t1℃时,50g水中加入30g乙,充分溶解所得溶液的质量是______g.
③t2℃时,将乙的不饱和溶液转化为饱和溶液一定可行的方法 是______(填编号).
A.加足量溶质乙 B.蒸发溶剂至晶体析出 C.降温
④t2℃时,甲、乙溶液的溶质质量分数相等且均为a%,则甲溶液一定为______(填“饱和”或“不饱和”)溶液,a%的取值范围为______.
⑤将t2℃等质量的甲、乙饱和溶液分别降温到t1℃,有关说法正确的是______.
A.t1℃时溶质质量:甲=乙B.t1℃时溶剂质量:甲>乙
C.t1℃时溶液质量:甲<乙D.析出晶体质量:甲>乙.
36. 如表是甲乙丙三种物质(不含结晶水)在不同温度时的溶解度,根据表格信息答题.
温度/℃
0
20
40
60
溶解度
g/100g水
甲
13.3
31.6
63.9
110
乙
35.7
36.0
36.6
37.3
丙
0.18
0.16
0.14
0.12
①0℃时,甲乙丙溶解度最大的物质是______.
②甲、乙溶解度相等时的温度范围是______.
③20℃时S乙=36.0g/100g水的含义是______.
④甲固体中混有少量乙,提纯甲的操作是:加水溶解→______→______→过滤、洗涤、烘干.
⑤将60℃的甲、乙、丙饱和溶液分别降温到0℃,下列说法正确的是______.
a.均为0℃时的饱和溶液
b.析出晶体质量:甲>乙>丙
c.0℃溶液的溶质质量分数:乙>甲>丙.
五、探究题(本大题共3小题,共30.0分)
37. 根据如图装置回答问题:
①写出标号仪器名称:a______.
②用氯酸钾在装置A中制氧气,若试管口有水珠出现,此现象是______(选填“物理”或“化学”)变化引起的.
③用粉末状碳酸钙与稀盐酸反应制二氧化碳,可使反应平稳进行的发生装置是______ ,写出该反应的化学方程式______.收集二氧化碳和氧气都可用E装置的原因是______.
④探究催化剂的种类对过氧化氢分解速率的影响,实验数据如表.(其他影响实验的因素均相同)
编号
过氧化氢溶液质量/克
催化剂质量/克
待测数据/秒
实验1
100.0
MnO2 0.2
t1
实验2
100.0
CuO X
t2
Ⅰ.表中X的数值应是______.
Ⅱ.表中的待测数据指测量收集相同体积氧气所需时间,若t1 ______ (选填“>”、“<”或“=”)t2,则MnO2的催化效果优于CuO.或者还可以测量______,也能达到实验目的.
Ⅲ.测得实验1中完全反应后生成氧气1.6克,求过氧化氢溶液的溶质质量分数.(根据化学方程式计算)______.
38. 现有一份纯碱样品,其中只含有一种可溶性杂质.为了测定样品中纯碱的含量,做了如下的实验,请你回答下列问题:
(1)写出上述反应的化学方程式______;
(2)根据已知条件列出求解样品中纯碱的质量(x)比例式______;
(3)样品中纯碱的质量分数为______;
(4)若将反应后的滤液恒温蒸发掉123.5g水,则最终所得溶液中溶质的质量分数为______;
(5)加人氯化钙溶液的过程中溶液中溶质的质量变化情况为______;
(6)若用上述纯碱样品265t制取烧碱,则可制得纯度为80%的烧碱______t.
39. 水和溶液在生产、生活中十分常见.
Ⅰ.自来水生产过程中加入明矾的目的是______.
Ⅱ.图1是a、b两种固体物质(不含结晶水)在水中的溶解度曲线:
①a的溶解度小于b的溶解度的温度范围______.
②30℃时,将20g a物质放入20g水中充分溶解得到溶液的质量
为______g.溶液中溶质的质量分数为______.如图2所示,并参照图1,试管1、2中分别盛有20℃时等质量的a、b物质的饱和溶液,底部有等质量的a、b物质剩余,向烧杯里的水中加入冰块,下列判断错误的是______(忽略溶剂的蒸发,析出的晶体不含结晶水)
A.试管2底部的固体减少
B.a的溶液由饱和溶液变成不饱和溶液
C.a的溶液中溶剂质量等于b的溶液中溶剂质量
D.变化后试管2的溶液中溶质质量小于试管1的溶液中溶质质量.
六、计算题(本大题共11小题,共55.0分)
40. 现有氢氧化钠和碳酸钠的混合溶液,为了测定溶液中碳酸钠的溶质的质量分数.化学小组的同学取上述溶液50g于烧杯中,逐滴加入稀盐酸,如图所示关系:
(1)反应生成二氧化碳的质量为______g.
(2)计算溶液中碳酸钠的溶质的质量分数.
41. 某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数
1
2
3
4
稀盐酸的用量
5g
5g
5g
5g
剩余固体的质量
1.5g
1.0g
0.5g
0.3g
(1)从以上数据可知,这四次实验中,第______次石灰石样品中的碳酸钙已完全反应.
(2)石灰石样品中碳酸钙的质量分数为______.
(3)该化学兴趣小组所用稀盐酸的溶质质量分数______.
(4)第4次实验结束后,所得溶液中氯化钙的质量分数为______(计算结果精确到0.1%)并写出其计算过程:
42. 某同学欲测定某石灰石样品中碳酸钙的质量分数.取12.5g石灰石样品于烧杯中,再向其中加入100g稀盐酸,恰好完全反应后,测得烧杯内物质的总质量变为108.1g(已知:石灰石中的杂质既不溶于水,也不与其他物质反应,生成的二氧化碳全部逸出).试计算:
(1)生成的二氧化碳质量;
(2)该样品中碳酸钙的质量分数;
(3)所用稀盐酸的溶质质量分数.
43. 蓄电池中所用电解液是质量分数约为28%的硫酸.若用1升98%的浓硫酸(密度为1.84g/cm3)稀释成28%的硫酸,可得28%的硫酸溶液多少克?需加水多少毫升?
44. 向盛有50g稀硫酸的烧杯中倒入10g黄铜(铜锌合金)粉末,恰好完全反应,称得未溶物质量为6.75g.试计算:
(1)该黄铜中含锌的质量.
(2)所用稀硫酸中硫酸的质量分数.
(3)反应后所得溶液中溶质的质量分数(结果精确到0.1%).
45. 某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:(假设双氧水完全分解,不考虑氧气中带出的水分)请计算:
(1)生成氧气的质量______g,物质的量______.
(2)这瓶过氧化氢溶液中溶质的质量分数是多少?(写出计算过程)______.
46. 某同学利用石灰石和稀盐酸进行如下实验,操作过程和数据如图(样品中杂质不与酸反应也不溶于水).
(1)15g石灰石样品中CaCO3物质的量为______mol.
(2)列式计算不饱和溶液A的溶质质量分数(结果准确到0.1%).
47. 12.5g碳酸钙和氧化钙粉未组成的均匀混合物中含碳酸钙80%,向其中加入10%的稀盐酸至恰好完全反应.
(1)混合物中碳酸钙的质量.
(2)反应后所得溶液中溶质的质量分数.(计算结果精确到0.1%)
48. 请根据如图标签的信息回答
(1)H2SO4中氢元素、硫元素和氧元素的质量比为______(写最简整数比)
(2)现要配制100g 4.9%的稀硫酸,需要这种浓硫酸______mL(计算结果精确到0.1);配制过程中需要加水______.
49. t℃时,两个装有100克水的烧杯中,分别加入不带结晶水的甲、乙物质各80克,充分搅拌.根据如图溶解度曲线求解:
(1)t℃时,______(选填“甲”或“乙”)溶液是饱和溶液;
(2)t℃时,甲溶液的溶质质量分数(精确到0.1%).
50. 取10g某锌样品(含少量杂质,且杂质不溶于水,也不与酸反应)于烧杯中,向其中加入一定量的稀硫酸,当加入稀巯酸的质量为100g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
(1)恰好完全反应时所生成氢气的质量为______g.
(2)所加硫酸溶液的溶质质量分数为多少?