- 171.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
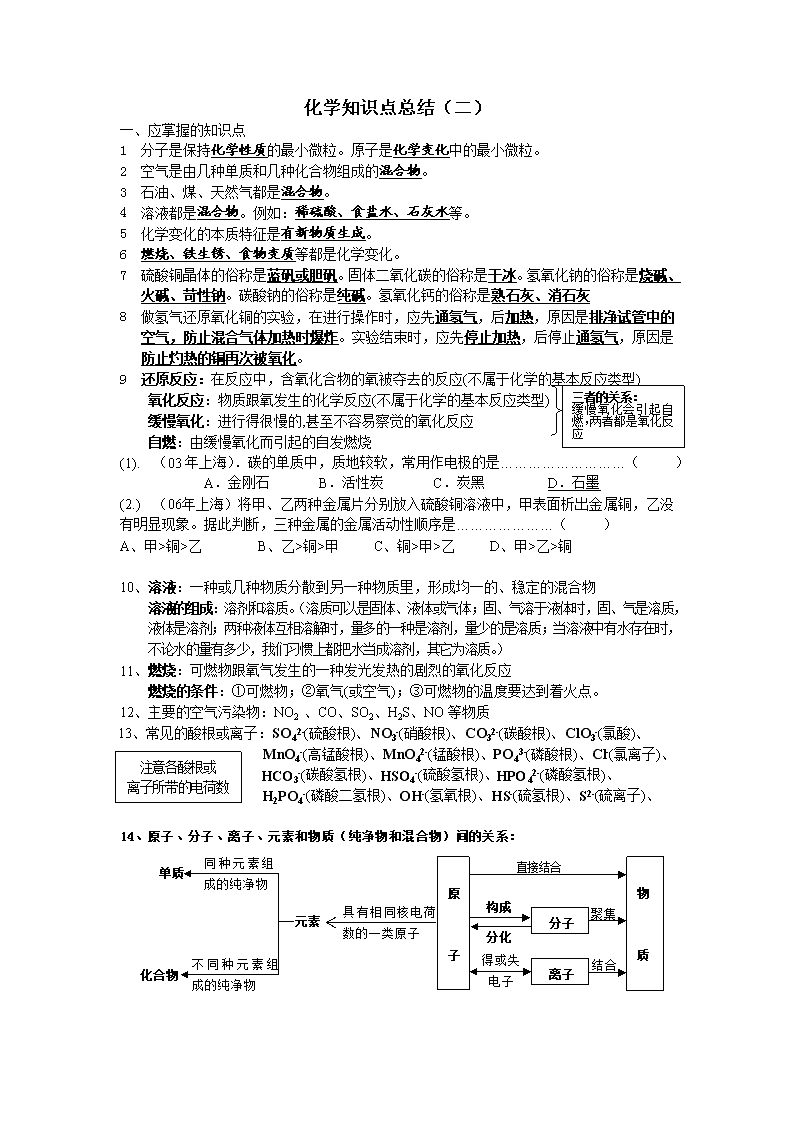
化学知识点总结(二)
一、应掌握的知识点
1 分子是保持化学性质的最小微粒。原子是化学变化中的最小微粒。
2 空气是由几种单质和几种化合物组成的混合物。
3 石油、煤、天然气都是混合物。
4 溶液都是混合物。例如:稀硫酸、食盐水、石灰水等。
5 化学变化的本质特征是有新物质生成。
6 燃烧、铁生锈、食物变质等都是化学变化。
7 硫酸铜晶体的俗称是蓝矾或胆矾。固体二氧化碳的俗称是干冰。氢氧化钠的俗称是烧碱、火碱、苛性钠。碳酸钠的俗称是纯碱。氢氧化钙的俗称是熟石灰、消石灰
8 做氢气还原氧化铜的实验,在进行操作时,应先通氢气,后加热,原因是排净试管中的空气,防止混合气体加热时爆炸。实验结束时,应先停止加热,后停止通氢气,原因是防止灼热的铜再次被氧化。
9 还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)
氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型)
缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应
自燃:由缓慢氧化而引起的自发燃烧
三者的关系:
缓慢氧化会引起自燃,两者都是氧化反应
(1). (03年上海).碳的单质中,质地较软,常用作电极的是………………………( )A.金刚石 B.活性炭 C.炭黑 D.石墨
(2.) (06年上海)将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是…………………( )
A、甲>铜>乙 B、乙>铜>甲 C、铜>甲>乙 D、甲>乙>铜
10、溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶液的组成:溶剂和溶质。(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质。)
11、燃烧:可燃物跟氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:①可燃物;②氧气(或空气);③可燃物的温度要达到着火点。
12、主要的空气污染物:NO2 、CO、SO2、H2S、NO等物质
13、常见的酸根或离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸)、
MnO4-(高锰酸根)、MnO42-(锰酸根)、PO43-(磷酸根)、Cl-(氯离子)、
HCO3-(碳酸氢根)、HSO4-(硫酸氢根)、HPO42-(磷酸氢根)、
H2PO4-(磷酸二氢根)、OH-(氢氧根)、HS-(硫氢根)、S2-(硫离子)、
14、原子、分子、离子、元素和物质(纯净物和混合物)间的关系:注意各酸根或
离子所带的电荷数
元素
单质
化合物
同种元素组成的纯净物
不同种元素组成的纯净物
原
子
具有相同核电荷数的一类原子
分子
构成
分化
离子
得或失电子
直接结合
物
质
聚集
结合
物质
化合物
存在状态
表示方法
单质
元素符号
元素
宏观组成
相对质量—相对原子质量
相对质量—相对分子质量
微 观 构 成
核外电子(—)
表示方法
元素符号
质子(+)
中子(0)
化学式
由原子构成
结构
表示方法
原子
分子
原子核
分类
无机化合物
纯净物
单质
金属单质
非金属单质
稀有气体
碱
氧化物
酸
有机化合物
化合物
盐
混合物
离子
带电的原子或原子团
表示方法
离子符号
相对质量—各原子的相对原子质量和
15、物质的结构:
16、化学符号的意义及书写:
(1)化学符号的意义:a.元素符号:①表示一种元素;②表示该元素的一个原子。
b.化学式:本知识点的第5点第(1)小点
c.离子符号:表示离子及离子所带的电荷数。
d.化合价符号:表示元素或原子团的化合价。
符号前有数字时符号所表示的粒子
元素符号:原子
化学式:分子
离子符号:离子
如:5CO2 只表示5个二氧化碳分子
如:4Mg2+ 只表示4个镁离子
如:3S 只表示3个硫原子
当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示该种粒子的个数。
如: 钙离子:Ca2+
如: 氢原子:H
如: 二氧化碳分子:CO2
如正二价的镁元素:Mg
+2
(2)化学符号的书写:a.原子的表示方法:用元素符号表示
17、蒸发溶剂、加入溶质、升高(或降低)温度
加入溶剂、降低(或升高)温度
不饱和溶液
饱和溶液
特征的反应
一、7个分解反应:
⑴ Cu2(OH)2CO3 △ 2CuO+H2O+CO2↑; ⑵ 2H2O 通电 2H2↑+O2 ↑;
△
⑶ 2KMnO4 △ K2MnO4+MnO2+O2↑; ⑷ 2KClO3 MnO2 2KCl+3O2 ↑;
⑸ H2CO3 = H2O + CO2↑; ⑹ CaCO3 高温 CaO + CO2↑;
⑺ 2HgO △ 2Hg+O2↑
二、3类置换反应:
⑴金属与酸:Zn+H2SO4 = ZnSO4+H2↑; Zn+2HCl = ZnCl2+H2↑
Mg+H2SO4 = MgSO4+H2↑; Mg+2HCl = MgCl2+H2↑
Fe+H2SO4 = FeSO4+H2↑; Fe+2HCl = FeCl2+H2↑
2Al+3H2SO4 = Al2(SO4)3+3H2↑; 2Al+6HCl = 2AlCl3+3H2↑
⑵铁与硫酸铜:Fe+CuSO4 = FeSO4+Cu
⑶氢气或碳做还原剂:H2 + CuO △ Cu + H2O; 3H2+Fe2O3 高温 2Fe+3H2O
C+2CuO 高温 2Cu+CO2↑; 3C+2Fe2O3 高温 4Fe+3CO2↑
三、3种氧化还原反应:
⑴氢气做还原剂: H2 + CuO △ Cu + H2O; 3H2+Fe2O3 高温 2Fe+3H2O
⑵碳做还原剂: C+2CuO 高温 2Cu+CO2↑; 3C+2Fe2O3 高温 4Fe+3CO2↑
⑶一氧化碳做还原剂:CO+CuO △ Cu+CO2; 3CO+Fe2O3 高温 2Fe+3CO2
四、两种沉淀:
⑴ Ca(OH)2+CO2 = CaCO3↓+H2O ⑵ 2NaOH+CuSO4 = Cu(OH)2↓+Na2SO4
白色沉淀 蓝色沉淀
常考的一些知识点:
10. 五种白色沉淀是AgCl、BaSO4、CaCO3、BaCO3、Mg(OH)2;一种蓝色沉淀是
Cu(OH)2;一种红褐色沉淀是Fe(OH)3。 其中不溶于水,也不溶于稀硝酸的是AgCl和BaSO4。
11. 可以用酒精灯直接加热的仪器是试管、蒸发皿、燃烧匙。
12. 可以用酒精灯间接加热的仪器是烧杯。
13. 用滴管往试管中滴加液体时,滴管不应伸入试管中。
10. CO在氧气中燃烧,火焰呈蓝色。
11. 收集气体应用集气瓶;量取一定体积的液体需用量筒;溶解较多固体时应用烧杯;取用粉末状固体药品一般使用药匙;取用块状药品应使用镊子。加热时常用酒精灯。
12. 氧气的收集方法是向上排空气法和排水法。氢气的收集方法是向下排空气法和排水法。二氧化碳的收集方法是向上排空气法。
13. 做氢气还原氧化铜的实验,在进行操作时,应先通氢气,后加热,原因是排净试管中的空气,防止混合气体加热时爆炸。实验结束时,应先停止加热,后停止通氢气,原因是防止灼热的铜再次被氧化。
14. 酒精灯火焰温度最高的是外焰。
15. 最简单的有机物是甲烷。
16. 氧气的验满方法是带火星的木条在集气瓶口复燃。二氧化碳的验满方法是燃着木条在集气瓶口熄灭。
17. 能区别盐酸和硫酸的试剂是氯化钡BaCl2溶液。
18. 能鉴别氢氧化钠溶液、盐酸、水的试剂是石蕊试剂。
19. 在氧气、稀硫酸、熟石灰、干冰四种物质中,可用来金属除锈的是稀硫酸;可用来改良酸性土壤的是熟石灰;可用于潜水、抢救病人的是氧气;可用作人工降雨的是干冰。
20. 氢气是一种无色无味的气体,比空气轻,难溶于水。
21. 二氧化碳是一种无色无味的气体,比空气重,能溶于水。
22. 由饱和溶液到不饱和溶液的方法是升高温度或增加溶剂。
23. 由不饱和溶液到饱和溶液的方法是降低温度、增加溶质或减少溶剂。
24. 溶解度是指在一定温度下,某种固体物质在100克溶剂中达到饱和状态所溶解的质量。
25. 20℃时,食盐的溶解度为36克。就是说在20℃时,100克水中最多可以溶解食盐36克。
26. 影响固体溶解度的因素是温度。影响气体溶解度的因素是温度和压强。
27. 若要分离溶解度随温度的升高而明显增大的物质,应用冷却热饱和溶液法。
28. 配制溶液的步骤是计算、称量或量取、溶解。
29. 粗盐提纯的步骤是溶解、过滤、蒸发。
30. 浓硫酸在稀释时,应将浓硫酸慢慢注入水中,并不停搅拌。
例1 右图装置具有集气、贮气、洗气等功能。试用“a”或“b”填空:
⑴作集气瓶:①用排空气法收集氢气时,氢气应从 端通入;收集氧气时,氧气应从 端通入,检验氧气是否已收集的方法是将带火星的木条放在 处。②用排水法收集气体时,需先在瓶里盛 。收集氢气时,氢气应从 端通入;收集氧气时,氧气应从 端通入。
⑵作贮气瓶:若瓶中已贮存有难溶于水的气体,为使气体逐渐排出,可往 端逐渐通入 。
⑶作洗气瓶:为除去(或称洗去)CO中的少量CO2,可在瓶中盛半瓶 ,将混有少量CO2的CO气体从 端通入,则另一端导管排出的即是纯净的CO。
⑷对于医院里给病人输氧时使用该洗气瓶(装半瓶水)的叙述错误的是( )
A便于观察是否有氧气输出 B可观察输出氧气的速度
C有利于让病人吸入具有一定湿度的氧气 D氧气瓶应与洗气瓶的b端连接
例2 为了测定水煤气的组成,用右图A、B、C装置连接后,
澄清石灰水
C
CuO
B
干燥剂
A
将水煤气通入。测定时发现A中质量增加,B中黑色粉末
变红,C中出现浑浊。回答:
⑴装置连接顺序应是:(填A、B、C)
水煤气→ → → ;
⑵A质量增加,说明水煤气中含有 ;
⑶C中的现象说明水煤气中含有 。