- 186.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018无锡市中考化学一模18题专项训练
18-1(11分)梅老师带领的化学兴趣小组在学习资料卡片“石笋和钟乳石的形成”时,发现难溶于水的CaCO3当遇到溶有CO2的水时,会发生反应:CaCO3+CO2+H2O= Ca(HCO3)2,反应生成的Ca(HCO3)2溶解性较大。联想到实验室检验CO2时,将气体通入澄清石灰水中能生成CaCO3。若长时间往澄清石灰水中通入CO2会产生什么样的现象呢?如果长时间向碱溶液中通入二氧化碳又会如何反应?小章和小丽决定用小烧杯盛装一定量的氢氧化钠溶液并不断通入二氧化碳气体进行探究。
【提出问题】氢氧化钠溶液中通入二氧化碳一段时间后,溶液中会有什么溶质?
【查阅资料】
(1)通入少量的二氧化碳时,NaOH与CO2能反应的化学方程式_______________________。
(2)通入过量的二氧化碳时,反应的化学方程式为Na2CO3+CO2+H2O= 2NaHCO3
(3)碳酸氢盐都能溶于水
(4)Na2CO3、NaHCO3的溶液呈碱性、BaCl2呈中性
【提出猜想】
(1) 溶质有NaOH、Na2CO3; (2)溶质为Na2CO3;
(3)溶质是___________________(填化学式); (4)溶质全部是NaHCO3
【设计实验方案】
实验步骤
实验现象
实验结论
①用试管取少量小烧杯中反应后的溶液,
滴加几滴________试液(填酸碱指示剂)
溶液变红色
该溶液显碱性
②将小烧杯中反应后剩下的溶液进行称量,
然后滴加过量的BaCl2溶液
有 生成
猜想(4)不成立
③取步骤②静置后的上层清液,
滴入稀盐酸
有气泡冒出
猜想(1)和(2)不成立
【得出结论】猜想(3)成立
【讨论交流】
(1) 小王同学提出实验步骤①是多余的。你认为该实验设计_______________(填“需要”或“不需要”),理由___________________________________________________。
(2) 将实验步骤②剩下混合物进行过滤、洗涤、干燥、称量。发现所得沉淀质量等于步骤②中所称量的溶液质量的十分之一,试计算氢氧化钠溶液中通入二氧化碳一段时间后,溶液中Na2CO3的质量分数。(写出计算过程,最后结果保留小数点后两位)
(3)验证二氧化碳性质时,如果长时间向澄清石灰水中通入二氧化碳会看到什么样的现象呢?请你描述一下:_____________________________________________。
【知识拓展】梅老师引导同学们再次研读教材,发现遇热或压强变小时,Ca(HCO3)2又能反应生成CaCO3,并告诉同学们,干粉灭火器中用NaHCO3灭火的原理与之类似,请写出该反应方程式 ,在生活中,NaHCO3还有许多用处,请说出一种 。
18-2.(11分)氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因 。下面是几位同学对一瓶氢氧化钠固体成分进行的探究:
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
实验操作
实验现象
结论
取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的 (填一种溶液名称)
有气泡产生
探究二:确定氢氧化钠固体变质的程度
小刚方案:
实验操作
实验现象
结论
①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的氯化钙溶液
产生白色沉淀
氢氧化钠固体部分[来源:Z*xx*k.Com]
变质
②静置后取上层清液于试管中,滴入2滴酚酞试液
[来源:学_科_网]
在上述实验操作中有同学提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案________(填“可行”或“不可行”),理由:
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的质量分数
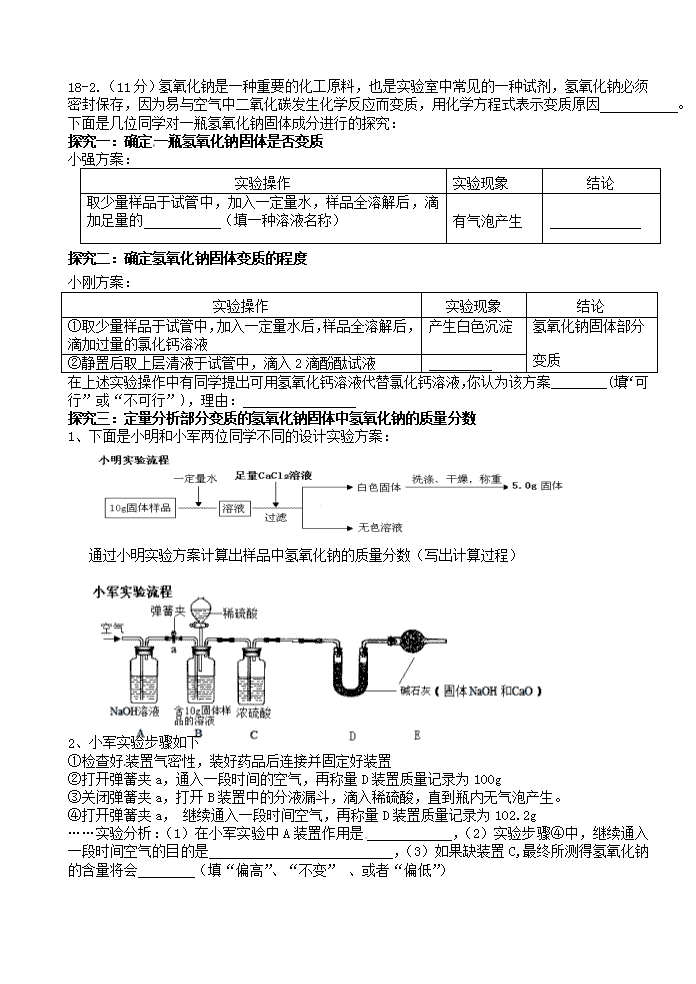
1、下面是小明和小军两位同学不同的设计实验方案:
通过小明实验方案计算出样品中氢氧化钠的质量分数(写出计算过程)
2、小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生。
④打开弹簧夹a, 继续通入一段时间空气,再称量D装置质量记录为102.2g
……实验分析:(1)在小军实验中A装置作用是 ,(2)实验步骤④中,继续通入一段时间空气的目的是 ,(3)如果缺装置C,最终所测得氢氧化钠的含量将会 (填“偏高”、“不变” 、或者“偏低”)
18-3 (12分)家庭养观赏鱼时会在鱼缸里放点“鱼浮灵”,可使水中的含氧量迅速增加。“鱼浮灵”主要成分是过碳酸钠(xNa2CO3 • yH2O2),俗称固体双氧水。某化学兴趣小组对其进行探究。
Ⅰ. “鱼浮灵”的性质研究
实验1:取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;继续向试管中加有少量MnO2粉末,产生大量气泡。将带火星的木条伸入试管,木条_____________,
说明有O2生成,该反应的化学方程式为____________________________。
实验2:取实验1中上层清液,测得溶液pH > 7,说明溶液呈______性(填“酸”、“碱”或“中”);向溶液中滴加足量稀盐酸,产生大量气泡,将产生的气体通入澄清石灰水中,出现浑浊现象,说明有_________生成。
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
Ⅱ. “鱼浮灵”的制备研究
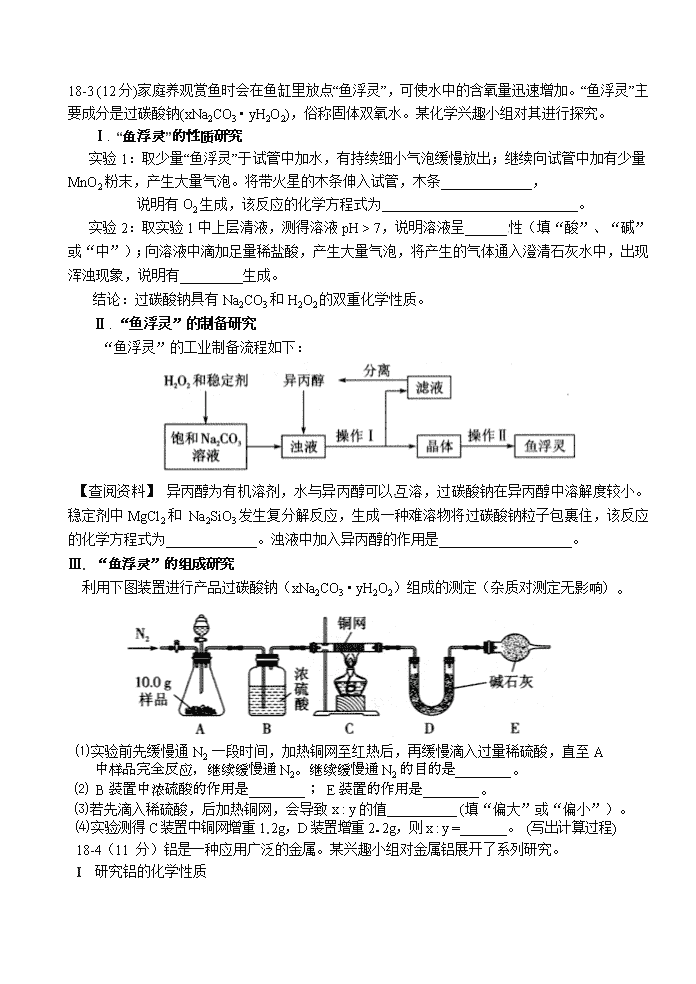
“鱼浮灵”的工业制备流程如下:
【查阅资料】 异丙醇为有机溶剂,水与异丙醇可以互溶,过碳酸钠在异丙醇中溶解度较小。稳定剂中MgCl2和 Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为_____________。浊液中加入异丙醇的作用是___________________。
Ⅲ. “鱼浮灵”的组成研究
利用下图装置进行产品过碳酸钠(xNa2CO3 • yH2O2)组成的测定(杂质对测定无影响)。
⑴实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A
中样品完全反应,继续缓慢通N2。继续缓慢通N2的目的是________。
⑵ B装置中浓硫酸的作用是________; E装置的作用是________。
⑶若先滴入稀硫酸,后加热铜网,会导致x : y的值__________ (填“偏大”或“偏小”)。
⑷实验测得C装置中铜网增重1. 2g,D装置增重2.2g,则x : y =_______。 (写出计算过程)
18-4(11 分)铝是一种应用广泛的金属。某兴趣小组对金属铝展开了系列研究。
I 研究铝的化学性质
(1)铝在常温下会与氧气反应,表面形成一层致密的氧化膜,化学方程式为 。 实验前,需要对铝的表面先进行 (填操作)处理。兴趣小组同学将铝处理好后剪 成若干大小相同的小片,用于后续实验。
(2)铝和酸、碱、盐溶液的反应
实验
操作
现象
结论
一
将 铝 片放 入稀
盐酸中
,试管变烫
铝能与盐酸发生反应,反应放热
二
将 铝 片放 入氢
氧化钠溶液中
铝表面有气泡产生,试管变
烫
铝能与氢氧化钠溶液反应,反应
放热
三
将 铝 放入 硫酸
铜溶液中
铝表面有红色物质产生,溶
液逐渐变成无色
金属活动性:铝 铜
实验一的现象为 。实验二查阅资料:铝和氢氧化钠、水反应生成偏铝酸钠
(NaAlO2)和氢气,反应的化学方程式为 。实验三表明,铝的金属活动性
(填“大于“或”小于“)铜。
(3)小组同学将实验一中的稀盐酸换成等质量、氢离子浓度相同的稀硫酸,相同时间内 发现铝片表面产生的气泡较少,反应较慢。
对比上述两组实验产生猜想。 猜想①:稀盐酸中的氯离子对反应可能有促进作用。 猜想②: 。
为验证猜想①是否合理,应在铝和稀硫酸中加入 (填字母),观察现象。
A.Na2SO4 B.Na2CO3 C.NaCl
II 测定某铝样品中金属铝的质量分数
【资料 1】氢氧化铝能与氢氧化钠溶液反应,但不与氨水反应。
【资料 2】AlCl3 +3NaOH=Al(OH)3↓+3NaCl;AlCl3 +3NH3·H2O = Al(OH)3↓+3NH4Cl。
(4)小组同学称取 4.62g 某金属铝样品(样品中杂质仅为氧化铝),置于图一烧瓶中,加 入足量稀盐酸至完全反应。将反应后的液体分成溶液 1 和溶液 2 两等份,设计两种实验 方案(如图三),通过沉淀质量测定样品中金属铝的质量分数。
方案1: 溶液1
过量NaOH溶液
过量氨水
5.46g沉淀
方案2:
溶液2
5.98g沉淀
图一 图二 图三
①选择正确的一种实验方案,计算样品中金属铝的质量分数(请写出计算过程)。
②小组同学组合图一和图二装置测氢气体积,烧瓶中反应停止即读出量筒内水的体积, 计算后发现金属铝的质量分数偏大,可能的原因是 。