- 109.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014年湖北省武汉市中考化学试卷
一、选择题(本题包括8小题,每小题只有1个正确选项.每小题3分,共24分)
1.(3分)下列变化中,属于化学变化的是( )
A.
将木头锯断
B.
铁生锈
C.
将弯曲的弹簧拉直
D.
水受热变成水蒸气
2.(3分)下列有关原子、分子的说法错误的是( )
A.
原子、分子都是构成物质的微粒
B.
原子、分子总是在不断地运动
C.
分子可以再分,原子不能再分
D.
分子间有一定的间隔
3.(3分)下列有关物质的组成说法正确的是( )
A.
煤气是由一氧化碳、甲烷、氢气等物质组成的混合物
B.
葡萄糖不属于有机物
C.
造成酸雨的主要物质是一氧化碳和二氧化碳
D.
氢气和天然气都含有碳元素,都可以作燃料
4.(3分)化学在生活中用途广泛,下列有关说法错误的是( )
A.
使用农药、化肥对人类有利也有弊
B.
合理使用加碘盐有利于碘缺乏症病人健康
C.
食用甲醛水溶液浸泡过的海产品对人体无害
D.
香烟的烟气中含有很多对人体有害的物质
5.(3分)二氧化钛(TiO2)是一种用途广泛的化工原料,用四氯化钛(TiCl4)与某常见物质X反应可制得二氧化钛,反应的化学方程式为:TiCl4+□X═TiO2+4HCl 关于物质X,下列说法正确的是( )
A.
该物质由碳、氢、氧三种元素组成
B.
该物质的化学式为H2O2
C.
该物质中氢、氧元素的质量比为1:8
D.
该物质中氧元素的质量分数是5%
6.(3分)下列有关说法正确的是( )
A.
实现CO⇌CO2的相互转化,都只有一种途径
B.
铝可以实现单质氧化物碱
C.
实现C CO2的转化,都利用了碳的可燃性
D.
实现H2OO2相互转化,化学反应的基本类型不同
7.(3分)某化学兴趣小组的同学在老师的指导下,正确完成如图所示两个实验.已知所用实验装置气密性良好.
关于该实验,有如下说法:
①红磷熄灭并冷却后才能打开弹簧夹;
②点燃酒精灯加热铜丝,可观察到铜丝由红色变成黑色;
③停止加热后即可读出注射器内气体的体积约为24mL;
④实验取用铜丝质量的多少不会影响实验结果;
⑤两个实验均能证明空气是混合物;
⑥两个实验均能证明空气中约含体积的氧气.
其中正确说法的个数有( )
A.
2个
B.
3个
C.
4个
D.
5个
8.(3分)某化学兴趣小组的同学将一枚洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面有红色的物质析出,且产生少量的气体.于是,他们重新配制硫酸铜溶液,再次实验,又观察到相同的现象.关于该实验,有如下说法:
①产生的气体可能是氢气;
②完全反应后溶液呈黄色;
③实验中一定发生了置换反应;
④由实验可以得出金属活动性顺序:Cu>Fe;
⑤硫酸铜溶液可能显酸性;
⑥重做实验没有任何意义.
其中正确说法的个数有( )
A.
2个
B.
3个
C.
4个
D.
5个
二、非选择题(本题包括5小题,共26分)
9.(4分)图一是某金属元素形成微粒的结构示意图.该金属在空气中燃烧时放出大量的热,并发出耀眼的白光.图二是该反应的微观示意图.
请根据以上信息回答问题:
(1)该金属元素原子核外电子数= _________ ;图一所示微粒的符号为 _________ ;
(2)图二所示的该金属在空气中燃烧时反应的化学方程式为 _________ .
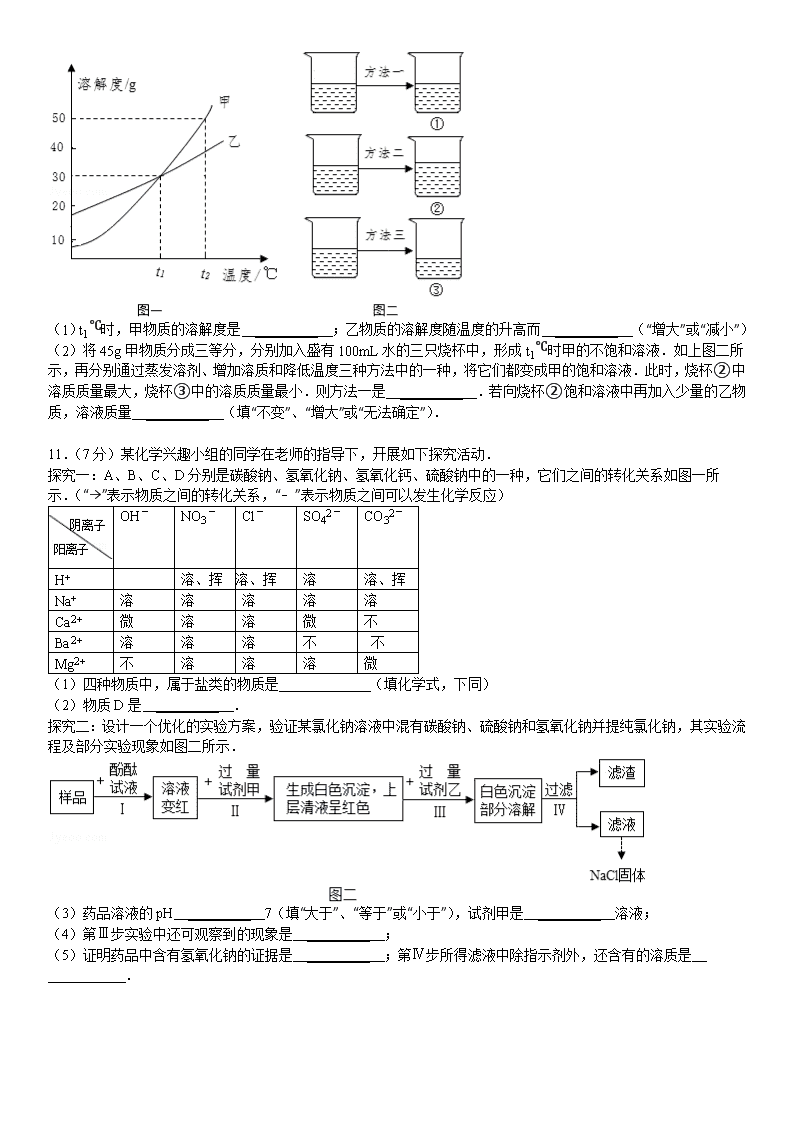
10.(4分)甲、乙两种固体物质的溶解度曲线如下图一所示.
(1)t1℃时,甲物质的溶解度是 _________ ;乙物质的溶解度随温度的升高而 _________ (“增大”或“减小”)
(2)将45g甲物质分成三等分,分别加入盛有100mL水的三只烧杯中,形成t1℃时甲的不饱和溶液.如上图二所示,再分别通过蒸发溶剂、增加溶质和降低温度三种方法中的一种,将它们都变成甲的饱和溶液.此时,烧杯②中溶质质量最大,烧杯③中的溶质质量最小.则方法一是 _________ .若向烧杯②饱和溶液中再加入少量的乙物质,溶液质量 _________ (填“不变”、“增大”或“无法确定”).
11.(7分)某化学兴趣小组的同学在老师的指导下,开展如下探究活动.
探究一:A、B、C、D分别是碳酸钠、氢氧化钠、氢氧化钙、硫酸钠中的一种,它们之间的转化关系如图一所示.(“→”表示物质之间的转化关系,“﹣”表示物质之间可以发生化学反应)
OH﹣
NO3﹣
Cl﹣
SO42﹣
CO32﹣
H+
溶、挥
溶、挥
溶
溶、挥
Na+
溶
溶
溶
溶
溶
Ca2+
微
溶
溶
微
不
Ba2+
溶
溶
溶
不
不
Mg2+
不
溶
溶
溶
微
(1)四种物质中,属于盐类的物质是 _________ (填化学式,下同)
(2)物质D是 _________ .
探究二:设计一个优化的实验方案,验证某氯化钠溶液中混有碳酸钠、硫酸钠和氢氧化钠并提纯氯化钠,其实验流程及部分实验现象如图二所示.
(3)药品溶液的pH _________ 7(填“大于”、“等于”或“小于”),试剂甲是 _________ 溶液;
(4)第Ⅲ步实验中还可观察到的现象是 _________ ;
(5)证明药品中含有氢氧化钠的证据是 _________ ;第Ⅳ步所得滤液中除指示剂外,还含有的溶质是 _________ .
12.(5分)某化学兴趣小组的同学对呼吸面具的制氧原理产生好奇心,通过查阅资料得知,呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2).过氧化钠分别能和二氧化碳、水反应,都生成氧气,反应的化学方程式为:
2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
为了测定呼吸面具中过氧化钠的质量分数,该小组的同学在老师的指导下,利用如图所示装置(固定装置一略去)开展探究,并得到正确的结论.
已知,装置B中盛有饱和NaHCO3溶液(NaHCO3不与CO2反应),碱石灰是由固体NaOH和CaO组成的混合物.整套装置气密性良好,反应所需试剂均足量.
请回答下列问题:
(1)仪器a的名称是 _________ ,装置A的作用是 _________ ;
(2)不用装置E代替装置C的理由是 _________ .
(3)装置D中过氧化钠药品的质量为m g,装置D在反应前后的总质量n1 g和n2 g.若药品中所含杂质既不溶于水也不参加化学反应,则药品中过氧化钠的质量分数= _________ .
13.(6分)将4.0g Cu﹣Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应.过滤、称量滤液的质量.相关实验数据如下:
反应前物质的质量/g
反应后物质的质量/g
Cu﹣Zn合金
稀硫酸
滤液
4.0
10
11.26
(1)Cu﹣Zn合金属于 _________ 材料(“金属”或“有机合成”)
(2)若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu﹣Zn合金中Zn的质量.写出必要的计算过程.
2014年湖北省武汉市中考化学试卷
参考答案与试题解析
一、选择题(本题包括8小题,每小题只有1个正确选项.每小题3分,共24分)
1.
解答:
解:A、将木头锯断只是分成两截,没有新物质生成,属于物理变化,故A错误;
B、铁生锈生成了主要成分是氧化铁的新物质,属于化学变化,故B正确;
C、将弯曲的弹簧拉直只是形状发生了变化,没有新物质生成,属于物理变化,故C错误;
D、水受热变成水蒸气只是状态发生了变化,没有新物质生成,属于物理边变化,故D错误.
故选:B.
2.
解答:
解:A、构成物质的微粒有分子、原子、和离子,所以原子、分子都是构成物质的微粒,故A说法正确;
B、原子、分子总是在不断地运动,故B说法正确;
C、在化学变化中分子可以再分,原子不能再分,故C说法错误;
D、根据分子的性质可知分子间有一定的间隔,故D说法正确.
由于本题选择错误的,故选:C.
3.
解答:
解:A、煤气是由一氧化碳、甲烷、氢气等物质组成的,属于混合物,故A说法正确.
B、葡萄糖是含碳元素的化合物,属于有机物,故B说法错误;
C、酸雨是指溶液pH小于5.6的雨水,造成酸雨的主要物质是二氧化硫和二氧化氮,故C说法错误;
D、氢气是由氢元素组成的,不含碳元素,故D说法错误.
故选:A.
4.
解答:
解:A、合理使用农药、化肥会提高粮食的产量,而大量使用农药、化肥会造成环境污染,故A说法正确;
B、人体缺碘易患甲状腺肿大,所以合理使用加碘盐有利于碘缺乏症病人健康,故B说法正确;
C、甲醛有毒,所以不能用食用甲醛水溶液浸泡过的海产品,故C说法错误;
D、香烟的烟气中含有很多对人体有害的物质,例如一氧化碳等,故D说法正确.
由于本题选择错误的,故选:C.
5.
解答:
解:
根据质量守恒定律的元素守恒、原子种类和个数不变,结合反应的化学方程式为:TiCl4+X═TiO2+4HCl,
推测X的化学式为H2O,则:
A、该物质由氢、氧两种元素组成,故A说法错误;
B、该物质的化学式为H2O,故B说法错误;
C、因为该物质的化学式为H2O,故该物质中氢、氧元素的质量比为1:8,故C说法正确;
D、该物质中氧元素的质量分数是=88.9%,故D说法错误.
故选:C.
6.
解答:
解:
A、一氧化碳在氧气中燃烧生成二氧化碳,与灼热的氧化铜反应生成铜和二氧化碳,物质间转化的方式不只是一种途径能实现,二氧化碳和碳高温条件下反应生成一氧化碳,故A错误;
B、金属铝与氧气反应生成氧化铝,但氧化铝与水不反应,故B错误;
C、碳在氧气中燃烧是碳的可燃性,碳和氧化铜反应是碳的还原性,故C错误;
D、水通电生成氧气是分解反应,氧气生成水,可以是化合反应,也可以是氧化反应,故D正确.
故选:D.
7.
解答:
解:①红磷燃烧并冷却后打开弹簧夹,避免了集气瓶内压强过大进入水过少,不能正确测定空气中氧气的含量的情况,故①说法正确;
②点燃酒精灯加热铜丝,铜与氧气反应生成氧化铜(2Cu+O22CuO),所以铜丝表面由光滑的红色变成黑色,故②说法正确;
③应该在停止加热并冷却至室温才能读数,故③说法错误;
④实验过程中为了将空气中的氧气完全耗尽,加入的铜丝必须是过量的,故④说法错误;
⑤两个实验均能证明空气是混合物,故⑤说法正确;
⑤两个实验均能证明空气中约含五分之一体积的氧气,故⑤说法正确.
故选C.
8.
解答:
解:①由质量守恒定律可知,溶液可能显酸性,生成的可能是氢气,故①说法正确;
②铁和硫酸铜反应生成铜和硫酸亚铁,溶液应该是浅绿色的,故②说法错误;
③铁钉放入硫酸铜溶液中,观察到铁钉表面有红色的物质析出,说明发生了铁和硫酸铜反应生成铜和硫酸亚铁的反应,属于置换反应,故③说法正确;
④铁和硫酸铜反应生成铜和硫酸亚铁的反应,说明金属活动性顺序:Fe>Cu;故④说法错误;
⑤铁钉放入硫酸铜溶液中,观察到铁钉表面有红色的物质析出,且产生少量的气体,硫酸铜溶液可能显酸性,生成的可能是氢气;故⑤说法正确;
⑥科学一定要注意严谨性,重做实验有必要,故⑥说法错误.
故选:B.
二、非选择题(本题包括5小题,共26分)
9.
解答:
解:(1)由该微粒的结构示意图可知,该金属元素原子核内质子数是12,在原子中核内质子数等于核外电子数,所以.该金属元素原子核外电子数是12;图一所示微粒是镁离子,符号为:Mg2+.
(2)由反应的微观示意图可知.该反应是镁与氧气反应生成了氧化镁,反应的化学方程式是:2Mg+O22MgO.
故答案为:(1)12,Mg2+;(2)2Mg+O22MgO.
10.
解答:
解:(1)由图可知:t1℃时,甲物质的溶解度是30g,乙物质的溶解度随温度的升高而增大;
(2)将甲的不饱和溶液变为饱和溶液,可采取蒸发溶剂、增加溶质和降低温度三种方法,其中溶质质量最大的是采取加入溶质的方法,蒸发溶剂溶液的质量减少,所以烧杯②中溶质质量最大,烧杯③中的溶质质量最小,烧杯③中总量减少,说明采取了蒸发溶剂、且析出了晶体的方法,①是采取了降温至恰好饱和的方法,因为降温溶质、溶剂质量不变,故方法一是降低温度;若向烧杯②饱和溶液中再加入少量的乙物质,溶质质量会增大,因为该饱和溶液是甲的饱和溶液,不是乙的饱和溶液,所以加入乙会继续溶解;
故答案为:(1)30g;增大;(2)降低温度;增大.
11.
解答:
解:(1)盐是由金属离子和酸根离子形成的化合物,碳酸钠是由碳酸根离子、钠离子形成,硫酸钠是由硫酸根离子和钠离子形成,氢氧化钙是由钙离子和氢氧根离子形成,氢氧化钠是由钠离子和氢氧根离子形成,所以四种物质中,属于盐类的物质是:Na2SO4、Na2CO3;
(2)A、B、C、D四种物质都溶于水,碳酸钠会与氢氧化钙反应,氢氧化钠会转化成碳酸钠、硫酸钠,氢氧化钙会与碳酸钠反应,氢氧化钙会转化成氢氧化钠,通过分析转化图可以看出D、A,D、C可以相互转化,所以D是氢氧化钠,A、C是碳酸钠或硫酸钠中的一种,A会转化成C,所以A是碳酸钠,C是硫酸钠,B就是氢氧化钙,所以物质D是:NaOH;
(3)碱性溶液可以使酚酞变红色,取样品滴入酚酞试液,溶液变红色,所以药品溶液的pH大于7,加入试剂甲后的溶液仍然显红色,说明溶液中仍含有碱性物质,含有氢氧化钠,碳酸钠和硫酸钠会与甲生成白色沉淀,又不会引入新的杂质离子,所以应该加入氯化钡溶液,试剂甲是:BaCl2溶液;
(4)沉淀部分溶解,又不会引入新的杂质,所以加入的乙是盐酸,盐酸可以和氢氧化钠发生中和反应,盐酸会与碳酸钡反应生成氯化钡、水和二氧化碳,所以第Ⅲ步实验中还可观察到的现象是:有气泡产生,上层清液由红色变成无色;
(5)碱可以使酚酞变红色,证明药品中含有氢氧化钠的证据是:第Ⅱ步加入过量氯化钡溶液后,上层清液仍为红色;
根据推导可知加入的乙是盐酸,盐酸会与碳酸钡反应,而使碳酸钡溶解生成氯化钡、水和二氧化碳,盐酸会与氢氧化钠反应生成氯化钠,盐酸是过量的,所以第Ⅳ步所得滤液中除指示剂外,还含有的溶质是:NaCl、BaCl2、HCl.
故答案为:(1)Na2SO4、Na2CO3;
(2)NaOH;
(3)大于,BaCl2;
(4)有气泡产生,上层清液由红色变成无色;
(5)第Ⅱ步加入过量氯化钡溶液后,上层清液仍为红色,NaCl、BaCl2、HCl.
12.
解答:
解:(1)由于图示可知,仪器a的名称是锥形瓶,由装置可知,装置A的作用是制取二氧化碳气体;
(2)由于装置E中的碱石灰能与二氧化碳反应,不能用装置E代替装置C.
(3)设过氧化钠的质量为x
2Na2O2+2CO2═2Na2CO3+O2 增加量
156 88 32 56
x n2g﹣n1g
解得:x=
药品中过氧化钠的质量分数为:=
故答为:(1)锥形瓶,产生实验所需的二氧化碳;(2)碱石灰还能与二氧化碳反应;(3).
13.
解答:
解:(1)Cu﹣Zn合金属于金属材料;
故答案为:金属;
(2)设铜锌合金中Zn质量为x,Cu的质量为4.0g﹣x,生成氢气的质量为x﹣1.26g
Zn+H2SO4=Zn SO4+H2↑
65 2
x x﹣1.26g
x=1.3g
答:合金中Zn的质量为1.3g.